TPX2通过p38 MAPK信号通路诱导直肠癌HR-8348细胞凋亡*
2019-01-21白国民李春耕陆庆革魏永辉赵建杰
白国民, 李春耕, 陆庆革, 魏永辉, 赵建杰
(唐山市中医医院肛肠科, 河北 唐山 063000)
直肠癌是较为常见的消化系统恶性肿瘤,寻找直肠癌有效治疗方法是重中之重[1]。非洲爪蟾驱动蛋白样蛋白2靶蛋白(targeting protein forXenopuskinesin-like protein 2,TPX2)在细胞分裂过程中发挥调控作用,可通过调控纺锤体的功能而影响细胞的生长[2]。研究显示TPX2在食管癌、乳腺癌和直肠癌等肿瘤中表达上调,与肿瘤的病理分期等具有密切关系;抑制肿瘤细胞中的TPX2表达,可使肿瘤细胞凋亡增加,增殖能力下降,但目前对于TPX2在直肠癌细胞生长和凋亡中的作用尚不明确[3-6]。已知p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在肿瘤中激活受阻,抑制其激活后可以降低肿瘤细胞的凋亡能力[7]。本研究用直肠癌细胞作为实验对象,探讨TPX2对直肠癌细胞的影响,以期为靶向治疗直肠癌提供新方向。
材 料 和 方 法
1 材料
人直肠癌细胞HR-8348购自ATCC。cDNA合成试剂盒和荧光定量PCR试剂盒均购自TaKaRa;抗TPX2抗体购自Santa Cruz Biotechnology;siRNA阴性对照(siRNA negative control, siRNA-NC)和TPX2 siRNA购自Abbexa;抗p38 MAPK抗体和抗磷酸化的p38 MAPK(p-p38 MAPK)抗体购自CST;抗cleaved caspase-3抗体和抗Bcl-2抗体购自Abcam;RNA提取试剂盒购自北京天根公司;细胞蛋白提取试剂盒购自北京索莱宝公司;Lipofectamine 2000购自Invitrogen;引物由南京金斯瑞生物科技有限公司合成。
2 方法
2.1细胞转染及分组 将HR-8348细胞分为正常对照(control)组、siRNA-NC组、TPX2 siRNA组和TPX2 siRNA+SB203580组。HR-8348细胞转染TPX2 siRNA后用20 μmol/L的p38 MAPK抑制剂SB203580处理记为TPX2 siRNA+SB203580组; siRNA-NC组和TPX2 siRNA组的细胞分别为转染siRNA-NC和TPX2 siRNA后的HR-8348细胞;control组为未经转染的HR-8348细胞。转染步骤参照Lipofectamine 2000说明书。HR-8348细胞用含有10%胎牛血清的RPMI-1640培养基培养,用0.25%的胰蛋白酶消化转染步骤简述如下:HR-8348细胞浓度调整为4×108/L,接种到6孔细胞培养板,细胞浓度为60%左右时,于细胞转染前1 h 弃去细胞培养液,加入不含血清的不完全培养液,以提高转染效率。同时将不完全培养基与siRNA-NC或TPX2 siRNA均匀混合为A液,室温下静置5 min,将Lipofectamine 2000与不完全培养基混合后为B液,取适量A液与B液充分混合后室温下放置20 min。弃细胞培养瓶中的不完全培养基,加入A液与B液的混合液,放置于37 ℃、5%CO2培养箱中孵育6 h,换液。
2.2RT-qPCR测定细胞中TPX2的mRNA水平 Control组、siRNA-NC组和TPX2 siRNA组的细胞培养24 h以后,用PBS将细胞洗涤2次,在细胞中加入TRIzol,细胞完全裂解后,在细胞中加入氯仿溶液,剧烈振荡15 s,溶液乳化以后,放在室温环境中孵育5 min。放在低温4 ℃离心30 min。溶液分为3层,RNA存在于上层溶液中,吸取上层溶液,与相等体积的异丙醇混合后,室温下静置10 min。在4 ℃离心10 min,用乙醇洗涤沉淀,在室温条件下干燥5 min,加入DEPC水将RNA溶解以后,测定A260/A280的值为1.8~2.0之间。反转录合成cDNA,荧光定量PCR测定TPX2的mRNA水平,以GAPDH为内参照。TPX2的上游引物序列为5’-GCCCTTTGTTCCCAAGAAAGA-3’,下游引物序列为5’-AGCAGTGGAATCGAGTGGAGA-3’;GAPDH的上游引物序列为5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物序列为5’-TGGTGAAGACGAAAGTGGA-3’。
2.3Western blot测定细胞中的蛋白水平 Control组、siRNA-NC组和TPX2 siRNA组的细胞培养24 h以后,收集细胞,加入蛋白裂解液,放在冰上裂解30 min以后,在4 ℃离心5 min。把上清溶液吸取到1.5 mL的EP管中,放置-20 ℃保存。BCA法对蛋白进行定量检测。用6%的浓缩胶和12%的分离胶进行SDS-PAGE,电泳条件为90 V恒压电泳约2 h。4 ℃、90 V转膜90 min。在5%牛血清白蛋白中室温孵育60 min以后,将抗TPX2的 I 抗以1∶800稀释,放在4 ℃过夜。将膜放在1∶2 000稀释的 II 抗中室温孵育90 min。用Odyssey扫描图像,半定量分析蛋白表达水平,以GAPDH为内参照。
Control组、siRNA-NC组、TPX2 siRNA组和TPX2 siRNA+SB203580组的细胞培养72 h以后,提取细胞蛋白,Western blot测定细胞中p38 MAPK、p-p38 MAPK、cleaved caspase-3和Bcl-2的蛋白水平,抗p38 MAPK、p-p38 MAPK、cleaved caspase-3和Bcl-2的I 抗均以1∶1 000稀释,步骤同上。
2.4MTT法测定细胞存活率 Control组、siRNA-NC组、TPX2 siRNA组和TPX2 siRNA+SB203580组的细胞按照每孔添加100 μL细胞悬浮液,每孔加入3 000个细胞种植到96孔细胞板中,每组设置4个复孔,孵育培养。分别在24 h、48 h和72 h在细胞中添加20 μL的MTT溶液,继续孵育4 h以后。每孔中添加150 μL的二甲基亚砜溶液,使结晶物溶解后,酶标仪测定490 nm的吸光度(A)值,分析细胞活力。
2.5流式细胞术测定细胞凋亡 Control组、siRNA-NC组、TPX2 siRNA组和TPX2 siRNA+SB203580组的细胞培养72 h以后,分别用0.25%的胰蛋白酶消化,用冰预冷的PBS重悬各组细胞,在细胞中分别依次加入膜联蛋白 V-FITC(Annexin V-FITC) 5 μL和10 μL的碘化丙啶(propidium iodide,PI)混合均匀以后,放在室温条件下孵育15 min。用流式细胞术测定细胞凋亡。
3 统计学分析
所有实验数据采用SPSS 21.0软件进行分析。计量资料用均数±标准差(mean±SD)表示,两组数据采用独立样本t检验,多组差异比较采用单因素方差分析,组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 TPX2 siRNA转染直肠癌HR-8348细胞后TPX2的表达
siRNA-NC组的细胞中TPX2的mRNA和蛋白水平与control组相比,差异没有统计学显著性;TPX2 siRNA组的细胞中TPX2的mRNA和蛋白水平与control组相比明显降低(P<0.05),说明转染TPX2 siRNA可以降低直肠癌细胞中TPX2的表达,见图1、2。
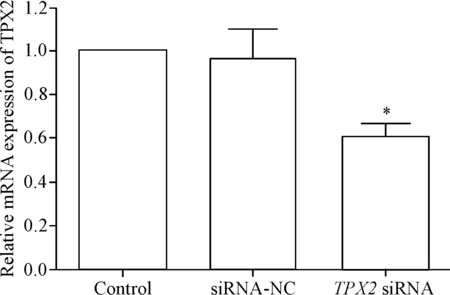
Figure 1.The mRNA expression level of TPX2 in transfected rectal cancer HR-8348 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图1转染后直肠癌细胞中TPX2的mRNA表达水平
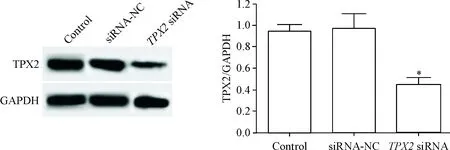
Figure 2.The protein expression level of TPX2 in transfected rectal cancer HR-8348 cells determined by Western blot. Mean±SD.n=3.*P<0.05vscontrol group.
图2TPX2蛋白在转染后直肠癌细胞中的表达水平
2 敲减TPX2表达对HR-8348细胞存活率的影响
siRNA-NC组的细胞在24、48和72 h测定的A值与control组相比没有明显变化,差异没有统计学显著性;TPX2 siRNA组的细胞在24、48和72 h的A值与control组相比明显降低(P<0.05),说明下调TPX2抑制直肠癌细胞HR-8348细胞的活力,见图3。
3 敲减TPX2表达对HR-8348细胞凋亡的影响
siRNA-NC组的细胞凋亡率及cleaved caspase-3和Bcl-2的蛋白水平与control组相比没有明显变化,差异没有统计学显著性;TPX2 siRNA组的细胞凋亡率及cleaved caspase-3的蛋白水平与control组相比明显升高,而Bcl-2蛋白水平明显降低(P<0.05),说明下调TPX2可诱导caspase-3和Bcl-2介导的直肠癌HR-8348细胞凋亡,见图4、5。
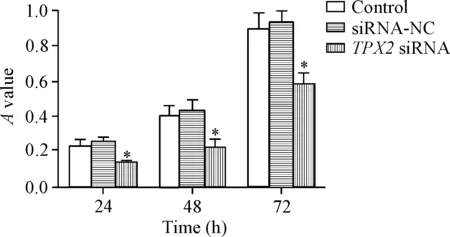
Figure 3.Knockdown ofTPX2 expression reduced the viability of rectal cancer HR-8348 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3TPX2表达下调降低细胞存活率
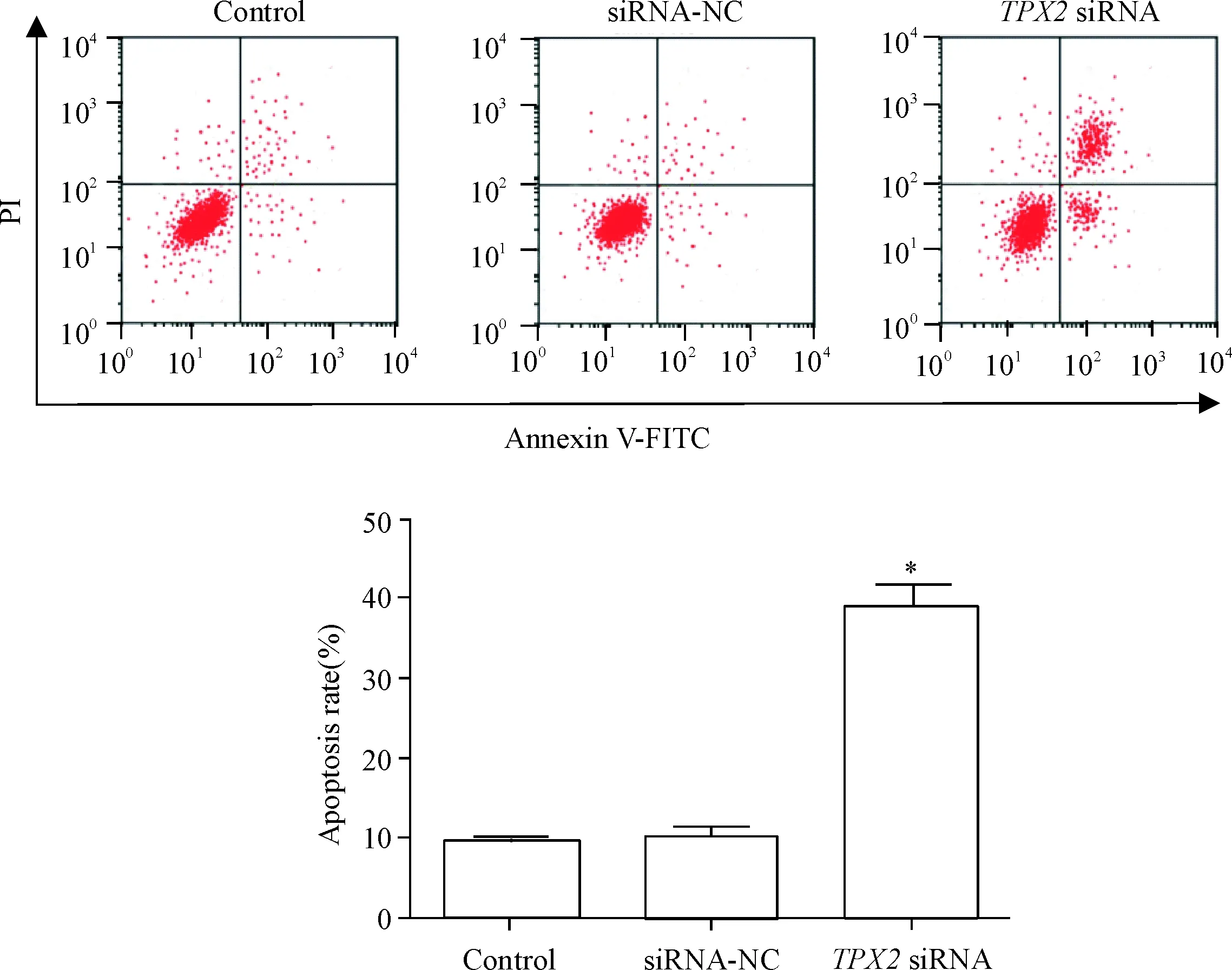
Figure 4.Knockdown ofTPX2 expression induced apoptosis of rectal cancer HR-8348 cells (analyzed by flow cytometry). Mean±SD.n=3.*P<0.05vscontrol group.
图4流式细胞术检测敲减TPX2表达对直肠癌HR-8348细胞凋亡的影响
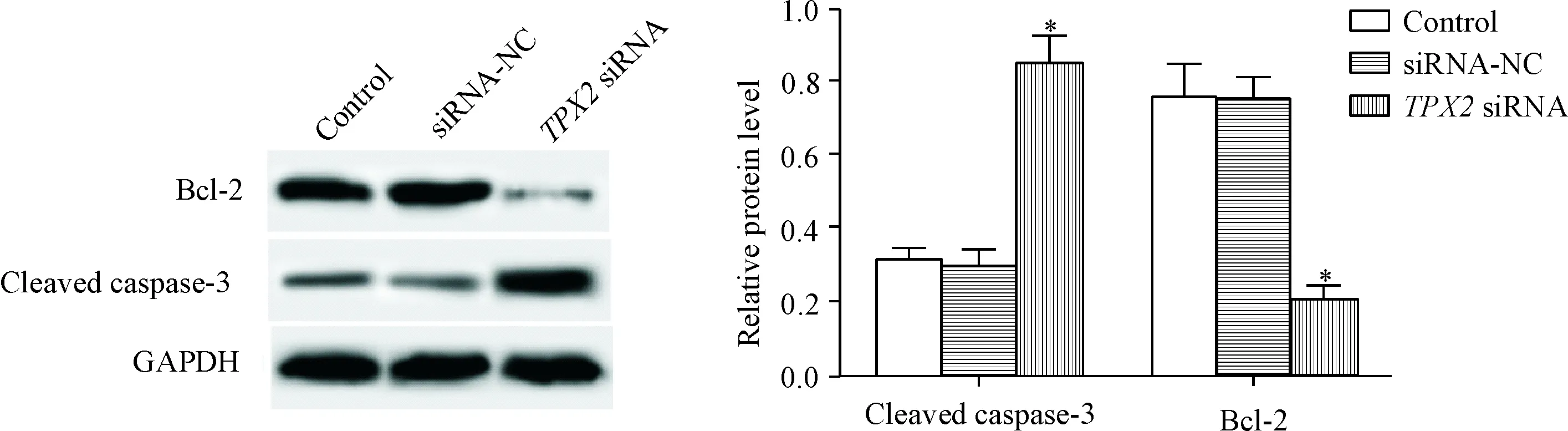
Figure 5.Knockdown ofTPX2 expression increased the protein level of cleaved caspase-3 and decreased the protein expression of Bcl-2 in the rectal cancer HR-8348 cells (determined by Western blot). Mean±SD.n=3.*P<0.05vscontrol group.
图5TPX2表达下调增加直肠癌HR-8348细胞中cleavedcaspase-3的蛋白水平,减少Bcl-2蛋白表达
4 敲减TPX2表达对HR-8348细胞中p38 MAPK和p-p38 MAPK蛋白水平的影响
siRNA-NC组的p-p38 MAPK/p38 MAPK水平与control组相比没有明显变化,差异没有统计学显著性;TPX2 siRNA组的p-p38 MAPK/p38 MAPK水平与control组相比明显升高(P<0.05),说明下调TPX2可诱导直肠癌细胞p38 MAPK磷酸化,促进细胞中p38 MAPK信号通路激活,见图6。
5 p38 MAPK抑制剂对HR-8348细胞活力的影响
TPX2 siRNA+SB203580组的细胞在24、48和72 h的A值与TPX2 siRNA组相比明显升高(P<0.05),说明p38 MAPK抑制剂可以减弱TPX2下调对直肠癌细胞生长的抑制作用,见图7。
6 p38 MAPK抑制剂对HR-8348细胞凋亡的影响
TPX2 siRNA+SB203580组的细胞凋亡率、cleaved caspase-3水平和p-p38 MAPK/p38 MAPK水平与TPX2 siRNA组相比明显降低(P<0.05),说明p38 MAPK抑制剂可以减弱TPX2下调诱导的直肠癌细胞凋亡,见图8、9。
Figure 6.Knockdown ofTPX2 expression induced p38 MAPK phosphorylation in the rectal cancer HR-8348 cells (determined by Western blot). Mean±SD.n=3.*P<0.05vscontrol group.
图6敲减TPX2表达诱导直肠癌HR-8348细胞中p38MAPK磷酸化
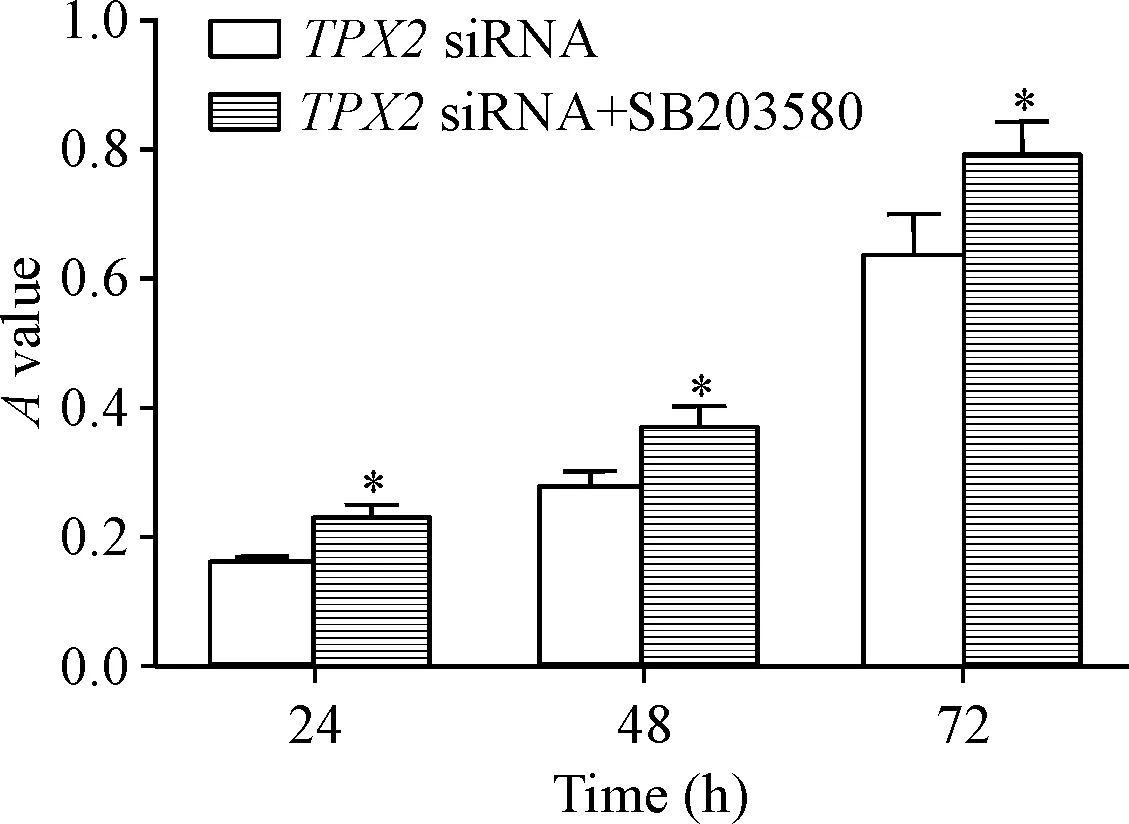
Figure 7.p38 MAPK inhibitor SB203580 antagonized the effect ofTPX2 knockdown on the viability of rectal cancer HR-8348 cells (measured by MTT assay). Mean±SD.n=3.*P<0.05vsTPX2 siRNA group.
图7p38MAPK抑制剂SB203580拮抗TPX2下调对细胞活力的影响
讨 论
TPX2属于微管蛋白,其基因在人类染色体上定位于20q11.2,该蛋白质由747个氨基酸组成,在哺乳动物的有丝分裂中发挥作用[8-10]。纺锤体的形成发生于中心体开始分裂之后,并且与MT相关蛋白功能的调控有关,这种调控作用是可逆的,TPX2经过动力蛋白与肌动蛋白联合作用后存在于纺锤体两极上,当细胞发生有丝分裂时,可以通过微管依赖的方法发生磷酸化,在细胞进入分裂后期以后,又可以从纺锤体的两极转移到中间体[11]。TPX2参与肿瘤的发生,在肿瘤中其表达水平升高后可以促进中心体的数量增多,形成异倍体,在正常的细胞核分裂中发挥调控作用[12-13]。

Figure 8.p38 MAPK inhibitor SB203580 antagonized the effect of TPX2 down-regulation on the apoptosis of rectal cancer HR-8348 cells (analyzed by flow cytometry). Mean±SD.n=3.*P<0.05vsTPX2 siRNA group.
图8p38MAPK抑制剂SB203580拮抗TPX2下调对细胞凋亡的影响
肿瘤的发生与细胞恶性增殖、凋亡减少有关,在这些过程中癌基因的表达上调起到关键作用,TPX2作为有丝分裂的调控基因,其表达异常后可以引起染色体异常等现象,降低基因组的稳定性,从而引起肿瘤的发生[14-15]。已经有研究显示,TPX2在肺癌细胞和支气管上皮细胞中的表达水平不同,在肺鳞癌和正常气管上皮细胞中表达水平逐渐降低[16];还有研究显示,TPX2在食管癌中的表达水平升高,并且与食管癌的转移、病理分期等有关[17];刘洁等[18]的研究显示,TPX2在结直肠正常黏膜组织、不典型增生组织及癌组织中的水平依次升高,并且与淋巴结转移、临床分期、病理分级等呈正相关。
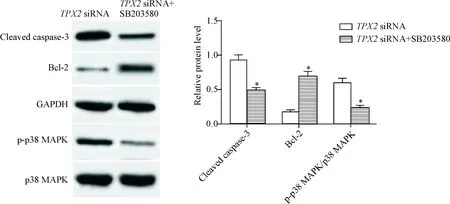
Figure 9.p38 MAPK inhibitor SB203580 antagonized the effect of TPX2 down-regulation on the protein levels of p38 MAPK, p-p38 MAPK, cleaved caspase-3 and Bcl-2 in the rectal cancer HR-8348 cells (determined by Western blot). Mean±SD.n=3.*P<0.05vsTPX2 siRNA group.
图9p38MAPK抑制剂SB203580拮抗TPX2下调对细胞中p38MAPK、p-p38MAPK、cleavedcaspase-3和Bcl-2蛋白水平的影响
本实验结果显示,在直肠癌细胞中下调TPX2转录和表达后,细胞的存活率降低,细胞的凋亡率升高,细胞中caspase-3活化水平也升高,Bcl-2水平降低,说明TPX2表达下调可以抑制直肠癌细胞的生长,诱导细胞凋亡,发挥抗肿瘤作用。Bcl-2是抗凋亡蛋白,在肿瘤组织中表达上调,其属于Bcl-2蛋白家族的成员之一,其表达上调后可以抑制细胞凋亡发生[19-20]。Caspase-3是caspase级联反应中的凋亡执行因子,其活化后发挥凋亡促进作用,在肿瘤组织中表达下调[21]。
p38 MAPK是MAPK信号通路的重要分支,其磷酸化水平升高后可以促进细胞凋亡的发生,在肿瘤组织中的磷酸化水平异常降低[22]。p38 MAPK与细胞的增殖、凋亡等多种生物学特性的发挥有关,是一种重要的细胞内信号转导通路,p38 MAPK抑制剂可以促进肿瘤细胞的生长,抵抗细胞凋亡发生[23-24]。有研究显示,TPX2在乳腺癌中通过调控下游信号通路p38 MAPK的激活影响乳腺癌细胞的生长和凋亡情况[25]。本实验结果显示,TPX2表达下调后细胞中p38 MAPK磷酸化水平升高,用p38 MAPK抑制剂处理下调TPX2的直肠癌细胞后,细胞凋亡减少,细胞活力升高,抑制p38 MAPK信号通路可以减弱TPX2表达下调对直肠癌细胞生长和凋亡的影响。
TPX2在直肠癌发生中发挥重要作用,其表达下调可以抑制直肠癌细胞的生长,促进直肠癌细胞凋亡,其作用机制与激活下游p38 MAPK信号通路有关,TPX2与p38 MAPK信号通路具体的作用机制尚不清楚。TPX2可能是治疗直肠癌的潜在靶点。本研究为以后研究直肠癌的发病机制提供了理论基础,为探讨TPX2在肿瘤中的作用提供了重要依据。在后续实验中我们将对TPX2在多种直肠癌细胞中的作用进行验证。
