缺氧条件下HMGB1对HepG2细胞线粒体功能的影响*
2019-01-21贺兴波郑弘毅杨建芬任精华
贺兴波, 郑弘毅, 杨建芬, 刘 瑶△, 任精华
(1赣南医学院第一附属医院, 2赣南医学院, 江西 赣州 341000; 3华中科技大学同济医学院附属协和医院肿瘤中心, 湖北 武汉 430022)
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种高度恶性的肿瘤,其典型特点是增殖速度快、侵袭性强,肿瘤血供往往不能满足生长所需, 由此使得肝癌细胞处于低氧和营养物质缺乏的应激微环境中[1]。充足的能量供应是肝癌细胞在此应激环境中无限增殖、浸润和转移的前提和必要条件[2]。线粒体是细胞的能量工厂,在线粒体自噬、分裂/融合和线粒体生物合成的协同作用下,限制和延缓功能受损线粒体的积累,可达到对线粒体的质量控制(mitochondrial quality control)[3]。高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)是一种非组蛋白DNA结合蛋白,除了通过调控细胞周期、促进肿瘤新生血管生成和肿瘤转移参与肝癌发病外,还可诱导线粒体自噬[4],调节肿瘤能量代谢,参与肝癌发病。我们采用RNA干扰技术下调肝癌细胞HMGB1的表达,观察缺氧环境下细胞线粒体功能的变化并从线粒体生物合成角度探讨其可能的机制,为阐明HMGB1如何调控肝癌生长提供一个新视点。
材 料 和 方 法
1 细胞株
人肝癌HepG2细胞购自ATCC,传代并液氮保存于赣南医学院第一附属医院临床医学研究中心。
2 主要试剂和仪器
RPMI-1640培养液和胎牛血清(Gibco);Lipofectamine®2000(Invitrogen);HMGB1小干扰RNA(HMGB1 small interfering RNA,HMGB1-siRNA)及阴性对照siRNA(negative control siRNA, siRNA-NC; Cat#stQ0002758-1)(锐博生物科技有限公司);MitoSOXTMRed Mitochondrial Superoxide Indicator(Thermo Fisher Scientific);增强型ATP检测试剂盒(Cat#S0027)、线粒体膜电位检测试剂盒(JC-1; Cat# C2006)和基因组DNA小量抽提试剂盒(Cat#D0063)(碧云天生物技术研究所);抗过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)辅助激活因子1α(PPARγ coactivator-1α,PGC-1α)抗体(Cat#ab54481)和线粒体转录因子A(mitochondrial transcription factor A,TFAM)抗体(Cat#ab131607)(Abcam);抗核呼吸因子1(nuclear respiratory factor 1,NRF1)(Cat#46743)抗体(Cell Signaling Technology);抗β-actin抗体(Cat#5441)(Sigma);DNA凝胶回收试剂盒(Cat#AP-GX-50)(AXYGEN);ChamQ SYBR qPCR Master Mix(Cat#Q311-02/03)(诺唯赞生物科技有限公司);BCA蛋白定量检测试剂盒(Cat#BCA-02)(鼎国昌盛生物技术有限公司)。CO2-N2-O2三气培养箱(Eppendorf); NanoDrop微量分光光度计(Thermo Fisher Scientific)。
3 主要方法
3.1细胞培养和转染 HepG2细胞在含10%胎牛血清的RPMI-1640培养基(含1×105U/L青霉素和100 mg/L链霉素)中培养,37 ℃、5% CO2及饱和湿度条件下培养于6 cm细胞皿(每皿8×105个细胞),每3 d传代1次。细胞随机分为HMGB1-siRNA1/2/3干扰组、阴性对照组和空白对照组,待细胞融合度为30%~50%时,按Lipofectamine® 2000说明书操作转染50 nmol/L HMGB1-siRNA和siRNA-NC,4 h后更换新鲜的完全培养基,在37 ℃、5% CO2及饱和湿度条件下培养24~72 h,采用RT-qPCR和Western blot检测转染细胞中HMGB1的mRNA和蛋白表达水平,筛选具有最佳沉默效果的干扰组用于后续实验。
3.2实验分组 实验分为缺氧(hypoxia)组:细胞在缺氧条件(1% O2+5% CO2+94% N2)下培养;Hypoxia+HMGB1-siRNA组:常氧培养条件下,待细胞融合度为30%~50%时,转染50 nmol/L HMGB1-siRNA,4 h后更换新鲜的完全培养基培养24 h后转入缺氧培养箱培养24 h;Hypoxia+siRNA-NC组:常氧培养条件下,待细胞融合度为30%~50%时,转染50 nmol/L negative control siRNA,4 h后更换新鲜的完全培养基培养24 h后转入缺氧培养箱培养24 h。
3.3流式细胞术检测细胞线粒体活性氧簇(reactive oxygen species,ROS)水平 用13 μL 的DMSO溶解MitoSOX red,制成5 mmol/L储存液于-20 ℃避光保存,染色时用PBS将储存液稀释成5 μmol/L的工作液。各组细胞加入1 mL MitoSOX red工作液,37 ℃避光孵育10 min后,PBS洗涤细胞,用不含EDTA的胰酶消化收集细胞,PBS重悬细胞后上流式细胞仪检测。
3.4流式细胞术检测线粒体膜电位(Ψm)水平 PBS洗涤各组细胞,用不含EDTA的胰酶消化收集细胞,重悬于0.5 mL细胞培养液中,加入0.5 mL JC-1染色工作液,颠倒数次混匀,37 ℃孵育20 min。孵育期间配制JC-1染色缓冲液,冰浴备用。孵育结束后,4 ℃、600×g离心4 min,弃上清。用JC-1染色缓冲液重悬、洗涤细胞,4 ℃ 600×g离心4 min,弃上清,用500 μL PBS重悬细胞后上流式细胞仪检测。
3.5RT-qPCR检测线粒体DNA(mitochondrial DNA,mtDNA)拷贝数 选择mtDNA特异性的编码基因COXI作为检测基因,以该基因与核基因18sRNA内参照的相对表达量作为线粒体基因拷贝数的衡量指标。提取细胞全基因组DNA,NanoDrop分光光度计测定DNA浓度,-20 ℃保存备用。SYBR Green法分别扩增COXI和18sRNA,COXI的上游引物序列为5’-ACTAACAGACCGCAACCTCAAC-3’,下游引物序列为5’-TCCGAAGCCTGGTAGGATAAG-3’;18sRNA的上游引物序列为5’-CAGCCACCCGAGATTGAGCA-3’,下游引物序列为5’-TAGTAGCGACGGGCGGTGTG-3’。扩增产物行经琼脂糖凝胶电泳回收,NanoDrop测定DNA浓度, 计算标准品拷贝数=6.02×1014×标准品浓度(mg/L)/(DNA片段长度×660)。以无菌去离子水2倍倍比梯度稀释18sRNA和COXI标准品,ABI7500荧光定量PCR仪上进行不同梯度浓度的标准品COXI和18sRNA的扩增, 以标准品拷贝数的对数值为横坐标,以对应CT值为纵坐标,绘制标准曲线。将每个样本COXI基因所得CT均值带入标准曲线算出拷贝数MX,将18sRNA内参照所得CT均值经标准曲线法计算得出拷贝数MP,最终算得该样本的mtDNA相对拷贝数变化为n=MX/MP。
3.6ATP检测试剂盒测定细胞内ATP生成量 各组细胞加入裂解液于冰上裂解,4 ℃、12 000×g离心5 min,取10 μL上清测蛋白浓度并将各样品浓度调至均一,剩余上清冰浴备用。黑色96孔板内每孔加入100 μL ATP检测工作液,室温放置3~5 min,再加入50 μL待测样品(每组设3组平行孔)。按试剂盒要求配制ATP标准品,使用Thermo Scientific Varioskan LUX多功能微孔板读数仪选择Luminometer模块检测各组细胞的荧光强度,绘制标准曲线,计算ATP生成量。
3.7Western blot法检测细胞线粒体生物合成相关蛋白表达的变化 按试剂盒要求提取各组细胞总蛋白并定量。取40 μg总蛋白变性5 min,进行SDS-PAGE,按照Marker切去需要的凝胶转移至PVDF膜上。用5% BSA室温封闭1 h,加入特异性 I 抗(浓度均为1∶1 000),4 ℃孵育过夜;室温TBST漂洗4次,每次15 min;加入II抗(1∶10 000),37 ℃孵育1 h,室温漂洗4次,每次15 min。反应信号经化学荧光底物发光,X线胶片曝光。使用ImageJ软件对结果进行灰度分析, 测定目的条带和内参照β-actin的灰度值,结果以样本灰度值/内参照灰度值表示。
4 统计学处理
所有实验结果均由3次重复实验得出,采用SPSS 17.0软件进行统计分析。定量资料以均数±标准差(mean±SD)表示,两组间均数比较采用两独立样本t检验,多组间均数比较采用单因素方差分析(one-way ANOVA),当方差分析结果有统计学意义时,再采用SNK-q法行多重比较,以P<0.05为差异有统计学意义。
结 果
1 HMGB1-siRNA对HMGB1的mRNA和蛋白表达的影响
RT-qPCR检测结果显示,干扰组HMGB1的mRNA表达水平较空白对照组和阴性对照组均有不同程度的下降,以HMGB1-siRNA3组下降最为明显(P<0.05),两对照组间的差异无统计学显著性,见图1A。Western blot结果显示,干扰组的HMGB1蛋白表达水平较空白对照组和阴性对照组均有不同程度下降,以HMGB1-siRNA3组的抑制效果最强(P<0.05),见图1B。结果表明HMGB1-siRNA可有效抑制肝癌细胞HepG2中HMGB1的mRNA和蛋白表达水平,同时选取HMGB1-siRNA3干扰序列用于后续实验。
2 HMGB1对HepG2细胞线粒体活性氧簇水平的影响
流式细胞术检测结果显示,hypoxia+HMGB1-siRNA组细胞的MitoSox平均荧光强度明显高于hypoxia组(P<0.01)和hypoxia+siRNA-NC组(P<0.01),hypoxia组和hypoxia+siRNA-NC组相比较,差异无统计学显著性,见图2。
3 HMGB1对HepG2细胞线粒体膜电位的影响
流式细胞术检测结果显示,hypoxia+HMGB1-siRNA组的JC-1由红色向绿色转变明显增多,即红/绿荧光的相对比例下降至3.06±0.27,膜电位明显低于hypoxia组(15.85±5.44,P<0.01)和hypoxia+siRNA-NC组(15.20±2.17,P<0.05);hypoxia组和hypoxia+siRNA-NC组相比较,差异无统计学显著性,见图3。
4 HMGB1对HepG2细胞mtDNA拷贝数的影响
Hypoxia+HMGB1-siRNA组细胞的COXI mRNA表达水平明显低于hypoxia组和hypoxia+siRNA-NC组(P<0.05),hypoxia组和hypoxia+siRNA-NC组相比较无明显差异,见图4。
5 HMGB1对HepG2细胞ATP生成量的影响
Hypoxia+HMGB1-siRNA组细胞的ATP生成量明显低于hypoxia组(P<0.01)和hypoxia+siRNA-NC组(P<0.01),hypoxia组和hypoxia+siRNA-NC组相比较,差异无统计学显著性,见图5。
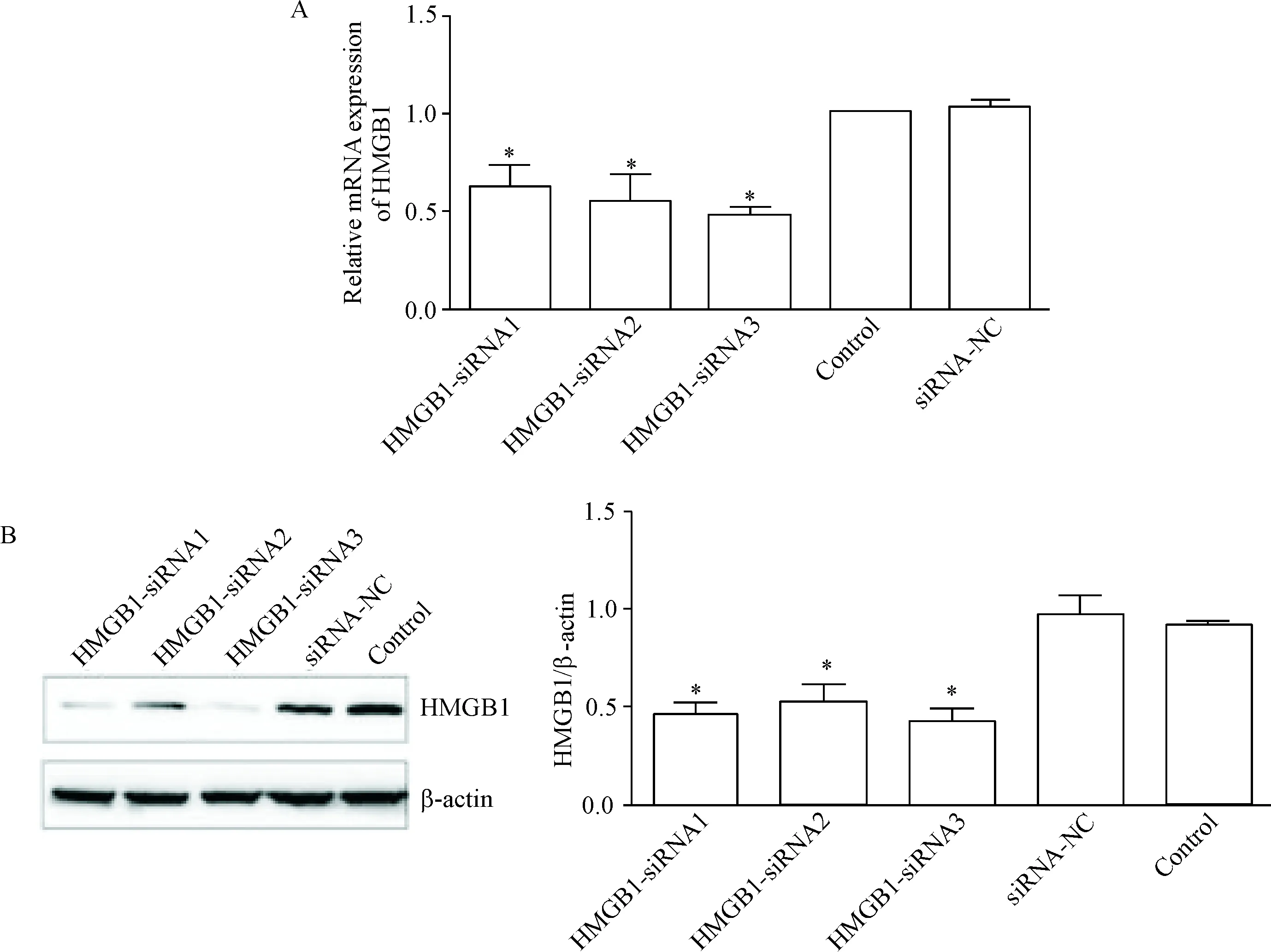
Figure 1.The effect of HMGB1-siRNA transfection on the expression of HMGB1 at mRNA and protein levels in the HepG2 cells. A: the mRNA expression of HMGB1 detected by RT-qPCR; B: the protein expression of HMGB1 detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group and siRNA-NC group.
图1HMGB1-siRNA对HMGB1mRNA和蛋白表达的影响
6 HMGB1对HepG2细胞线粒体生物合成相关蛋白表达的影响
Western blot结果显示,hypoxia+HMGB1-siRNA组的线粒体生物合成相关蛋白PGC-1α、NRF1和TFAM的相对表达量均明显低于hypoxia组(P<0.01)和hypoxia+siRNA-NC组(P<0.05);hypoxia组和hypoxia+siRNA-NC组相比较,差异无统计学显著性,见图6。
讨 论
线粒体生物合成是细胞在发育、运动[5]、饥饿、炎症、缺氧和能量限制等刺激下,新生线粒体形成以维持及恢复线粒体结构、数量与功能的一个动态过程[6],它和线粒体自噬和线粒体分裂/融合共同调节,保持细胞内线粒体数量、形态和功能的动态平衡[7-8]。PGC-1α是线粒体生物合成最重要的调节因子[9],PPARs、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和环磷酸腺苷(cyclic adenosine monophosphate,cAMP)反应元件结合蛋白等可诱导PGC-1α的转录激活[10]。除此以外,能量感受器AMP活化的蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)介导的磷酸化修饰、乙酰转移酶GCN5介导的乙酰化及NAD+依赖的沉默信息调节因子1(silent information regulator 1,SIRT1)介导的去乙酰化修饰也可影响PGC-1α的亚细胞定位调控其活性。激活的PGC-1α转位至胞核与NRF1结合后,转录激活TFAM的表达,维持细胞内正常线粒体的数量并增强线粒体呼吸链氧化磷酸化功能,平衡能量供应,满足肿瘤细胞快速增殖的代谢需求[11]。
HMGB1是一种高丰度的细胞核非组蛋白DNA结合蛋白,其既可在正常生命活动中发挥作用,也在许多病理现象中充当重要角色[12]。核内的HMGB1参与稳定核小体、易化基因转录表达和调控等多种细胞生命活动;在血供/氧供不足、营养缺乏、炎症和氧化应激等刺激因素的作用下,经甲基化、乙酰化、磷酸化和ADP核糖基化等蛋白质翻译后修饰的HMGB1从细胞核转位至细胞浆,激活自噬抑制凋亡;HMGB1还可由受刺激的免疫细胞主动分泌或由损伤、坏死细胞被动释放到细胞外,与其受体——晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)和Toll样受体2/4(Toll like receptor 2/4,TLR2/4)等结合从而引发胞内信号转导,调控炎症反应、启动适应性免疫应答及激活肿瘤细胞修复和增殖、分化和再生机制[13]。

Figure 2.The effect of HMGB1 on mitochondrial superoxide level in HepG2 cells. A: HepG2 cells were divided into 3 groups, and then stained with MitoSox red and analyzed by flow cytometry; B: the quantitative analysis of A. Mean±SD.n=3.*P<0.05vshypoxia group and hypoxia+siRNA-NC group.
图2HMGB1对HepG2细胞线粒体活性氧簇水平的影响
研究发现,HMGB1在肝癌的发病过程中扮演癌基因的角色[14],其参与肝癌发病的可能机制有:(1)增加细胞周期蛋白D1和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)的表达,诱导肝癌细胞增殖[15];(2)与RAGE结合导致HCC中新生血管生成[16];(3)与胞浆内的beclin-1结合,诱导肝癌细胞保护性自噬[17];(4)释放至胞浆的HMGB1与mtDNA结合,通过激活TLR9信号通路,诱导肝癌生长[18];(5)抑制基质金属蛋白酶(matrix metalloproteinases,MMP)的抑制剂:伴有kazal基序富含半胱氨酸的逆转诱导蛋白(reversion-inducing cysteine-rich protein with Kazal motif,RECK)和组织基质金属蛋白酶抑制因子3(tissue inhibitors of metalloproteinase 3,TIMP3),诱导MMP的表达从而促进肝癌转移[19]。
HMGB1能否通过调节肝癌细胞能量代谢发挥促癌作用,目前国内外文献报道不多。Tang等[4]的研究指出,核内HMGB1是热休克蛋白β-1(heat shock protein beta-1,HSPB1)的转录调节因子,后者有稳定线粒体还原内稳态和提高葡萄糖6磷酸脱氢酶的作用,15、86位丝氨酸磷酸化的HSPB1还能调控细胞微丝骨架的聚合和重构。无论缺失HMGB1还是HSPB1,都将导致细胞微丝骨架发生异常,影响线粒体自噬关键分子Parkin的线粒体转位和线粒体外膜电压依赖阴离子通道1(voltage-dependent anion-selective channel protein 1,VDAC1)的泛素化,最终抑制胞内线粒体自噬体的组装和转运,细胞表现为线粒体片段化,有氧呼吸和ATP产生减少,肿瘤增殖受限。
鉴于HMGB1可以通过诱导线粒体自噬,清除功能受损的线粒体,参与肿瘤能量代谢,我们认为有必要研究HMGB1能否通过调控线粒体的生物合成,使肿瘤细胞在应激环境刺激下保持线粒体功能的正常行使,产生充足能量供肿瘤快速增殖。本文中我们采用功能缺失策略分析缺氧环境下HMGB1对线粒体功能和线粒体生物合成的影响,结果显示与hypoxia组和hypoxia+siRNA-NC组相比,缺氧环境下,当HMGB1表达被抑制后,细胞线粒体活性氧簇含量明显升高,线粒体膜电位、mtDNA拷贝数和ATP产生量明显下降,且线粒体生物合成相关蛋白表达有一定程度下降,该结果和我们前期体外实验发现靶向干扰HMGB1后,肝癌细胞在缺氧环境下增殖速度和克隆形成率明显降低及PGC-1α的表达被抑制[11],以及体内实验发现腹腔注射化学诱癌剂二乙基亚硝胺后,肝脏组织特异性敲除HMGB1小鼠的肝癌发生率和肿瘤组织内PGC-1α表达量明显下降,生存期显著延长具有相同的趋势[20]。
综上所述,本研究初步发现缺氧环境下HMGB1通过影响线粒体生物合成,诱导新生线粒体形成并维持应激环境下细胞线粒体的正常功能,但HMGB1是否通过影响PGC-1α的胞内定位及翻译后修饰发挥上述作用有待进一步研究。
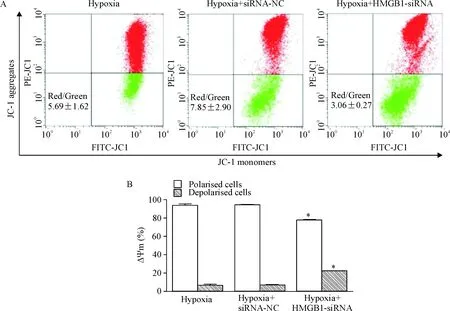
Figure 3.The effect of HMGB1 on mitochondrial membrane potentials in HepG2 cells detected by JC-1 staining. A: HepG2 cells were divided into 3 groups, and then incubated with the JC-1 dye and analyzed by flow cytometry. Representative dot plots: J-aggregated red fluorescence (polarized cells); JC-1 monomer green fluorescence (depolarized cells); B: the quantitative analysis of A. Mean±SD.n=3.*P<0.05vshypoxia group and hypoxia+siRNA-NC group.
图3JC-1检测HMGB1对HepG2细胞线粒体膜电位的影响
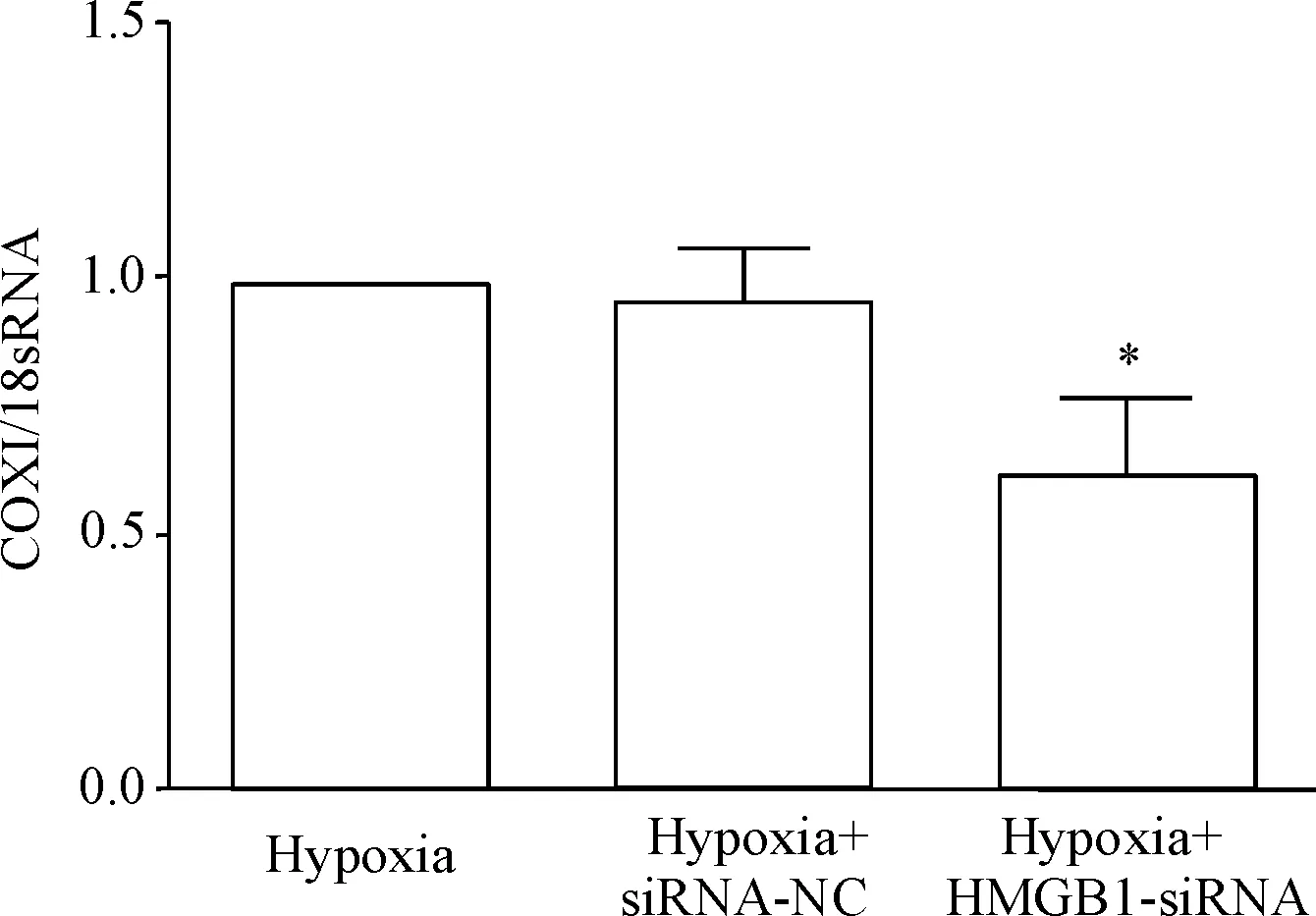
Figure 4.The effect of HMGB1 on the copy number of mitochondrial DNA in the HepG2 cells detected by RT-qPCR. Mean±SD.n=3.*P<0.05vshypoxia group and hypoxia+siRNA-NC group.
图4RT-qPCR检测HMGB1对HepG2细胞线粒体DNA拷贝数的影响

Figure 5.The effect of HMGB1 on intracellular ATP production in the HepG2 cells. The cellular ATP concentration was measured by bioluminescence assay. Mean±SD.n=3.*P<0.05vshypoxia group and hypoxia+siRNA-NC group.
图5HMGB1对HepG2细胞ATP生成量的影响
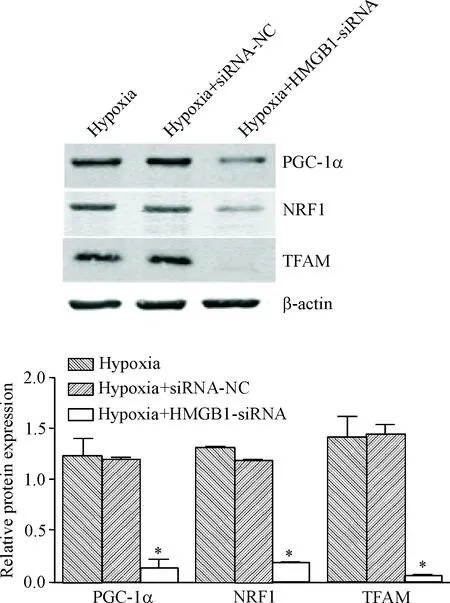
Figure 6.The effects of HMGB1 on the protein expression of mitochondrial biogenesis associated molecules. Mean±SD.n=3.*P<0.05vshypoxia group and hypoxia+siRNA-NC group.
图6Westernblot检测HMGB1对线粒体生物合成相关蛋白表达的影响
