丹参酮IIA通过JNK通路诱导人骨肉瘤HOS细胞凋亡*
2019-01-21陆建红黄晓文金益军杨彦楠吴奕征
陆建红, 黄晓文▲, 金益军, 杨彦楠, 吴奕征
(武警浙江省总队医院 1检验科, 2重症监护科, 浙江 嘉兴 314000;3浙江大学医学院附属邵逸夫医院骨科, 浙江 杭州 310016)
骨肉瘤好发于少年儿童,预后差,病死率高[1]。随着外科手术与新辅助化疗的联合应用,大多数患者实现了保肢[2],但仍有远处转移和复发者,5年生存率无法超过70%[3]。此外,化疗药物及一些新型靶向药的使用,也增加了对患者的毒副作用[4]。因此,寻找新型有效的骨肉瘤治疗药物,提高远期缓解率,成为临床工作中亟待解决的问题之一。丹参酮IIA(tanshinone IIA)良好的抗氧化与抑制炎症反应的能力已被证实[5],并能促进部分肿瘤细胞凋亡或自噬,诱导相关癌基因表达变化,进而抑制肿瘤生长[6-9],但对人骨肉瘤细胞系HOS的作用,目前尚无相关文献报道。本研究应用CCK-8实验、集落形成实验、细胞迁移实验、荧光显微镜技术、电镜、蛋白质印迹法(Western blot)及流式细胞术等方法,探讨不同浓度丹参酮IIA对HOS细胞增殖的抑制作用及其相关机制,为进一步探究该药作为骨肉瘤治疗药物的可能性提供依据。
材 料 和 方 法
1 材料
丹参酮IIA(纯度>99%)和SP600125购自Sigma;CCK-8试剂盒、结晶紫染色液和Hoechst 33258染液购自江苏碧云天生物技术公司;Transwell细胞培养小室购自Corning;Annexin V-FITC/PI凋亡试剂盒购自BD;抗cleaved caspase-3、Bcl-2、Bax和p-JNK等抗体均购自Abcam。
2 细胞培养
人骨肉瘤细胞系HOS购自美国菌种保藏中心(American Type Culture Collection,ATCC),细胞培养于DMEM高糖培养液 (含10% 四季青胎牛血清、1×105U/L青霉素和100 mg/L链霉素), 37 ℃、5% CO2孵箱内培养。
3 主要方法
3.1CCK-8实验检测细胞活力 取指数生长期HOS细胞,按每孔3 000个的细胞密度接种于96孔板,每孔补足DMEM高糖培养液至100 μL,增设只加培养液的阴性对照孔。待12 h细胞完全贴壁后,分别加入不同浓度的丹参酮IIA,使终浓度为10、20和30 μmol/L,每个浓度设置5个复孔。于加药24 h和48 h后每孔分别加入10 μL CCK-8检测溶液终止培养。将96孔板于37 ℃孵育4 h后振荡,使用酶标仪在450 nm波长下检测各孔的吸光度(A)值。细胞抑制率(%)=(1-实验组吸光度值/对照组吸光度值)×100%。结合剂量效应关系计算半数抑制浓度(IC50)。
3.2集落形成实验 细胞按单克隆铺于6孔板上,待第2天贴壁后加入相应浓度的药物处理,约7 d后用PBS洗涤3次,4%多聚甲醛固定15 min,再用PBS洗涤1次。加入0.1%的结晶紫染液染色20 min,PBS洗涤后观察各孔集落形成数量并拍照计数。
3.3细胞迁移实验 将细胞铺于Transwell上室(小室)内,同时加入不同浓度的药物处理。培养板上室内使用不含血清的DMEM高糖培养液,下室内加入含10% FBS的DMEM高糖培养基。1 d后用PBS洗涤培养板,加入0.1%的结晶紫染液染色20 min,洗涤后在显微镜下观察并拍照。
3.4Hoechst 33258染色 添加爬片于6孔板内,并接种细胞。用不同浓度药物处理1 d后,PBS洗涤3次,加入Hoechst 33258染液染色20 min,再次洗涤后置于荧光显微镜下观察并拍照。
3.5透射电镜观察 将药物处理后的细胞用2.5%的戊二醛溶液固定过夜,随后经固定漂洗、脱水与包埋后制作切片并染色,用透射电镜观察并拍照。
3.6流式细胞术检测细胞凋亡 用不含EDTA的胰酶消化并收集经不同浓度的药物和制剂处理后的细胞,离心后用PBS洗涤2次,并重悬于100 μL Binding Buffer中,分别加入5 μL Annexin V-FITC与PI染色,避光孵育15 min后补充Binding Buffer至500 μL,转移到流式检测管中,1 h内上机测量细胞凋亡比例。
3.7Western blot检测蛋白水平 用含有1%PMSF蛋白酶抑制剂的RIPA裂解液裂解经不同浓度药物和相应抑制剂处理过的细胞提取蛋白,定量后调齐内参上样。采用80 V 恒压电泳15 min,再转为120 V恒压电泳分离蛋白后,经280 mA恒流转膜100 min,用5%脱脂牛奶封闭液常温下封闭1 h,然后分别加入抗cleaved caspase-3、Bcl-2、Bax、p-JNK和GAPDH抗体,置4 ℃孵育过夜(抗体稀释比例为1∶1 000),用TBST洗涤3次,每次10 min,加入HRP辣根过氧化物酶标记的羊抗兔IgG (1∶5 000) 室温孵育90 min,再次洗涤3次,每次10 min后进行曝光测量目标蛋白的含量。
4 统计学处理
应用SPSS 20.0统计软件分析,实验数据以均数±标准差(mean±SD)表示。CCK-8细胞活力检测实验、蛋白灰度分析、流式细胞术凋亡检测等单变量不同浓度间的比较采用单因素方差分析和Dunnett’s检验;相同药物浓度下的抑制剂、药物共处理组与单药处理组间的比较采用成组设计资料t检验。以P<0.05为差异有统计学意义。
结 果
1 丹参酮IIA对HOS细胞活力的影响
CCK-8细胞活力实验显示,丹参酮IIA对HOS细胞的生长有明显抑制作用,并呈浓度和作用时间依赖性,24 h的IC50为(23.80±2.15) μmol/L,48 h的IC50为(19.36±2.21) μmol/L。与对照组相比,各处理组细胞活力的差异有统计学意义(P<0.05),见图1。集落形成实验进一步证实丹参酮IIA对HOS细胞增殖能力有强烈的抑制效果,与对照组相比,各处理组集落数有显著差异(P<0.05),见图2。

Figure 1.The inhibitory effect of tanshinone IIA on HOS cell viability detected by CCK-8 assay. Mean±SD.n=5.*P<0.05vs0 μmol/L group.
图1丹参酮IIA对HOS细胞活力的抑制作用
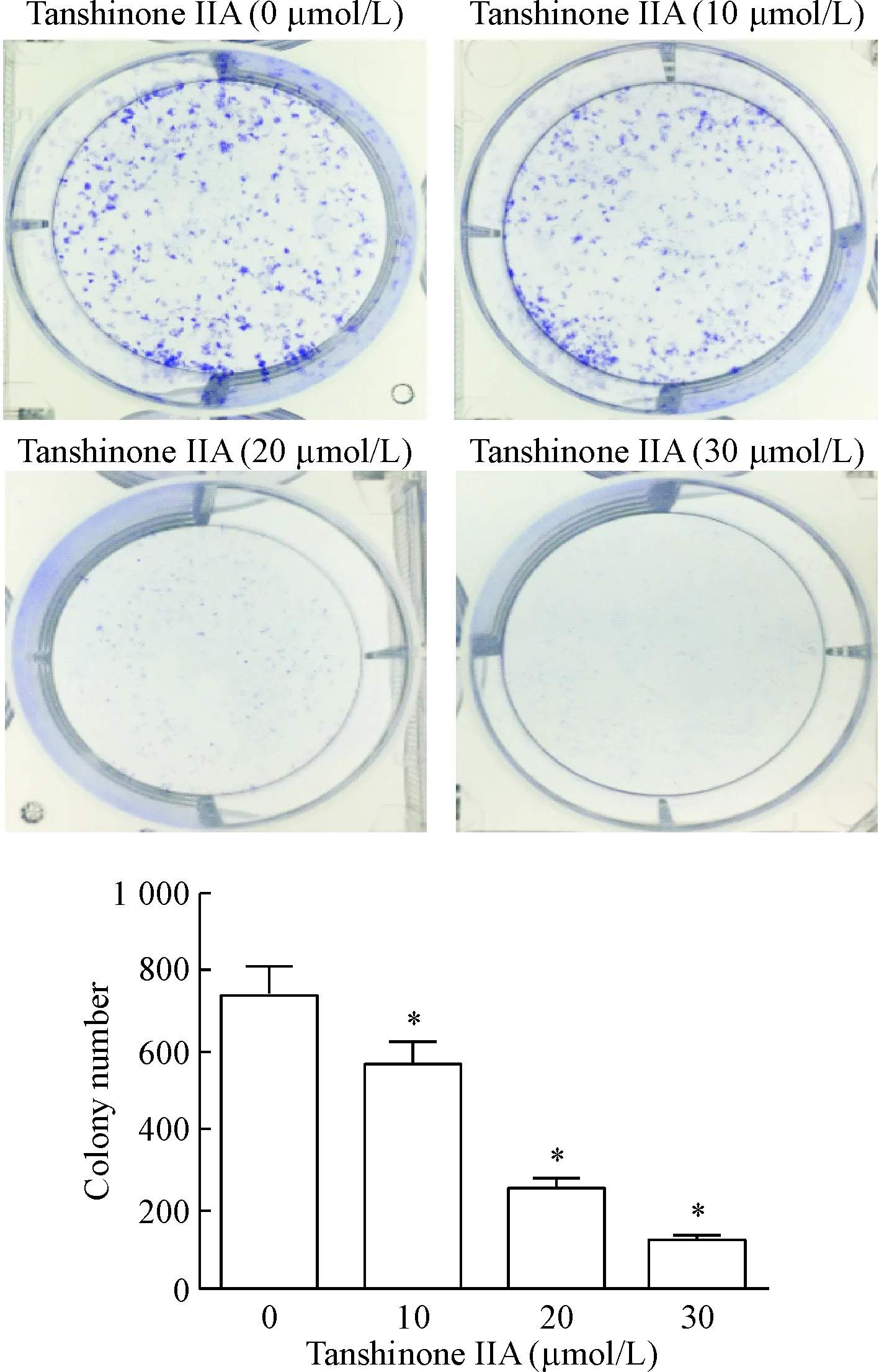
Figure 2.The effect of tanshinone IIA on the colony formation ability of HOS cells. The cell colonies were suppressed by the drug at different concentrations for 24 h. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图2丹参酮IIA抑制细胞集落形成
2 丹参酮IIA对HOS细胞迁移能力的影响
Transwell细胞迁移实验显示,丹参酮IIA可抑制肿瘤细胞的迁移,其效应随着药物浓度的增加而增强,差异具有统计学意义(P<0.05),见图3。

Figure 3.The effect of tanshinone IIA on HOS cell migration ability (×400). Mean±SD.n=3.*P<0.05vscontrol group.
图3丹参酮IIA抑制HOS细胞迁移能力
3 丹参酮IIA促进HOS骨肉瘤细胞发生凋亡
Hoechst染色和透射电镜结果显示,经30 μmol/L丹参酮IIA处理24 h后的细胞内出现核皱缩与凋亡小体,见图4、5。流式细胞技术量化了细胞凋亡的比例,随着药物浓度的增加,细胞凋亡比例呈现上升趋势(P<0.05),见图6。Western blot结果显示,丹参酮IIA能上调cleaved caspase-3与Bax蛋白的水平,并下调Bcl-2蛋白的水平(P<0.05),进一步从蛋白层面证实了凋亡的发生,见图7。
4 丹参酮IIA诱导JNK通路激活
Western blot检测结果表明,与对照组相比,丹参酮IIA处理提高了HOS细胞的p-JNK与其底物p-c-Jun的蛋白水平,且上升程度呈现药物浓度依赖性(P<0.05),见图8。

Figure 4.Apoptosis of the HOS cells induced by tanshinone IIA. The apoptotic cells demonstrated by Hoechst 33258 staining under fluorescence microscope (red arrow,×400).
图4丹参酮IIA诱导HOS细胞发生凋亡
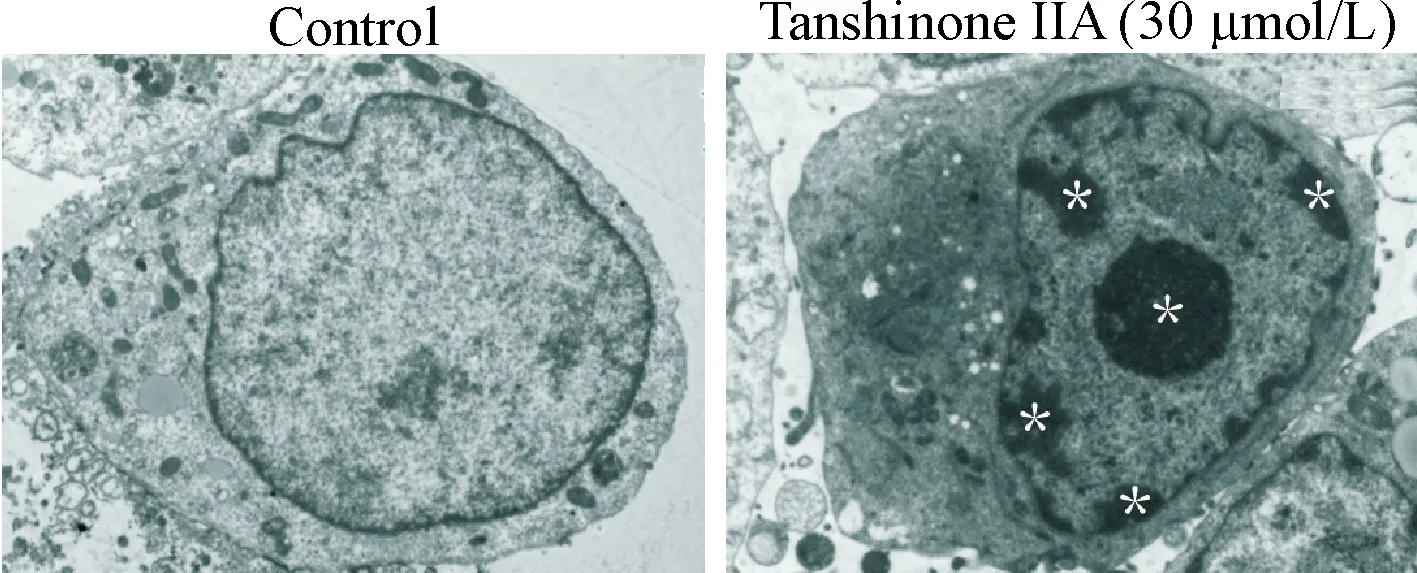
Figure 5.The ultrastructure of apoptotic HOS cells induced by tanshinone IIA under transmission electron microscope (white asterisk,×5 000).
图5透射电镜观察丹参酮IIA对HOS细胞凋亡的影响
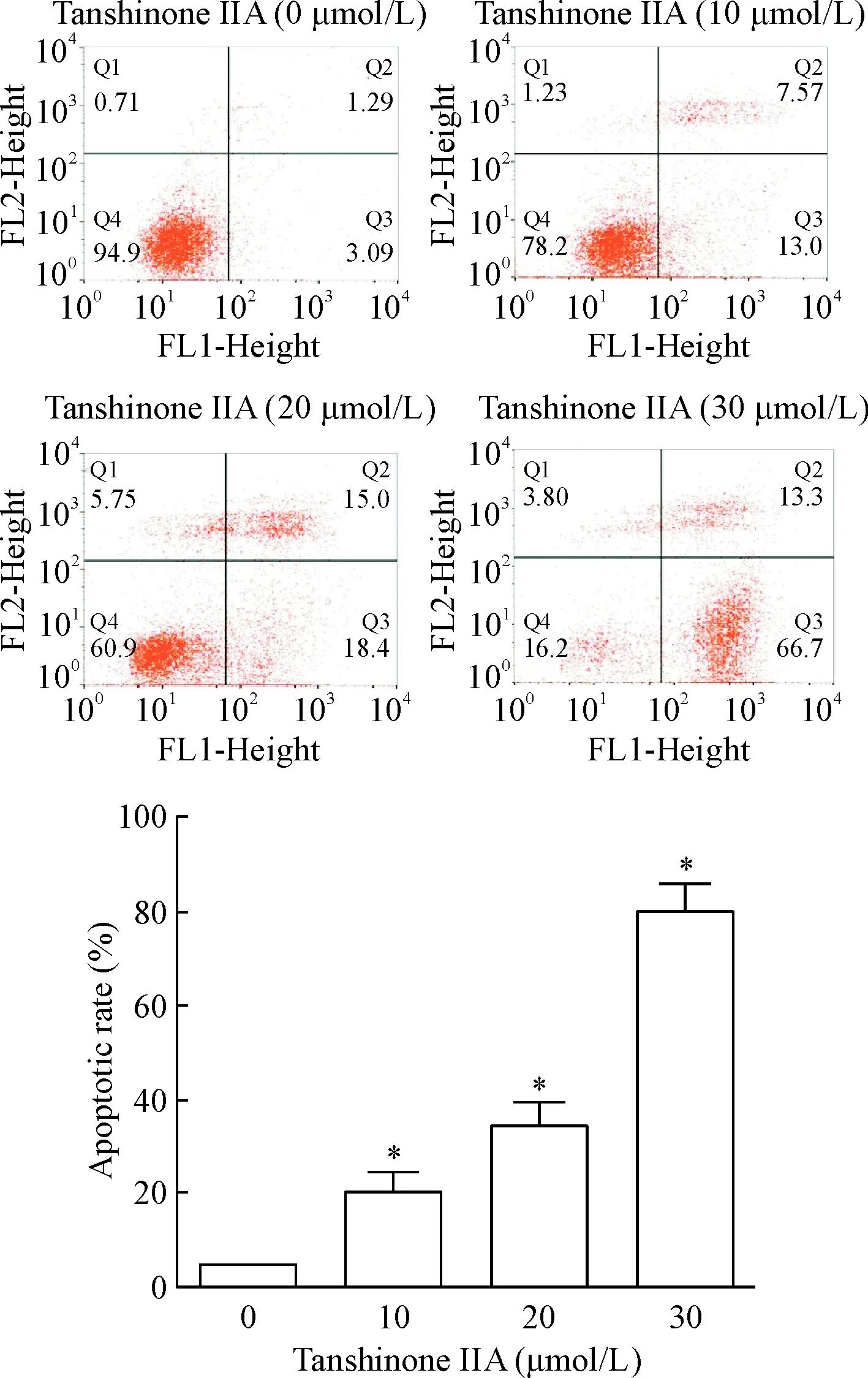
Figure 6.Apoptosis of the HOS cells triggered by tanshinone IIA was detected by flow cytometry. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图6流式细胞技术检测丹参酮IIA对HOS细胞凋亡的影响
5 JNK/c-Jun通路对细胞凋亡的影响
CCK-8实验显示,JNK抑制剂SP600125能在一定程度上减轻丹参酮IIA对HOS细胞生长的抑制作用,与相应单药物处理组相比,丹参酮IIA与SP600125共处理组在中、高浓度下细胞活力明显提高(P<0.05),见图9。Western blot结果显示,与单药物处理组相比,丹参酮IIA与SP600125共处理组cleaved caspase-3和Bax的蛋白表达下调,Bcl表达上调(P<0.05),见图10。因此,丹参酮IIA通过激活JNK通路,导致HOS细胞凋亡的发生。
讨 论
骨肉瘤的发病率位居恶性骨肿瘤之首,病情进展迅速,近年来不断提高的治疗方法,远期缓解率也始终无法突破瓶颈,迫使我们探索行之有效且安全的新治疗方案。丹参酮IIA是从传统中药丹参中提取的有效药物成分,很多研究已证实其有一定抑制肿瘤细胞生长的作用[6-9]。本研究结果表明,丹参酮IIA在体外能有效抑制HOS细胞增殖与迁移,通过激活JNK信号通路产生细胞抑制作用,诱导凋亡发生,发挥抗肿瘤效应。
细胞凋亡是由特定因素诱导并受基因调控的一种程序性死亡过程,以形态上出现细胞表面微绒毛消失、胞浆浓缩、核膜皱缩、核仁裂解、染色质浓聚以及出现凋亡小体等为特征性标志,与机体的生长发育、细胞病理生理状态以及内环境关系十分密切[10]。通过Hoechst 33258染色与透射电镜检查,我们观察到在丹参酮IIA作用下的HOS细胞出现大量核膜皱缩,染色质浓聚等现象,提示细胞出现凋亡。研究显示,凋亡是由caspase家族介导的一系列级联放大反应,caspase-3作为凋亡反应下游的执行蛋白,是不同凋亡途径所共同的必经之路,其表达水平可以整体反映凋亡的强弱[11]。此外,Bcl-2家族是肿瘤细胞中影响凋亡的关键因素之一,在不同的信号通路中起重要作用,其中Bcl-2和Bax分别是Bcl-2家族中最具代表性的凋亡抑制和促进基因,当凋亡发生时,Bcl-2家族中的相应蛋白作用于线粒体,破坏其完整性,进一步释放线粒体中的促凋亡因子,从而诱导凋亡的发生[12]。本课题研究发现,在丹参酮IIA作用之下,HOS细胞内caspase-3与Bax表达水平显著上升,而Bcl-2水平下降,进一步佐证了细胞内凋亡的发生且呈现一定的浓度依赖性,并与流式细胞术检测凋亡所得结果相吻合。
Figure 7.The alterations of apoptosis-related proteins caused by tanshinone IIA. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图7丹参酮IIA导致凋亡相关蛋白改变
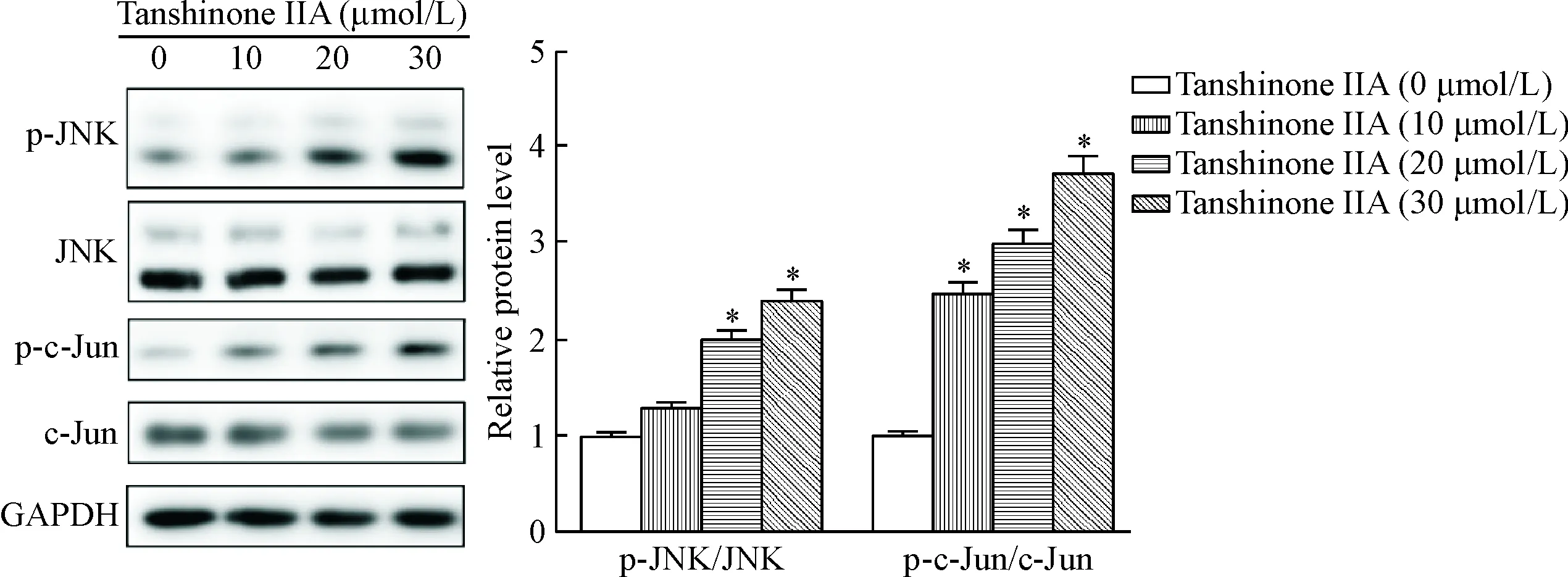
Figure 8.Tanshinone IIA induced activation of JNK signaling pathway. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图8丹参酮IIA诱导JNK信号通路激活
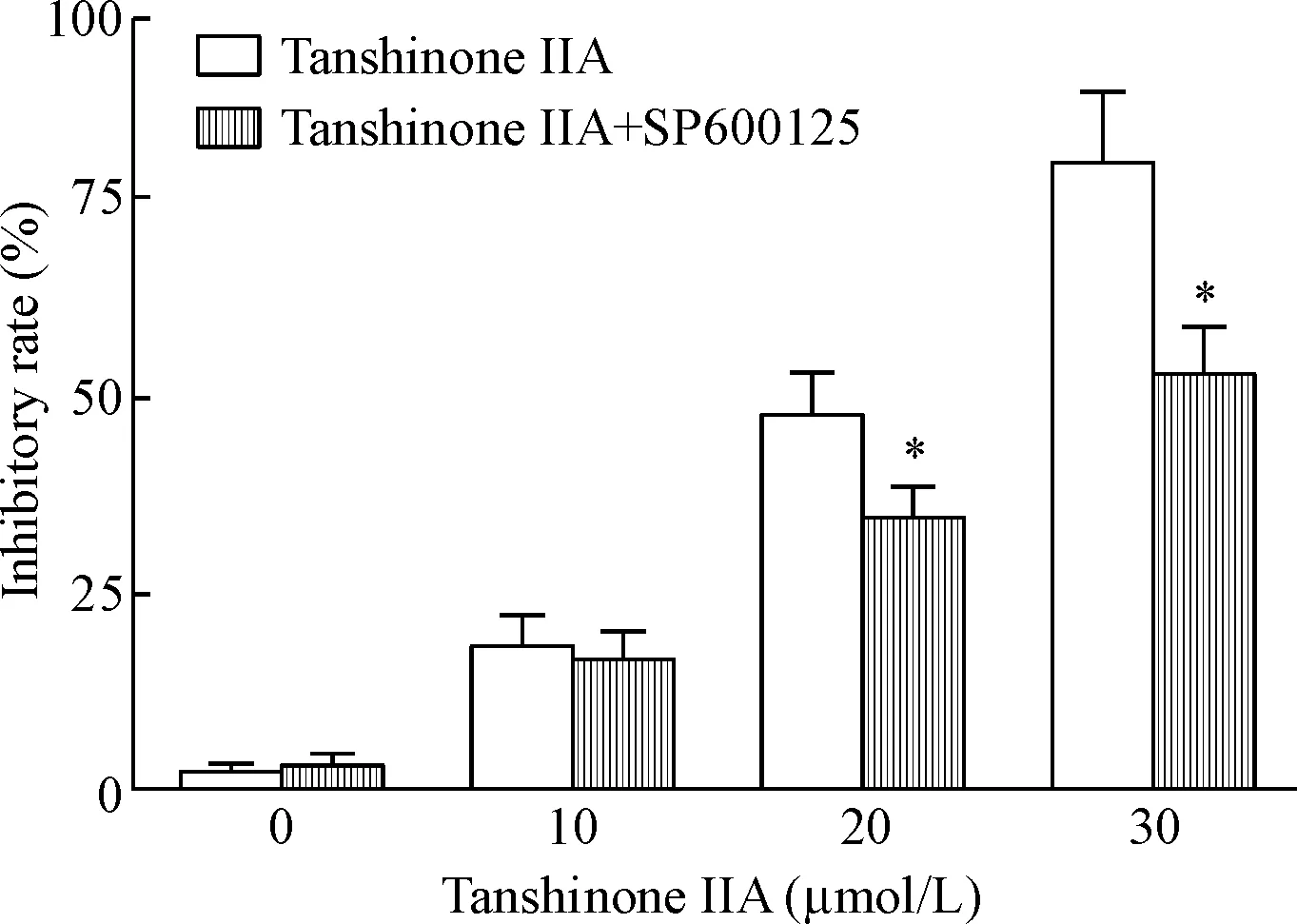
Figure 9.The JNK inhibitor SP600125 reversed tanshinone IIA-induced HOS cell viability inhibition. Mean±SD.n=3.*P<0.05vstanshinone IIA group.
图9SP600125缓解丹参酮IIA对细胞活力的抑制作用
目前已经发现调控凋亡的相关上游信号通路有多条,包括JNK通路、IL-6/STAT3通路和PI3K /Akt通路等[13-15]。JNK通路作为一条经典的MAPK信号通路,在细胞的生长发育、分化以及多种代谢活动中起到重要作用。JNK小分子能被上游多种激酶激活而磷酸化,再激活下游底物如c-Jun发挥病理生理作用[16]。JNK的亚型JNK1和JNK2普遍表达于各组织,而JNK3则在少数器官中才表达,因此我们选择p-JNK与p-c-Jun以及总JNK与总c-Jun作为检测指标以反映JNK信号通路的激活情况。本实验结果提示,在丹参酮IIA作用之下,蛋白表达水平p-JNK/JNK与p-c-Jun/c-Jun显著上升。为了进一步验证JNK通路与凋亡的关系,我们添加了JNK抑制剂SP600125与丹参酮IIA共处理组,再次通过细胞增殖实验与Western blot进行检测,结果显示JNK通路一定程度上被抑制,在此基础上细胞存活率有所提升,凋亡某种程度上被逆转。由此可见,JNK通路参与了丹参酮IIA引起的凋亡,但SP600125并不能完全逆转凋亡的发生,我们推测可能有其它通路参与该药物介导的凋亡,或是抑制剂浓度以及作用时间的关系,有待于我们作进一步研究。
综上所述,本实验通过细胞生物学与分子生物学的方法,研究丹参酮IIA对人骨肉瘤HOS细胞的影响。我们发现一定剂量的丹参酮IIA可通过作用于JNK信号通路而导致HOS细胞增殖被抑制,从而诱导凋亡发生,效应呈现浓度和作用时间依赖性。该结果为丹参酮IIA在骨肉瘤方面的临床应用提供了可参考的实验基础。

Figure 10. The JNK inhibitor SP600125 reversed tanshinone IIA-induced HOS cell apoptosis. The cells were treated with tanshinone IIA (30 μmol/L) for 24 h after incubation of JNK inhibitor SP600125 at 40 μmol/L for 2 h. Mean±SD.n=3.*P<0.05vstanshinone IIA group.
图10SP600125缓解丹参酮IIA导致细胞凋亡的作用
