HDAC1调控Wnt/β-catenin信号通路对乳腺癌细胞凋亡的影响*
2019-01-21牟成金
牟成金, 潘 武, 李 娟, 汪 静
[1四川省医学科学院, 四川省人民医院(东院), 四川 成都 610101; 2四川大学华西医院乳腺外科, 四川 成都 610041]
乳腺癌是一种常发生于女性的恶性肿瘤,其早期的临床症状不明显,当患者出现一定的临床症状以后大部分已经错过了最佳的治疗时机,因此探讨乳腺癌的发病机制,寻找有效的靶基因治疗乳腺癌是广大医学工作者目前研究的重点[1]。组蛋白脱乙酰酶1(histone deacetylase 1,HDAC1)具有调控细胞生长和凋亡等的作用,其可以影响相关基因的转录和表达,在非组蛋白和组蛋白的乙酰化中具有关键作用[2]。HDAC1参与肿瘤的发生,在肿瘤中表达异常,例如乳腺癌、肾癌和膀胱癌等,并且HDAC1还可以通过多种途径调控肿瘤细胞的凋亡等生物学特性[3-5]。Wnt/β-catenin在乳腺癌中过度激活,是一种与肿瘤细胞生长、凋亡密切相关的信号转导通路,HDAC1可以通过与Wnt/β-catenin的相互作用影响肝癌细胞的生长[6-7]。本研究探讨HDAC1在乳腺癌细胞中的表达和敲减HDAC1对乳腺癌细胞活性和凋亡的影响及机制,为靶向HDAC1治疗乳腺癌和研究HDAC1在肿瘤中的作用机制奠定基础。
材 料 和 方 法
1 材料
正常乳腺上皮细胞系MCF-10A及乳腺癌细胞系BT549、MCF-7和MDA-MB-231购自ATCC,均用含有10%胎牛血清的DMEM培养基培养于95%空气、5% CO2培养箱中,温度设置为37 ℃,用0.25%的胰蛋白酶消化传代。抗细胞周期蛋白D1(cyclin D1)抗体购自Saierbio;抗cleaved caspase-3、β-catenin和c-Myc抗体购自CTS;MMLV-RT逆转录酶和RT-qPCR试剂盒购自大连宝生物;RNA提取试剂盒购自北京天根;抗HDAC1抗体购自Abcam;HDAC1 siRNA和siRNA control购自Seebio;Lipofectamine 2000购自Invitrogen。
2 方法
2.1RT-qPCR测定HDAC1 mRNA在细胞中的表达 收集正常乳腺上皮细胞系MCF-10A及乳腺癌细胞系BT549、MCF-7和MDA-MB-231,在细胞中分别添加TRIzol裂解液,按照细胞总RNA提取试剂盒说明书提取细胞中的总RNA。用MMLV-RT逆转录酶合成cDNA。取cDNA进行RT-qPCR,反应程序为:95 ℃ 2 min; 95 ℃ 30 s、60 ℃ 35 s, 40个循环。以GAPDH为内参照,采用2-ΔΔCt法分析计算HDAC1在各组细胞中的mRNA水平。HDAC1的上游引物序列为5’-GGGTCAAGGAGGAGGTCAAG-3’, 下游引物序列为5’-TTGGCATTTCAGGAGTTTGTC-3’; GAPDH的上游引物序列为5’-CGGAGTCAACGGATTTGGTCGTAT-3’, 下游引物序列为5’-AGCCTTCTCCATGGTGGTGAAGAC-3’。
2.2Western blot测定蛋白水平 收集正常乳腺上皮细胞系MCF-10A及乳腺癌细胞系BT549、MCF-7和MDA-MB-231,提取细胞中的总蛋白,把各组蛋白加入1/4体积的5×SDS上样缓冲液中,在100 ℃反应5 min。以12%的分离胶和4%的浓缩胶进行电泳,每个泳道中添加30 μg的蛋白样品,在浓缩胶中以70 V电压电泳大约30 min后,观察染料进入到分离胶和浓缩胶的交接处,把电压调整到100 V,继续电泳约2.5 h,观察染料进入底端以后,进行转膜。转膜条件为 4 ℃,300 mA,转膜时间为100 min。用以TBST稀释的牛血清白蛋白在室温中封闭60 min。HDAC1 I抗以1∶300稀释,把封闭后的膜放在稀释好的 I 抗内,置于4 ℃过夜。 II 抗以1∶3 000稀释,再把膜放在稀释好的 II 抗中,置于室温孵育2 h。ECL发光以后,曝光,用软件分析各条带的灰度值,用HDAC1灰度值与GAPDH灰度值的比值表示蛋白水平。Control、siRNA control和HDAC1 siRNA各组的细胞培养48 h以后,按照上述Western blot方法测定细胞内cleaved caspase-3、β-catenin、c-Myc和cyclin D1的蛋白水平。
2.3细胞转染和分组 MDA-MB-231细胞中转染HDAC1 siRNA和siRNA control,转染用Lipofectamine 2000脂质体转染,步骤参照试剂说明书。以不做转染处理的MDA-MB-231细胞为control组。各组细胞在转染以后分别培养48 h,以RT-qPCR和Western blot法测定细胞中HDAC1 的mRNA和蛋白水平,步骤同上。
2.4MTT法测定细胞活力 取种植于96孔板内的各组细胞,培养48 h后,在细胞内分别添加20 μL的MTT溶液,继续孵育4 h。用移液枪把上清溶液吸除,每孔中分别添加150 μL的DMSO,观察结晶物溶解以后,测定各孔490 nm的吸光度(A)值。A值越大表明细胞活力越高。
2.5流式细胞术测定细胞凋亡 各组细胞培养48 h后,收集细胞,用500 μL的结合缓冲液重悬,添加Annexin V-FITC和PI分别5 μL,放置于室温,避光反应约15 min,流式细胞仪测定各组乳腺癌细胞凋亡。
2.6激活Wnt/β-catenin信号通路后细胞凋亡情况的检测 取转染HDAC1 siRNA后的乳腺癌MDA-MB-231细胞,在细胞培养液中添加10 mmol/L的Wnt/β-catenin通路激活剂LiCl, 即HDAC1 siRNA+LiCl组。流式细胞术测定HDAC1 siRNA+LiCl和HDAC1 siRNA组细胞48 h的凋亡水平,Western blot测定HDAC1 siRNA+LiCl和HDAC1 siRNA组细胞培养48 h后细胞中cleaved caspase-3、β-catenin、c-Myc和cyclin D1的蛋白水平,步骤同上。
3 统计学处理
实验数据均用SPSS 21.0软件进行数据处理和统计分析。所有数据以均数±标准差(mean±SD)表示。两组间比较均用独立样本t检验,多组间比较用单因素方差分析(one-way ANOVA),各组间两两比较用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 HDAC1在乳腺癌细胞中高表达
乳腺癌细胞系BT549、MCF-7和MDA-MB-231中HDAC1的mRNA和蛋白水平均明显高于正常乳腺上皮细胞系MCF-10A(P<0.05),说明HDAC1在乳腺癌细胞中过度表达。其中MDA-MB-231细胞中HDAC1的mRNA和蛋白水平均明显高于MCF-7和BT549细胞(P<0.05),故选用MDA-MB-231细胞做后续实验,见图1。
2 HDAC1 siRNA下调乳腺癌细胞中HDAC1的表达
siRNA control组细胞中HDAC1的mRNA和蛋白水平与control组相比差异无统计学显著性;HDAC1 siRNA组细胞中HDAC1 的mRNA和蛋白水平均明显低于control组(P<0.05),见图2。
3 敲减HDAC1表达降低乳腺癌细胞活力并诱导细胞凋亡
siRNA control组细胞的A值与凋亡率与control组相比差异没有统计学显著性;HDAC1 siRNA组细胞的A值明显低于control组,凋亡率明显高于control组(P<0.05),见图3。
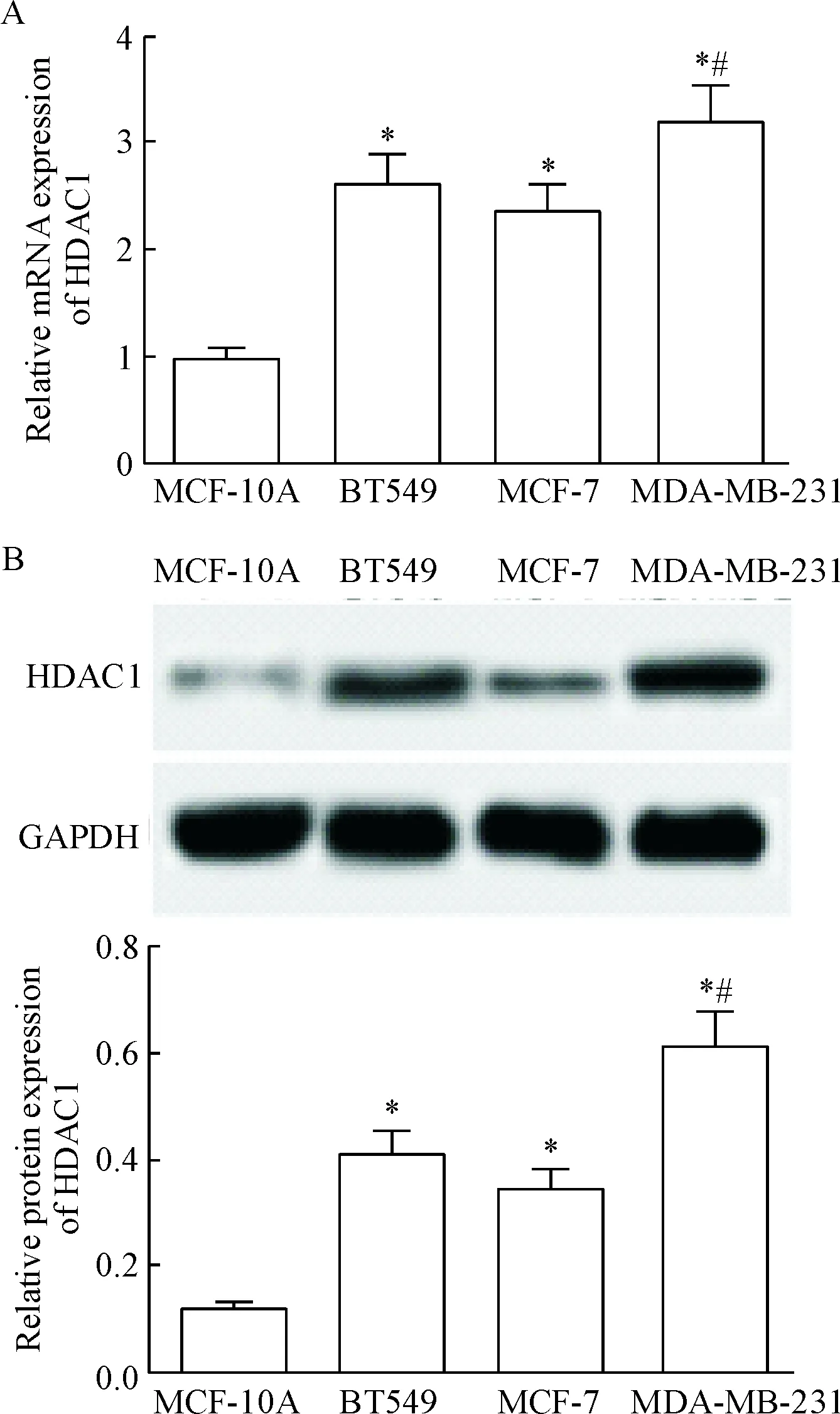
Figure 1.The expression of HDAC1 at mRNA and protein levels in normal mammary epithelial cell line MCF-10A and breast cancer cell lines BT549, MCF-7 and MDA-MB-231. A: the mRNA expression of HDAC1 determined by RT-qPCR; B: the protein expression of HDAC1 determined by Western blot. Mean±SD.n=3.*P<0.05vsMCF-10A;#P<0.05vsMCF-7 or BT549.
图1HDAC1在正常乳腺上皮细胞系MCF-10A和乳腺癌细胞系BT549、MCF-7、MDA-MB-231中表达水平的比较
4 敲减HDAC1表达诱导乳腺癌细胞中caspase-3活化并抑制Wnt/β-catenin信号通路激活
siRNA control组细胞中cleaved caspase-3、β-catenin、c-Myc和cyclin D1的蛋白水平与control组相比差异没有统计学显著性; 与control组相比,HDAC1 siRNA组细胞中的cleaved caspase-3水平明显升高,β-catenin、c-Myc和cyclin D1水平明显降低(P<0.05),见图4。
5 激活Wnt/β-catenin信号通路抑制HDAC1下调诱导的乳腺癌细胞凋亡
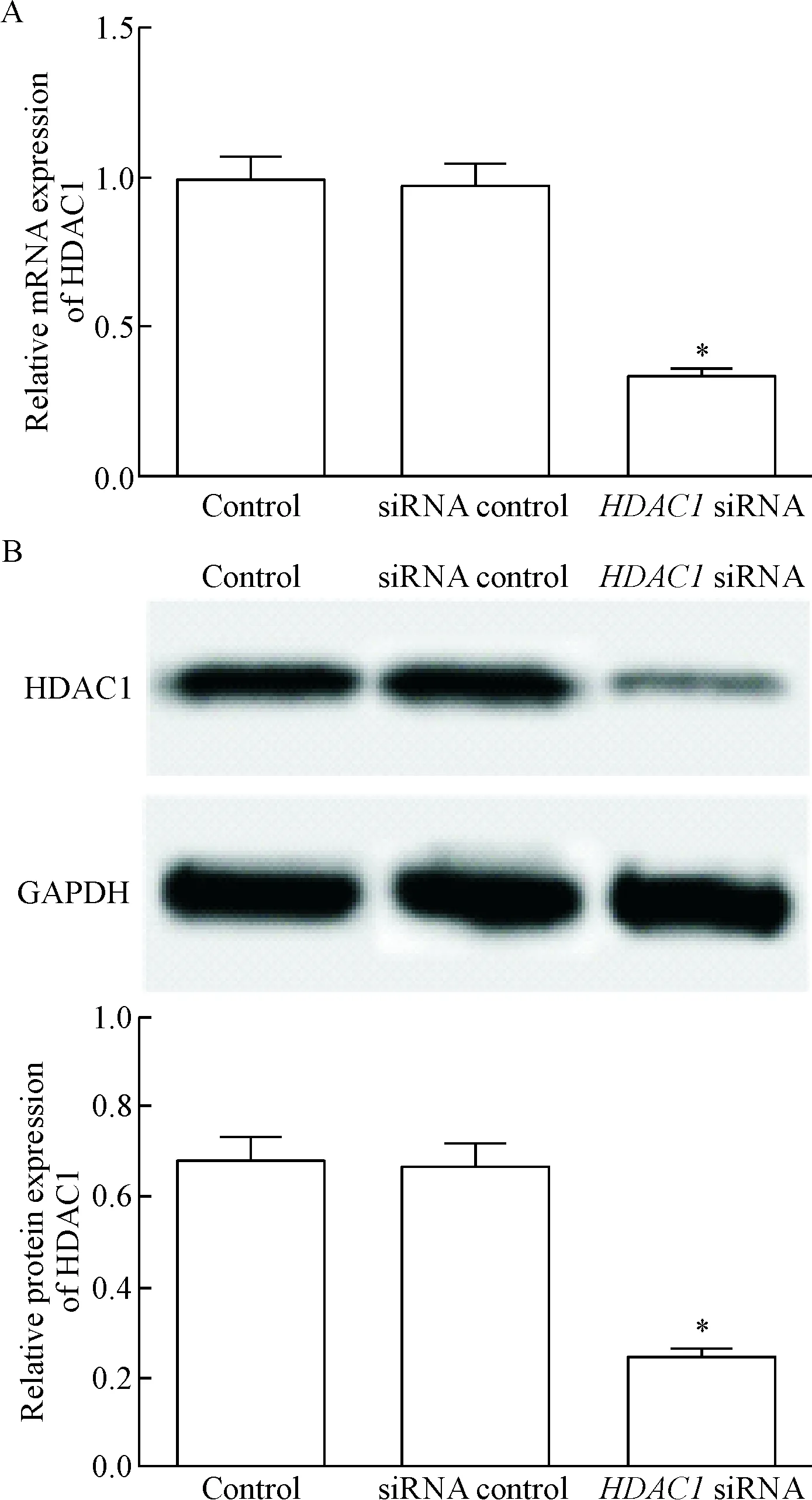
Figure 2.The effect ofHDAC1 siRNA transfection on HDAC1 expression in the breast cancer cells. A: the mRNA expression of HDAC1 determined by RT-qPCR; B: the protein expression of HDAC1 determined by Wes-tern blot. Mean±SD.n=3.*P<0.05vssiRNA control group.
图2HDAC1siRNA对乳腺癌细胞中HDAC1表达的影响
HDAC1 siRNA+LiCl组细胞的A值明显高于HDAC1 siRNA组,凋亡率明显低于HDAC1 siRNA组(P<0.05),见图5。
6 激活Wnt/β-catenin信号通路减弱HDAC1下调对细胞中cleaved caspase-3、β-catenin、c-Myc和cyclin D1蛋白水平的影响
与HDAC1 siRNA组相比,HDAC1 siRNA+LiCl组细胞中的cleaved caspase-3水平明显降低,β-catenin、c-Myc和cyclin D1水平明显升高(P<0.05),见图6。
讨 论
肿瘤的发生与组蛋白乙酰化有关,当正常细胞内组蛋白的乙酰化及去乙酰化水平的平衡被打破以后,就会引起细胞的正常代谢及生长等发生异常,引起肿瘤的发生[8]。组蛋白脱乙酰酶可以将组蛋白去乙酰化,维持乙酰化平衡。HDAC1是组蛋白脱乙酰酶家族中的成员,是目前发现的与肿瘤密切相关的成员之一,在肿瘤的转移和发生中均有重要作用[9-10]。HDAC1高表达之后,肿瘤细胞的增殖活性明显增强,HDAC1是所有组蛋白脱乙酰酶中与肿瘤关系最具有代表性的成员,其表达水平的高低与宫颈癌、肺癌、乳腺癌和胃癌等多种癌症的进展和分期有关,并且HDAC1还参与细胞内增殖、凋亡等相关因子的表达[11-17]。本实验的结果显示,HDAC1在3株乳腺癌细胞中的表达水平均明显高于正常的乳腺上皮细胞,这与上述研究报道一致,HDAC1在乳腺癌中高表达。
研究报道显示,HDAC1参与肿瘤细胞的有丝分裂,并且可以通过激活caspase-3诱导细胞凋亡的发生[18]。肿瘤细胞的生长和凋亡是细胞自发完成的一种主动过程,是经过多重基因和信号转导的严格过程[19]。Caspase-3在细胞凋亡中有重要作用,无论是线粒体途径还是死亡受体途径,最后都会激发caspase凋亡反应,使位于凋亡反应下游的caspase-3激活,促进细胞凋亡[20-21]。本实验表明,乳腺癌细胞中敲减HDAC1表达后,细胞中caspase-3的活化水平升高,细胞凋亡增加,细胞活性降低,提示敲减HDAC1表达可诱导caspase-3活化,促进乳腺癌细胞凋亡。
Wnt/β-catenin信号通路是一个由多个作用位点和环节共同组成的与生长发育有关的信号通路,其在成熟的细胞中激活水平极低,细胞内的β-catenin存在于细胞膜上,以复合物的形式存在[22]。在细胞受到相关信号刺激以后,β-catenin的降解受到抑制,引起细胞内β-catenin大量聚集,进入到细胞核内,诱导下游靶基因c-myc、cyclinD1的转录[23]。Wnt/β-catenin信号通路与乳腺癌有关,不仅参与乳腺癌干细胞的分化增殖,还与乳腺癌细胞的生长凋亡有关[24]。最近的研究显示,HDAC1与Wnt/β-catenin存在一定的潜在关系,对于细胞的生长和凋亡具有调控作用[25-27]。本实验结果表明,敲减HDAC1表达可以抑制Wnt/β-catenin信号通路的激活,而Wnt/β-catenin激活剂可以部分逆转敲减HDAC1表达诱导的乳腺癌细胞凋亡,敲减HDAC1表达通过抑制Wnt/β-catenin信号通路诱导乳腺癌细胞凋亡。
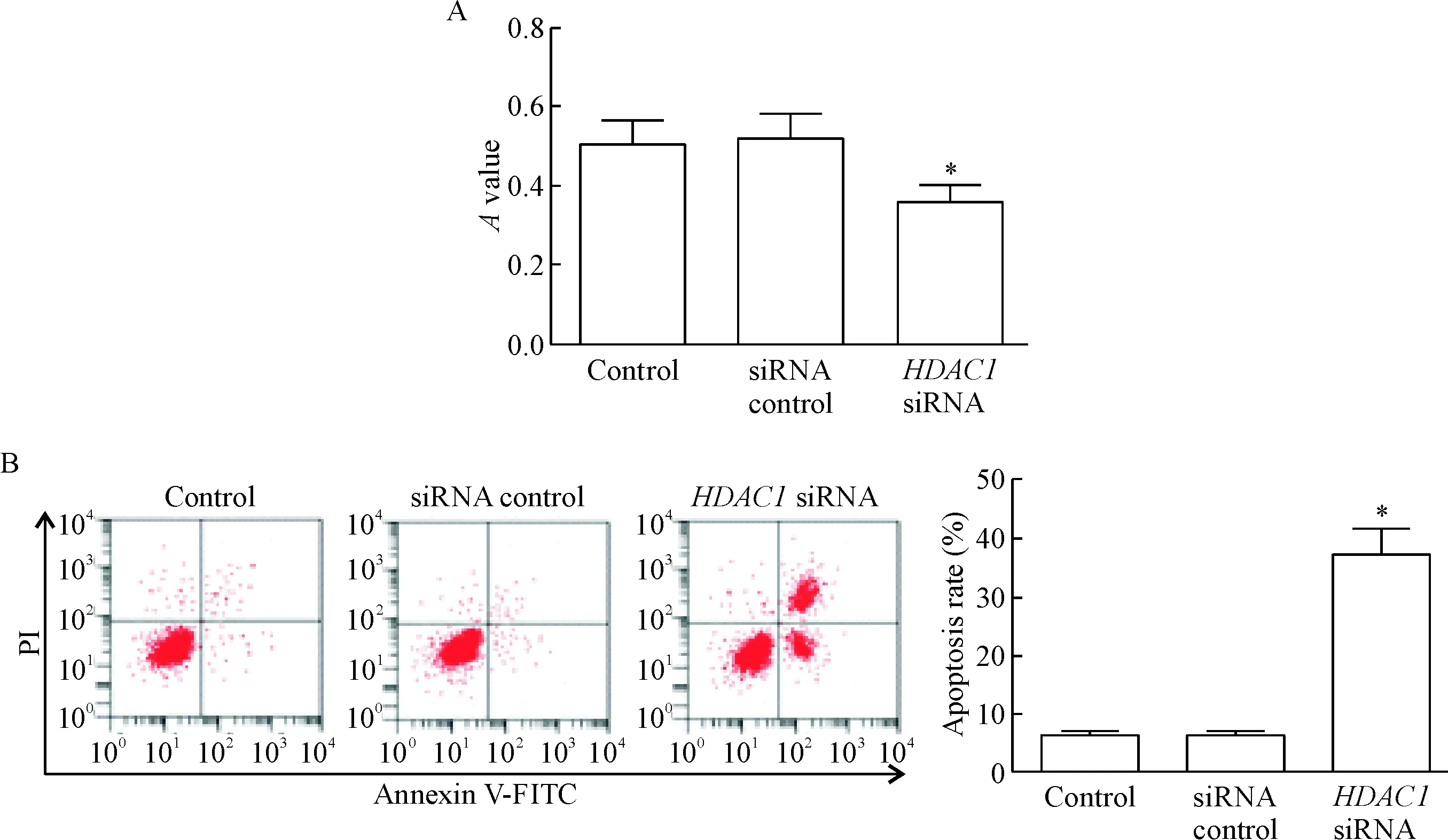
Figure 3.The effects ofHDAC1 knockdown on the viability and apoptosis of breast cancer cells. A: the cell viability detected by MTT assay; B: the images of flow cytometry for cell apoptosis and quantitative analysis of the apoptotic rate. Mean±SD.n=3.*P<0.05vssiRNA control group.
图3敲减HDAC1表达对乳腺癌细胞活力和凋亡的影响
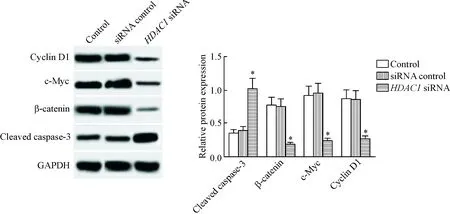
Figure 4.The effects ofHDAC1 knockdown on the protein levels of cleaved caspase-3, β-catenin, c-Myc and cyclin D1 in the breast cancer cells. Mean±SD.n=3.*P<0.05vssiRNA control group.
图4敲减HDAC1对乳腺癌细胞中cleavedcaspase-3、β-catenin、c-Myc和cyclinD1蛋白水平的影响
HDAC1在乳腺癌中高表达,敲减HDAC1表达可以诱导乳腺细胞的凋亡,是一种潜在的治疗乳腺癌的基因靶点。敲减HDAC1表达可以通过抑制Wnt/β-catenin信号通路的激活诱导乳腺癌细胞的凋亡,对于其在其他多株乳腺癌细胞中的作用需要在后续实验中进行验证。本研究结果对于研究HDAC1在乳腺癌中的作用提供了新的资料。
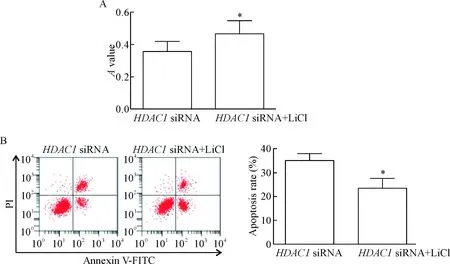
Figure 5.The effects of activation of Wnt/β-catenin signaling pathway onHDAC1 knockdown-induced apoptosis of the breast cancer cells. A: the cell viability detected by MTT assay; B: flow cytometry was used to analyze cell apoptosis and quantitative analysis of the apoptotic rate. Mean±SD.n=3.*P<0.05vsHDAC1 siRNA group.
图5激活Wnt/β-catenin信号通路对HDAC1下调诱导的乳腺癌细胞凋亡的影响
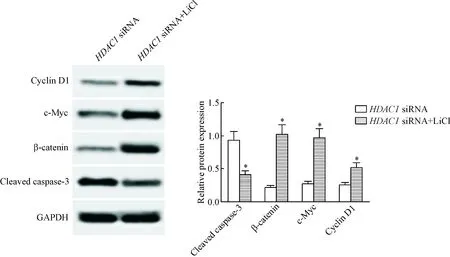
Figure 6.The effects of Wnt/β-catenin signaling pathway activation on the protein levels of cleaved caspase-3, β-catenin, c-Myc and cyclin D1 protein in the breast cancer cells withHDAC1 knockdown determined by Western blot. Mean±SD.n=3.*P<0.05vsHDAC1 siRNA group.
图6激活Wnt/β-catenin信号通路对敲减HDAC1表达的乳腺癌细胞中cleavedcaspase-3、β-catenin、c-Myc和cyclinD1蛋白水平的影响
