一步水热法制备TiO2/Ti3C2纳米复合材料及其光催化性能
2019-01-11朱建锋牛冬娟
朱建锋, 高 妍, 赵 婷, 王 芬, 牛冬娟
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
为了应对日益增加的环境和能源问题,光催化被认为是一种有前景的清洁环境和可持续能源的方法.近年来,发现金属氧化物半导体在光照下对有害有机物降解为危害较小的分子具有良好的光催化活性.TiO2光催化剂由于其化学性质稳定,廉价易得,催化性高,氧化能力高,降解完全和可以重复使用等优点,在降解有毒有机污染物,污水处理,光电转换,清洁材料的制备等方面受到了广泛关注.然而TiO2还存在带隙较宽(约3.2 eV),只能在波长小于378 nm的紫外区显示光化学活性,对太阳能的利用率小于10%,同时其光生电子和空穴容易发生复合等问题,从而使得光催化效率降低.因此,一系列的策略已经被开发,以合成二氧化钛基纳米复合材料,用于抑制电子空穴重组和扩大光吸收范围,如贵金属负载[1],离子掺杂[2],以及与半导体[3],金属氧化物[4],和碳材料[5]复合.特别是,在含碳材料和二氧化钛的结合上有广泛的关注,因为它们二者组合的协同性能够达到增强光催化性能的目的[6].
最近,二维(2D)的过渡金属的碳化物或碳氮化物MXenes因其独特的性能已经被广泛研究[7,8].Ti3C2纳米片是目前研究最多的MXene,其可以通过用HF选择性刻蚀和剥落Ti3AlC2容易地获得.Ti3AlC2是典型的MAX相材料,它可认为是一种金属与陶瓷之间的复合物,同时兼具金属和陶瓷的优良性能.因此,Ti3C2具有高的导电性和类石墨烯状二维层状结构,被认为是锂离子电池(LIB)阳极[9],锂硫电池[10],和电化学电容器的储能材料[11],也正是因为独特的层状结构形态,使其具有良好的分散性和稳定性,也使Ti3C2作为染料的吸附剂[12]和作为催化剂的载体[13].Ti3C2已被广泛认为是一类高性能光催化剂[14].由于提供了一个TiO2和碳材料复合的天然平台,Ti3C2作为复合材料的基体可延长电子-空穴对的寿命,调节带隙,吸附反应物[14,15].
在近几年的研究中,二维纳米MXenes相材料(Ti3C2,Ti2C等)在制备和性能研究方面取得了显著的成果[16-18],但是目前对MXenes相结构的负载以及其复合材料在光催化领域的研究较少.本文采用钛酸丁酯为钛源,采用一步水热法制备了TiO2/Ti3C2纳米复合材料.该复合材料可有效分离光生电子和空穴,减小带隙,提高光催化效率.在这里,我们提出了一种可能的复合材料机制,以提高光催化降解性能.
1 实验部分
1.1 原料
碳化钛粉(TiC)、钛粉(Ti)、铝粉(Al)、氢氟酸(HF)、钛酸丁酯(C16H36O4Ti)、无水乙醇(C2H5OH)等.
1.2 Ti3AlC2与Ti3C2的制备
Ti3AlC2是通过真空无压烧结TiC、Ti和Al而制成的.将混合物通过低能球磨,真空烧结和高能球磨,最后在40 ℃下干燥24 h.详细内容参见文献[19].通过40%HF溶液在室温磁力搅拌24 h,蚀刻Ti3AlC2中的Al,制备出二维层状Ti3C2.然后离心,用去离子水彻底冲洗得到的悬浮液,乙醇洗涤几次,直至pH值达到中性,然后在40 ℃干燥,成功制备出Ti3C2粉末[20].
1.3 TiO2/Ti3C2复合材料的制备
称取0.6 g的Ti3C2分散在30 mL去离子水中,进行超声处理至溶液均匀透明无沉淀.量取1.7 mL钛酸丁酯溶于9 mL无水乙醇中,缓慢加入上述溶液.将该溶液搅拌3 h置于水热反应釜中,在150 ℃下水热反应12 h.反应完成后进行离心,水洗三次,醇洗三次反应溶液,将其在60 ℃条件下干燥12 h,研磨,得TiO2/Ti3C2复合材料.TiO2/Ti3C2复合材料的制备工艺如图1所示.
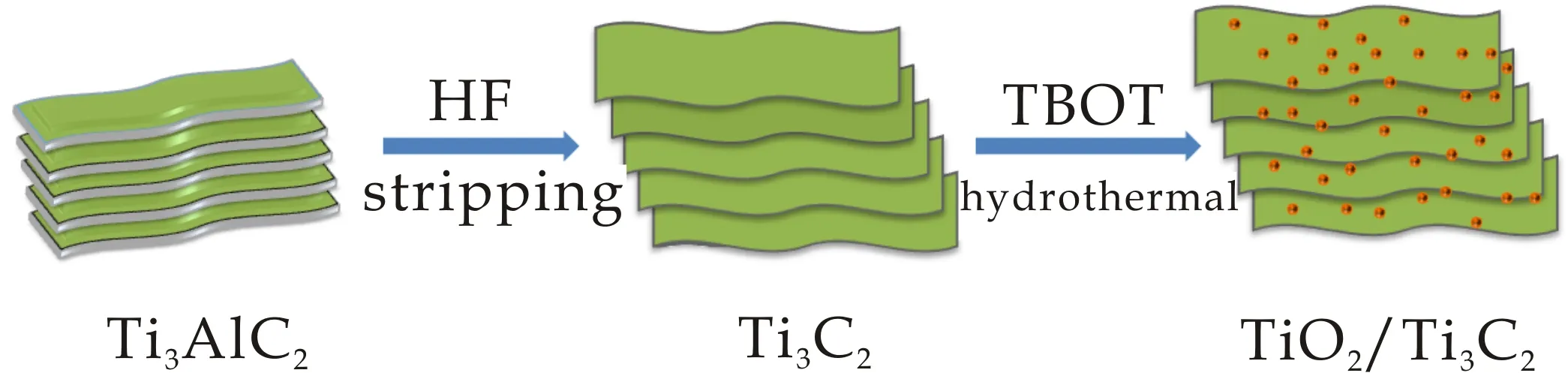
图1 TiO2/Ti3C2复合材料的制备工艺
为了进行对比实验,在150 ℃条件下,对纯钛酸丁酯进行水热处理,得到150 ℃ TiO2,其制备过程与TiO2/Ti3C2复合材料的制备过程完全相同.
1.4 测试与表征
X射线衍射分析(XRD)可以在5 °~80 °的角度范围内探索材料的结构.通过场发射扫描电子显微镜(SEM,Hitachi S4800)和透射电子显微镜(TEM;FEI公司TecnaiG220 S twin,200kV)观察纳米复合材料的表面形貌和微观结构.能量色散型X射线分析仪(EDS)可以进行元素分析.通过N2吸附脱附法测试材料的比表面积.使用紫外可见分光光度计(YQ2015001210)接收光学吸收光谱.
1.5 光催化性能测试
样品的光催化性能通过在500 W汞灯(Bilang,中国)下光催化降解甲基橙(MO)染料来评估.首先,将30 mg光催化剂溶解于50 mL MO溶液(20 mg/L)中并在黑暗条件下搅拌1 h,直到MO溶液和催化剂之间建立吸附平衡.然后进行光反应.在照射过程中,每15 min取出4 mL溶液,以8 000 r/min的速度离心,取出上清液,并在2 600 UV-vis分光光度计上测量MO溶液的吸光度.
2 结果与讨论
2.1 TiO2/Ti3C2复合材料的物相分析
对实验所得的粉末进行XRD测试,结果如图2所示.图2从下到上依次为Ti3C2、TiO2和TiO2/Ti3C2纳米复合材料的XRD图谱.从Ti3C2的XRD图谱中可以看出,分别在2θ为9.08 °、18.51 °、27.90 °、35.90 °、41.71 °、60.80 °时出现了衍射峰,分别对应于Ti3C2的(002)、(006)、(008)、(0010)、(0012)、(110)晶面,这与文献中报道的Ti3C2衍射峰一致[21].所制备的TiO2XRD图谱与标准TiO2的PDF卡片(PDF#21-1272)十分吻合.从图谱中可以看出,在2θ位于25.28 °、37.80 °、48.05 °、53.89 °、55.06 °处,分别对应(101)、(004)、(200)、(105)、(204)晶面.TiO2/Ti3C2纳米复合材料的XRD图谱中所有的衍射峰与TiO2和Ti3C2的特征峰吻合,表明TiO2/Ti3C2复合材料为TiO2与Ti3C2的共存结构.
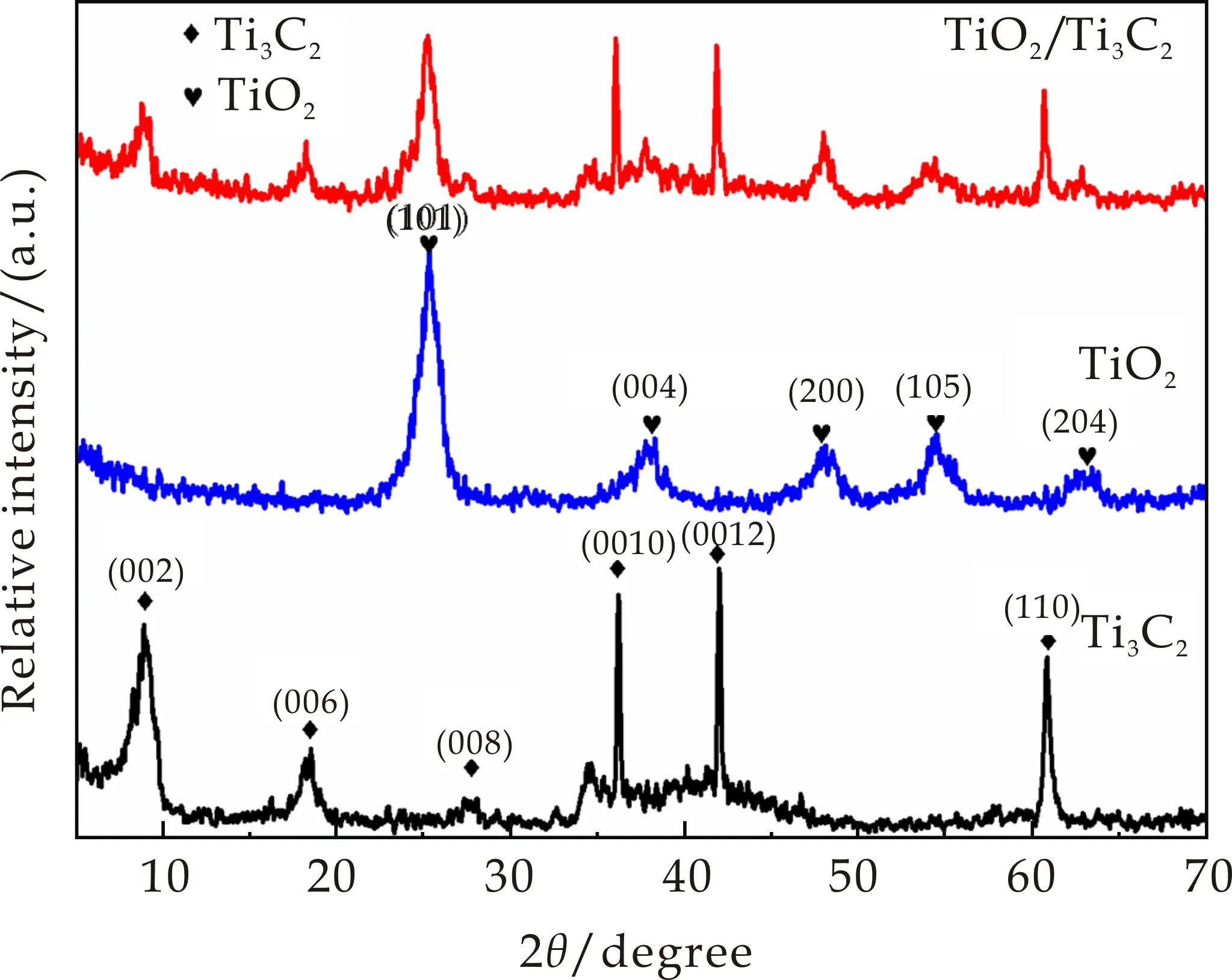
图2 Ti3C2、TiO2和TiO2/Ti3C2复合材料XRD图
2.2 TiO2/Ti3C2复合材料的形貌分析
图3为Ti3C2、TiO2、TiO2/Ti3C2复合材料的SEM图以及TiO2/Ti3C2的EDAX图.图3(a)显示了Ti3C2的形态,这种分层的手风琴状结构可以在所示的局部放大图3(b)中更清晰地看到.图3(c)、3(d)为所制备的TiO2的SEM图,其中图3(d)是图3(c)的局部放大图,从图中可以看出纯TiO2产物表现出的平均尺寸为1~4μm,它是由大量小的不规则颗粒聚集而成,这些不规则颗粒的尺寸约为80 nm.这些纳米颗粒是锐钛矿型TiO2纳米颗粒,由图2中的XRD结果证实.图3(e)、3(f)为TiO2/Ti3C2复合材料的SEM图,在水热法之后,Ti3C2的层状形态保留,并且在层的边缘和边缘处可以观察到尺寸约为20 nm的不规则形状的颗粒.这些夹层纳米颗粒的存在有效地防止了Ti3C2片的累积.同时,与纯TiO2样品相比,TiO2/Ti3C2复合材料中TiO2颗粒尺寸减小,团聚现象也明显减少.这意味着这种TiO2/Ti3C2复合材料具有大的特定表面积和高表面能.图3(g)为TiO2/Ti3C2复合材料中对应的Ti、O和C元素分布图,能看到Ti、O和C元素均匀分布在Ti3C2片层以及层间,可以表明TiO2颗粒负载到了Ti3C2上.

(a)、(b)Ti3C2的SEM图

(c)、(d)TiO2的SEM图

(e)、(f)TiO2/Ti3C2复合材料的SEM图
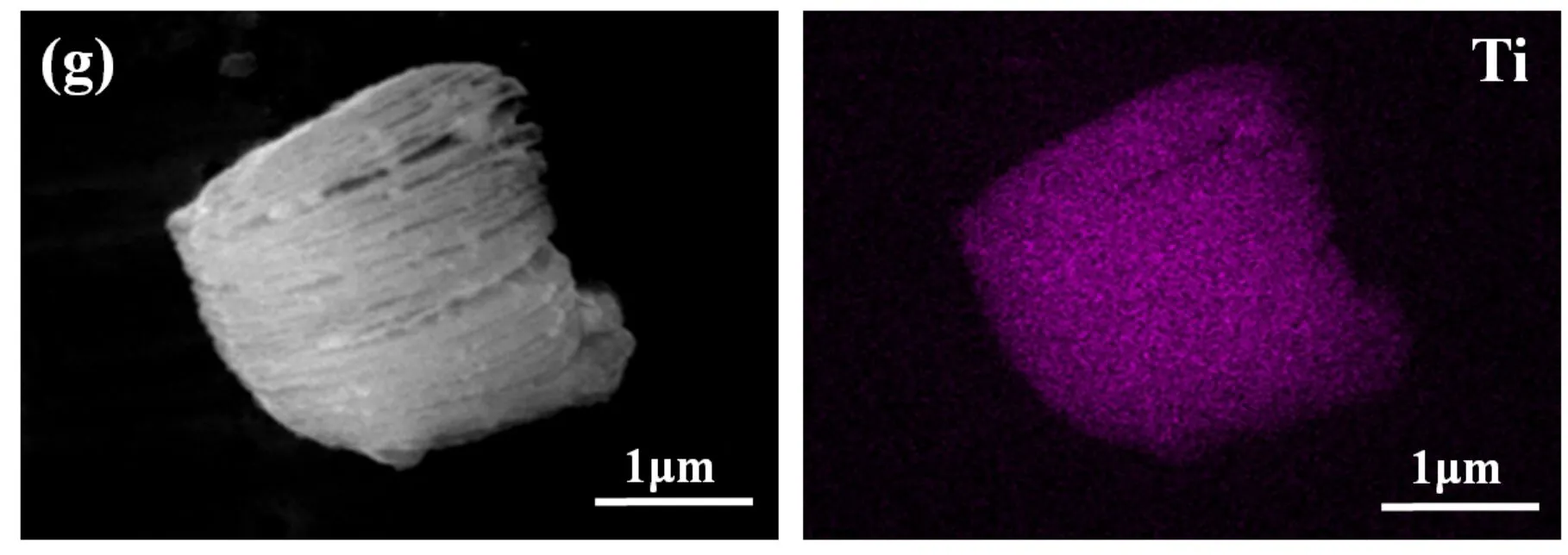

(g)TiO2/Ti3C2及相应Ti、O、C元素的EDAX面扫图图3 Ti3C2、TiO2和TiO2/Ti3C2的SEM图以及TiO2/Ti3C2的EDAX图
图4显示了Ti3C2和TiO2/Ti3C2复合材料的TEM和HRTEM图.图4(a)为Ti3C2的TEM图,从图中可以看出Ti3C2独特的二维层状类石墨烯结构;图4(b)为Ti3C2的HRTEM图像,测得Ti3C2的晶面条纹间距约为0.98 nm;图4(c)为TiO2/Ti3C2复合材料的TEM图;图4(d)为其相对应的HRTEM图,可以看出许多TiO2纳米颗粒均匀地附着在Ti3C2薄片上,形成夹心状结构.并且测量到0.36 nm的晶格间距,这归属于锐钛矿的(101)晶面.这些结果证实了TiO2颗粒成功负载到了Ti3C2二维层状材料上了,这与XRD、SEM结果吻合.TiO2/Ti3C2复合材料的夹层结构有利于提供更多的接触界面,以加速它们之间的电荷载流子迁移.
经测量,图4(a)中Ti3C2的层间距约为120 nm,而图4(c)中TiO2/Ti3C2复合材料的层间距约为183 nm,这表明TiO2颗粒的引入不仅能有效防止Ti3C2层的堆积,还可以增大其层间距,并增加材料的比表面积.

(a)Ti3C2的TEM图 (b)Ti3C2的HRTEM图
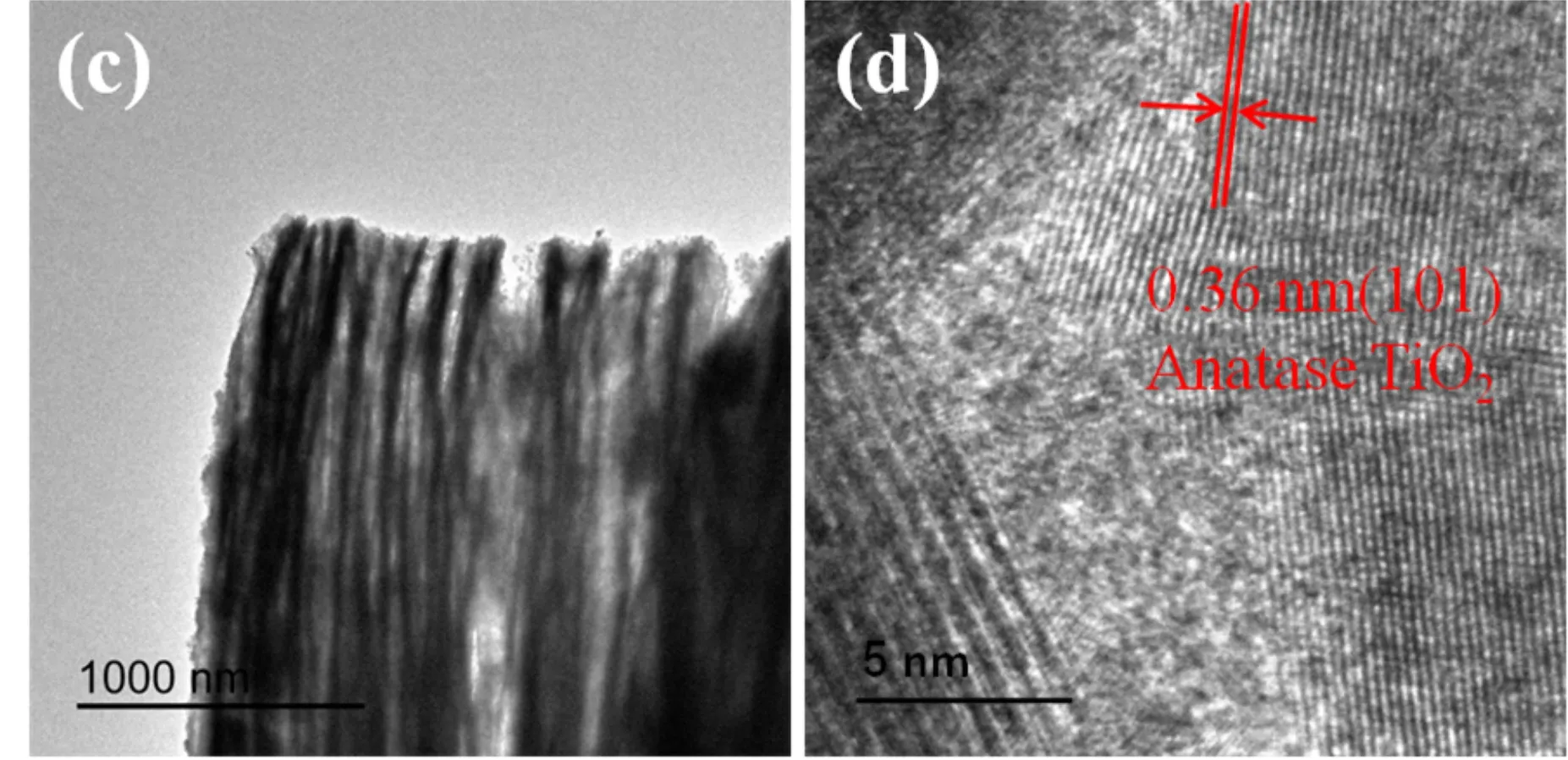
(c)TiO2/Ti3C2的TEM图 (d)TiO2/Ti3C2的HRTEM图图4 Ti3C2与TiO2/Ti3C2复合材料的TEM与HRTEM图谱
2.3 TiO2/Ti3C2复合材料的比表面积及孔径分析
图5为Ti3C2和TiO2/Ti3C2复合材料的N2吸附脱附等温曲线和孔径分布曲线.从图5(a)可以看出,Ti3C2和TiO2/Ti3C2复合材料的比表面积分别为6.021 1 m2g-1、109.894 6 m2g-1.负载后的比表面积有了很大程度的提高,TiO2/Ti3C2复合材料的比表面积是Ti3C2近18.25倍,这可能是由于大量细小的TiO2颗粒成功嵌入到Ti3C2层间,可防止Ti3C2片层的堆积,进而扩大片层之间的距离.
图5(b)为Ti3C2和TiO2/Ti3C2复合材料的孔径分布曲线.从图5(b)可以看出,TiO2/Ti3C2复合材料大部分的孔体积位于20~100 nm,且主峰位置大约在82 nm.应该指出的是,复合材料具有比Ti3C2大得多的孔体积.实验结果表明,较大的比表面积和较多的孔径有利于增加染料与光催化剂的接触面积,表面的活性位点越多,从而提高光催化剂降解的性能.
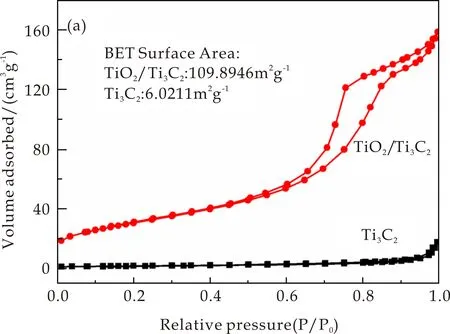
(a)Ti3C2和TiO2/Ti3C2复合材料的N2吸附脱附等温曲线
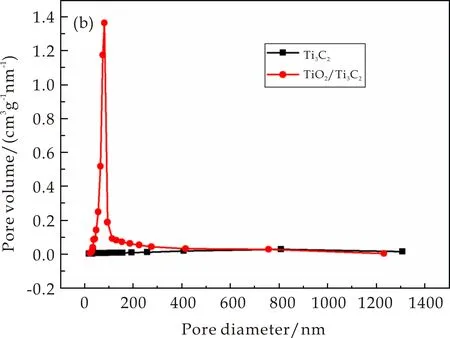
(b)Ti3C2和TiO2/Ti3C2复合材料的孔径分布曲线图5 Ti3C2和TiO2/Ti3C2复合材料的N2吸附脱附等温曲线与孔径分布曲线
2.4 TiO2/Ti3C2复合材料的光降解性能分析
从图6可以看出Ti3C2、TiO2和Ti3C2/TiO2纳米复合材料的光催化活性,其通过测量甲基橙(MO)的降解作为模型反应.与纯TiO2和Ti3C2相比,Ti3C2/TiO2纳米复合材料明显显示较高的光催化活性.在最初的30 min内,甲基橙被Ti3C2/TiO2复合材料迅速降解,而制备的TiO2的光催化降解性能相对较差,Ti3C2最差.降解60 min后,TiO2/Ti3C2纳米复合材料的降解效率达到90%,远高于TiO2(38%)和Ti3C2(28%)的降解效率.
从图6可以看出,Ti3C2在曲线的起点降解率小于1,说明其在暗反应阶段对染料还有一定的吸附作用,在光反应阶段也存在一定的光催化性能.这些实验的现象表明,Ti3C2/TiO2纳米复合材料在UV光照射下显示出比纯TiO2和Ti3C2更有效的光催化降解性能,这可能是由于Ti3C2和TiO2的协同作用,Ti3C2有类似于石墨烯独特的结构[20],同时兼具金属和陶瓷的优良性能,特别是高的电子传输效率可以有效地促进电子转移,这可以有效地减少电子-空穴对的复合,从而促进降解速率[22].
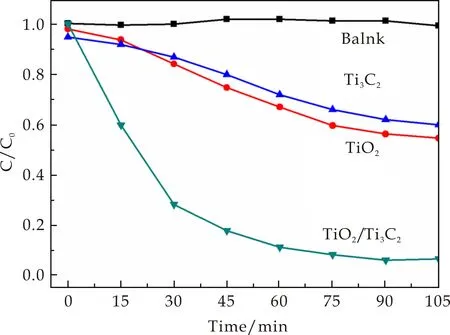
图6 Ti3C2、TiO2、TiO2/Ti3C2复合材料对甲基橙的光催化降解曲线图
图7是Ti3C2、TiO2与TiO2/Ti3C2纳米复合材料的光吸收性能图.从图7可以看出,Ti3C2在200~800 nm的波长范围内对光均有良好的吸收,说明Ti3C2既可以吸收紫外光也可以吸收可见光;TiO2只吸收紫外光,对大于400 nm波长的光几乎无吸收;相比之下,Ti3C2/TiO2纳米复合材料表现出更宽的光吸收,400 nm以上的光吸收明显比纯TiO2高,这可能归因于碳质材料的独特吸附[22],但比Ti3C2低,这是由于TiO2的形成.结合文献[22]可知,Ti3C2带隙窄且载流子迁移率高,表现出了金属性,因此,Ti3C2/TiO2纳米复合材料的光催化活性增强可能是由于存在金属Ti3C2,其与TiO2杂化可能有利于光吸收和光催化反应.
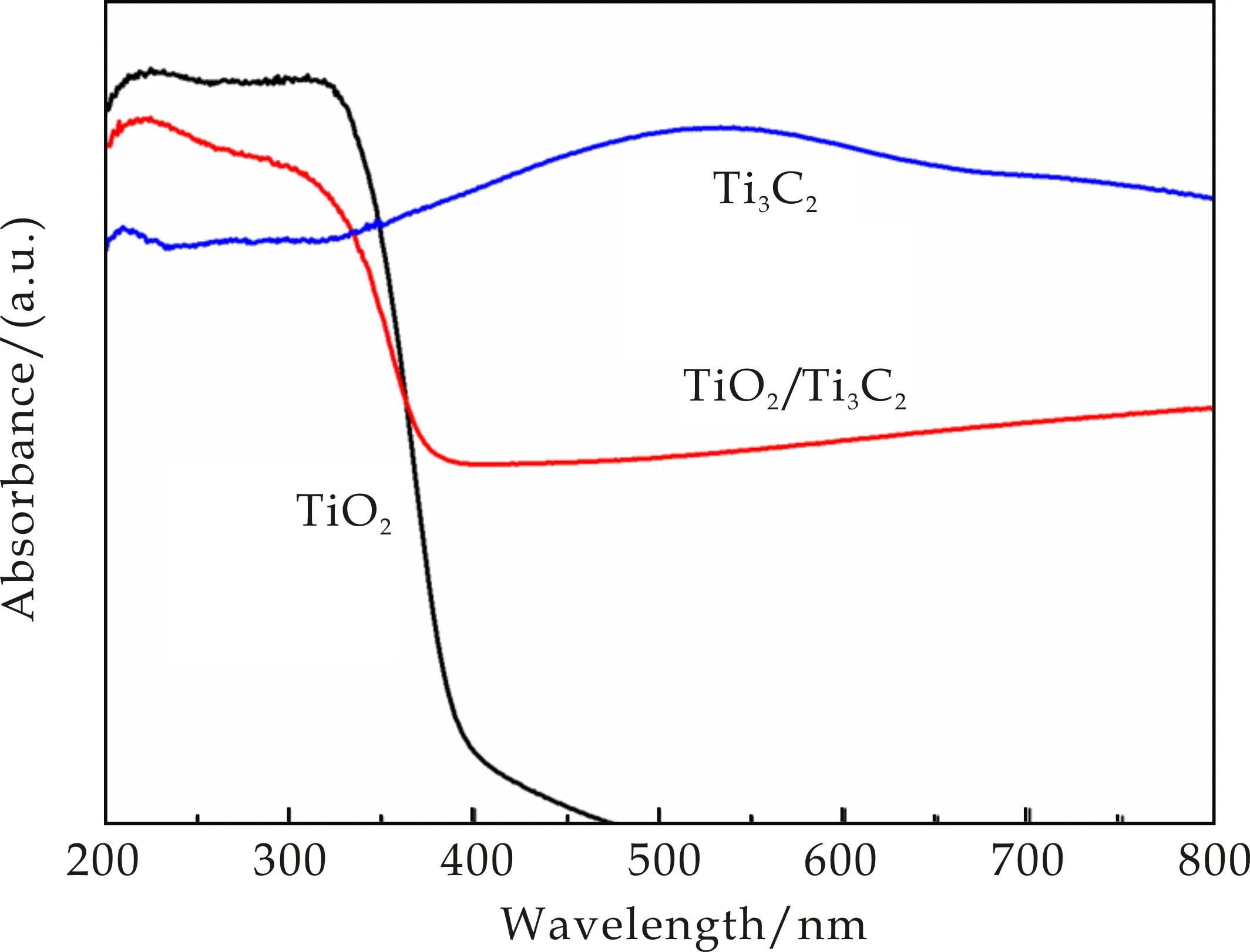
图7 Ti3C2、TiO2和TiO2/Ti3C2复合材料的紫外-可见吸收光谱
图8为TiO2/Ti3C2的可能光催化机理.其中,图8(a)是TiO2/Ti3C2复合材料的电荷转移图,可用密度泛函理论解释.通过文献[23]可知,Ti3C2的费米能级相对于正常氢电极(NHE)为-0.04 eV.TiO2的带隙为3.09 eV,其导带相对于NHE位于-0.25 eV,这比Ti3C2的费米能级更负,表明将光生电子从TiO2转移到Ti3C2是可行的.
图8(b)显示了TiO2/Ti3C2复合材料的光催化增强机理.首先,TiO2颗粒的成功嵌入产生了大的比表面积,这确保了TiO2/Ti3C2复合材料表面上的大量活性位点;其次,在暴露于紫外光时,光生电子和空穴被分离.由于Ti3C2的费米能级与TiO2导带之间的差异非常小,电子转移的能垒有效降低,光生电子很容易迁移到Ti3C2界面;第三,由于Ti3C2具有良好的电子传输类型,TiO2/Ti3C2复合材料具有高电子空穴分离效率并且可以有效地降低复合率.因此,复合材料的TiO2/Ti3C2光催化活性得到显著改善.

(a)TiO2/Ti3C2复合材料的电荷转移图示
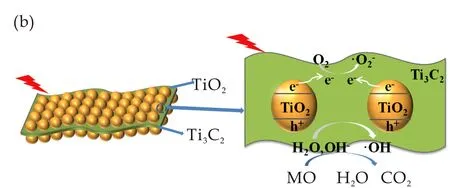
(b)TiO2/Ti3C2纳米复合材料可能的光催化机理的示意图图8 TiO2/Ti3C2复合材料的电荷转移及机理示意图
3 结论
本实验是由钛酸丁酯为钛源,采用简单的一步水热法成功制备了TiO2/Ti3C2纳米复合材料.实验结果表明:TiO2/Ti3C2纳米复合材料对于甲基橙的降解明显优于TiO2和Ti3C2,这可能是由于两者的协同作用,TiO2颗粒进入到Ti3C2层间,可以防止Ti3C2层的坍塌并增大层间距,从而增大比表面积,较大的比表面积有利于染料与催化剂的接触,增加活性位点;而Ti3C2由于良好的电子传输性能,有利于光生载流子的分离和快速传输;TiO2与Ti3C2的结合还可以有效减少其禁带宽度,增强对光的吸收效率,从而进一步增强光催化效率.
