溶藻弧菌RyhB的克隆与功能
2019-01-11贺小贤
刘 欢, 周 欣, 王 意, 贺小贤
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
0 引言
溶藻弧菌(Vibrioalginolyticus)是一种条件性致病菌,主要分布于世界各地的水体环境中,是多种经济养殖鱼类、虾类和贝类的病原菌,给海水养殖业带来了巨大的经济损失[1,2].此外,溶藻弧菌还是一种人-畜共患菌,在人体接触含有溶藻弧菌的水体时,可以通过创伤面或者耳朵等途径感染人体,导致创伤面感染以及中耳炎等病症的发生;还可经由食用受污染的水产品而引起肠胃炎的发生.而传统的抗生素防治易产生耐药性导致超级细菌的产生,同时会因药物残留而对人体造成危害,因此,开发绿色安全的新型防治手段迫在眉睫,而这就需要深入研究溶藻弧菌的毒力和致病性分子调控机理.
溶藻弧菌现已鉴定的主要毒力因子为胞外蛋白酶,另外还发现其运动性、生物被膜、铁载体等也与毒力和致病性紧密相关.而关于溶藻弧菌毒力调控机制的研究则主要集中在群体感应系统(Quorum sensing,QS)和sRNA分子伴侣蛋白Hfq等方面[3-8].群体感应系统通过合成、分泌、感知被叫做自诱导物(Autoinducer,AI)的信号分子,然后经过磷酸化与去磷酸化等作用将环境信号一步步地传递到关键的调控元件,通过其控制下游不同受控基因的转录表达水平,对外界环境的变化进行响应.QS对细菌不同生理功能都有重要的影响,如营养代谢、芽孢形成、鞭毛、生物被膜、毒力等.Hfq是反式非编码sRNA的伴侣蛋白,sRNA是细菌中一类不编码蛋白质、由60~300个碱基组成的小RNA.当外界环境变化时,细菌可以快速合成不同的sRNA,在伴侣蛋白Hfq的协助下,与靶标mRNA分子通过碱基配对而结合,影响靶标mRNA的稳定性或翻译活性,从转录后水平快速调控基因的表达来响应环境变化.目前,关于Hfq和sRNAs在细菌生长代谢、环境应激、毒力因子合成、对宿主的致病性等生理功能的重要调控作用的研究报道也是越来越多[9-13].
RyhB是细菌中目前己知调控靶mRNA数目最多的sRNA,通过转录后作用对细菌胞内铁平衡和病原菌的毒力进行调控.RyhB最早在大肠杆菌中被鉴定,如今也已经在其他细菌体内发现了与大肠杆菌RyhB同源或功能相近的sRNA分子.这些sRNA分子主要通过对病原菌体内铁摄取利用、生物被膜、耐酸性等功能的影响进而调控其致病性[14,15].霍乱弧菌体内的RyhB与大肠杆菌RyhB在碱基组成上具有较高的保守性,同源度较高,主要受铁摄取调控蛋白Fur和铁离子的负向调控[16].RyhB已在多种细菌中得到了鉴定,其除了参与铁代谢外,还参与细菌耐药性、压力应激、毒力、致病性等多方面的调控[17,18].
目前,关于溶藻弧菌中RyhB的克隆和功能鉴定还没有研究报道.本文首先利用生物信息学手段,在溶藻弧菌MVP01中筛选得到RyhB编码基因序列,进一步地通过无标记框内缺失手段将ryhB基因1~233位碱基全部从基因组中缺失,获得其缺失株,同时构建相应的互补菌株,通过不同表型检测对RyhB在溶藻弧菌体内的生物学功能进行初步研究.
1 材料与方法
1.1 材料
1.1.1菌株与质粒
大肠杆菌DH5α、DH5αλpir、SM10λpir、溶藻弧菌野生型菌株MVP01、自杀质粒pDM4、互补质粒pBAD33均由本实验时保存.pMD18T购自宝生物科技有限公司.互补菌株在培养过程中添加适量的阿拉伯糖及氯霉素.
1.1.2主要仪器和试剂
PCR热循环仪伯乐生命医学产品有限公司;水平核酸电泳仪购自北京六一生物科技有限公司;凝胶成像系统购自上海复日生物科技有限公司;阿拉伯糖、琥珀酸纳、HTDMA、无水哌嗪、LB培养基购自上海生工生物工程有限公司;TaqDNA聚合酶、Pfu高保真DNA聚合酶、DNA分子标准量、DNA琼脂糖凝胶回收试剂盒、质粒抽提试剂盒等都购自北京天根生化科技有限公司;限制性核酸内切酶、T4DNA连接酶购自宝日医生物技术有限公司.
第一,分析同异步沟通对顾客心流体验的影响,独立样本t检验显示,同步沟通组的心流体验值显著大于异步沟通组的分值(M同步=5.19 > M异步=4.11,df=120, t=5.956,p<0.01),假设1再次得到验证。
TSS限铁培养基:在1L容器中称量NaCl30g、琥珀酸钠5g、KCl3.7g、CaCl20.113g、MgCl20.1g、NH4Cl1.1g、KH2PO40.272g、Na2SO40.142g、Tris碱12.1g和Glucose4g,补水到1L.pH调节至7.4.灭菌备用.
CAS溶液配制方法为:将6mL10mM HTDMA溶液加到100mL刻度瓶,1.5mL铁离子溶液(1m MFeCl3,10mM HCl)和7.5mL2mM的CAS溶液缓缓加入,并不断搅拌.4.307g的无水哌嗪溶解在水中,加入6.25mL12M HCl.将此缓冲液加到刻度瓶,补加水至100mL.
1.1.3引物
表1为本文所使用的主要引物序列信息,由上海捷瑞生物工程有限公司合成.

表1 实验中所使用的引物
1.2 实验方法
1.2.1 ryhB基因的克隆与分析
根据已公布的溶藻弧菌MVP01基因组和霍乱弧菌以及大肠杆菌中的ryhB基因序列,利用生物信息学手段对其进行比对分析,筛选溶藻弧菌中的ryhB基因序列,设计特异性引物对ryhB基因进行克隆.在此基础上,利用Mfold对其进行二级结构预测分析(http://unafold.rna.albany.edu/?q=mfold).同时,为了探究RyhB可能参与的溶藻弧菌生理进程,利用在线生物信息学软件TargetRNA2(http://snowwhite.wellesley.edu/target)对RyhB在溶藻弧菌体内的靶标mRNA进行预测.
1.2.2ΔryhB突变株的构建
以溶藻弧菌MVP01基因组为模板,以引物ryhBupF和ryhBupR、ryhBdoF和ryhBdoR分别扩增获得上下游同源臂片段ryhBup和ryhBdo.将目的产物进行胶回收,并以其为模板,同时以ryhBupF和ryhBdoR为引物经overlap PCR将上下游同源臂片段ryhBup和ryhBdo连接起来,得到缺失了第1~233 bp碱基序列的ΔryhB片段.通过限制性内切酶SalI和SacI对ΔryhB片段与自杀质粒pDM4进行双酶切,后对酶切后的片段进行连接,得到重组质粒pDM4-ΔryhB,并分别转化大肠杆菌DH5αλpir和 SM10λpir,并挑选含有重组质粒的阳性克隆株,作为供体菌株,与受体菌株溶藻弧菌MVP01进行接合,通过两轮同源重组交换获得突变株.第一轮利用溶藻弧菌氨苄青霉素抗性和自杀质粒的氯霉素抗性的正向选择标记筛选得到第一轮的单交换菌株,进而再利用自杀质粒的特性,以蔗糖作为反向筛选压力,获得框内缺失突变株ΔryhB.
1.2.3 互补菌株ryhB+的构建
以MVP01基因组为模板,利用互补引物对ryhBcomF和ryhBcomR扩增获得含有完整ryhB基因的DNA片段后,克隆至pDM18-T载体中,通过限制性内切酶切割后与互补质粒pBAD33连接得到重组质粒pBAD-ryhB,转化到大肠杆菌DH5αλpir中,得到阳性克隆后抽提回补质粒pBAD-ryhB,进而转化至供体菌株-大肠杆菌SM10λpir中.最终通过接合实验将互补质粒pBAD-ryhB接合至受体菌ΔryhB中,在含有氨苄青霉素和氯霉素的双抗平板上挑取菌落,利用互补引物通过菌落PCR筛选得到互补菌株ryhB+.
1.2.4 限铁条件下溶藻弧菌的培养
将不同溶藻弧菌菌株进行活化培养后接种至新鲜的TSS限铁培养基中过夜培养,之后按1%接种到TSS限铁培养基中培养24 h.
1.2.5 铁载体定性检测
利用CAS法对不同菌株限铁条件下的上清液中铁载体的含量进行检测分析.具体操作如下:将在TSS限铁培养基中培养的菌液在8 000 rpm下离心15 min,在500μL上清液中加入等体积的CAS溶液,再滴加10μL 0.2 M的磺基水杨酸,漩涡震荡,在5 min内显粉红色或橙黄色即表明发酵液中含铁载体.
1.2.6 运动性分析
分别用含有0.3%(w/v)(软平板)和1.5%(w/v)(硬平板)琼脂粉的LBS平板测定各菌株的游动性和泳动性.将活化后的溶藻弧菌MVP01野生型菌株、ΔryhB突变株和ryhB+互补菌株用新鲜LBS液体培养基稀释,至OD600=1.0,吸取2μL菌液,滴加于平板上,软平板正置于30 ℃培养箱中,硬平板则倒置培养,至菌落生长至合适大小后,取出对其进行拍照.
2 结果与讨论
2.1 ryhB序列克隆与分析
在NCBI数据库中查找得到霍乱弧菌和大肠杆菌中的已鉴定的ryhB基因序列,随后通过BLAST将其与已公布的溶藻弧菌MVP01全基因组序列进行比对,筛得溶藻弧菌体内的ryhB基因序列,并以此序列为模板设计引物,以溶藻弧菌MVP01的基因组为模板,利用PCR扩增得到ryhB序列,结果如图1所示.其中泳道2和4扩增得到一条大小约为230 bp的特异性条带,与目标条带大小相一致,后对产物进行胶回收并进行测序.测序结果表明,溶藻弧菌ryhB基因序列长度为233 bp.

M:DNA分子量标准;1、3泳道:阴性对照(未加模版);2、4泳道:目的片段图1 ryhB基因的克隆
通过测序获得溶藻弧菌ryhB基因序列碱基组成后,利用Genedoc软件对溶藻弧菌,霍乱弧菌以及大肠杆菌中的ryhB基因序列进行比对分析,结果如图2所示(图2中“+1”表示基因转录起始位点).可以看到,3个菌种中ryhB基因在大小上存在较大差异,其中大肠杆菌中ryhB基因为131 bp,霍乱弧菌为147 bp,均远小于溶藻弧菌,这也反映出ryhB基因在不同种属进化过程中存在较大差异.此外,大肠杆菌和霍乱弧菌中ryhB基因均参与铁摄取的调控,且受到铁调蛋白Fur的调控.经序列比对发现,在溶藻弧菌ryhB基因上游-10至-35区也存在Fur蛋白结合位点序列,即Fur Box,且在种属中存在很高的保守性,但其所在位置略有差异(如图2红色方框所示).而Fur作为革兰氏阴性细菌的重要调控因子,主要参与细菌对铁的摄取与利用,即RyhB可能在Fur蛋白的调控下参与溶藻弧菌铁代谢过程.此外,三个菌株中ryhB基因其3′末端均具有Rho依赖型的终止子结构(如图2蓝色方框所示).
2.2 RyhB二级结构分析
在对RyhB编码基因进行测序的基础上,进一步利用Mfold在线分析工具对其转录的RNA分子进行二级结构预测发现.预测结果显示:RyhB二级结构具有5个RNA典型的茎环结构,在其3′端为多具U尾巴,同时在两个茎环结构间含有伴侣蛋白Hfq假定的结合位点AU富含区(如图3所示).Hfq对sRNA的识别不仅与碱基组成相关,而且还与结合位点序列周围RNA的二级结构相关,Hfq对于位于茎环结构间富含AU的ssRNA结合力更高.
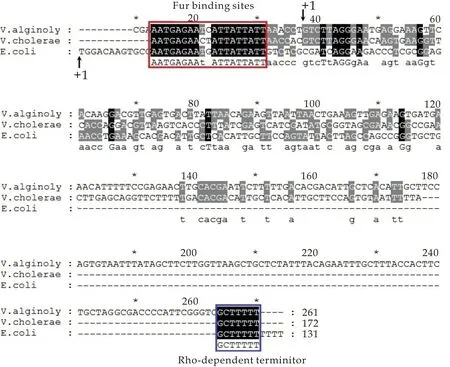
图2 不同细菌中ryhB基因序列的比对分析

图3 RyhB二级结构预测图
2.3 RyhB在溶藻弧菌中潜在靶标mRNA预测
反式sRNA分子可以与不同的目标mRNA分子之间形成不完全互补配对的碱基作用,影响目标mRNA分子自身的稳定性或翻译活性.为了进一步探究RyhB对溶藻弧菌不同生理功能的影响,首先利用生物信息学软件TargetRNA2对RyhB可能的靶标mRNA分子进行预测.RyhB在溶藻弧菌体内的潜在靶标基因共有32个,由表2所列举的部分基因可以看出,RyhB可以与溶藻弧菌不同生理功能相关的基因之间进行碱基配对,对这些基因都具有潜在的调控作用,部分靶标基因包括铁摄取相关蛋白FecB、鞭毛基体杆状蛋白B、钾离子摄取蛋白TrkH等.可见,RyhB可能通过对这些靶标基因的转录后调控作用,参与溶藻弧菌铁摄取、运动性、渗透压平衡等多种不同的生理进程的影响.

表2 RyhB部分靶标基因
2.4 ΔryhB突变株的构建
在克隆得到ryhB基因序列的基础上,进一步根据同源交换的原理利用自杀质粒得到缺失ryhB基因1~233位共233 bp的突变株ΔryhB.在含有10%蔗糖的反向筛选平板上,进行突变株的筛选,通过菌落PCR对所筛菌株进行初步验证,即利用位于突变株构建片段外侧的引物进行验证.结果如图4所示,1号泳道为野生型对照,2号泳道为ΔryhB突变株,可见ΔryhB突变株通过引物扩增获得的目的片段比野生型中的片段大小减少了约230 bp,即突变株构建时所设计的第1~233位共计233 bp.

M:DNA分子量标准;1:WT;2:ΔryhB图4 ΔryhB突变株PCR验证电泳图
随后对所得的突变株进行测序验证,抽提基因组,以其为模板,采用相同引物进行测序分析.测序结果证明,所筛得的PCR菌落验证正确的ΔryhB突变株中,ryhB基因第1~233位核苷酸序列被缺失掉,与设计完全相同,即成功构建获得ΔryhB突变株.
2.5 ryhB+互补株的构建
在成功获得了ΔryhB突变株后,利用带有阿拉伯糖启动子的广宿主互补质粒pBAD33进行互补菌株的构建,将含有完整RyhB编码基因序列连接至pBAD33质粒中,接合至ΔryhB突变株中.利用引物ryhBcomF和ryhBcomR对筛得的互补菌株进行PCR验证.电泳结果表明在ryhB+互补株中,互补引物对共扩增得到大小为233 bp的特异条带,而野生型菌株中也出现了233 bp的条带,突变株中则无特异性条带的产生.这是由于互补引物扩增的缺失片段大小为0 bp.证明携带有目的片段的回补质粒pBAD-ryhB成功接合到ΔryhB突变株中,ryhB+互补株成功构建(如图5所示).

M:DNA分子量标准;1:WT;2:ryhB+;3:ΔryhB图5 ryhB+回补菌株PCR验证电泳图
2.6 RyhB对溶藻弧菌铁载体含量的调控
通过对RyhB编码基因序列的分析发现,其上游-10至-35区存在铁调控蛋白Fur的结合位点序列,即RyhB可能在Fur的调控下参与溶藻弧菌铁代谢,且靶标mRNA预测分析也发现存在铁摄取相关蛋白的mRNA,因此,利用CAS法对不同菌株在限铁培养条件下铁载体含量的变化进行检测,结果如图6所示.
可见,溶藻弧菌野生型菌株在限铁条件下会合成一定量的铁载体(蓝色CAS溶液转变为较浅的橙黄色),而前期实验已鉴定参与铁载体合成的调控元件Hfq和LuxO作为阴性和阳性对照,结果与前期研究结果相一致,即Hfq表达受损后,铁载体合成受损;LuxO表达受损后,铁载体合成量则上升.当RyhB编码基因缺失后,CAS检测溶液显示为淡蓝色,未发生浅粉色或橙黄色的转变,即RyhB对溶藻弧菌铁载体的形成具有正向调控作用;而其相应的回补株则呈现与野生型类似的颜色变化,即当RyhB编码基因回补后,铁载体合成恢复到与野生型类似的水平.前期研究发现,sRNA分子伴侣蛋白Hfq对溶藻弧菌在限铁条件下的生长具有显著影响,而本论文发现RyhB对铁摄取载体的合成具有正向调控作用,后期可开展相关工作深入阐明Hfq与RyhB对溶藻弧菌铁摄取相关生理进程的调控机制.

图6 RyhB对溶藻弧菌铁载体含量的影响
2.7 RyhB对溶藻弧菌运动性的调控
前期靶标mRNA预测发现,RyhB的一个靶标mRNA分子为鞭毛基体杆状蛋白B,为了研究RyhB是否参与了溶藻弧菌运动性的调控并进一步验证靶标mRNA预测的可靠性,分别通过含有0.3%和1.5%琼脂的LBS软平板和硬平板对不同菌株的游动性和爬动性进行分析.结果如图7所示.

(a)爬动性分析

(b)游动性分析图7 RyhB对溶藻弧菌爬动性和游动性的影响
由图7可知:野生型菌株培养16 h后,在硬平板上显示出较为突出的爬动能力,沿着点样处向四周爬散开来;而ΔryhB突变株的爬动能力则基本丧失,在点样处四周没有出现明显的爬动情况,即仅在点样处进行生长繁殖;而互补菌株则表现出与野生型基本相当的爬动能力,沿着点样处向四周爬散开来(如图7(a)所示).而各菌株在软平板上的游动能力基本与硬平板相一致,即野生型菌株在软平板上过夜培养后,已经基本铺满了整个平板,且形成一定厚度的菌层;而ΔryhB菌株的游动能力几乎丧失,仅在点样处出现很小范围的游动;ryhB+互补株的游动能力则基本恢复到野生型菌株的水平,铺板整个平板(如图7(b)所示).可见,RyhB对溶藻弧菌的游动和爬动能力均具有较为显著的正向调控作用,并再次验证了利用生物信息学手段进行靶标mRNA预测结果的可靠性.在后续的工作中,可以深入研究RyhB与鞭毛基体杆状蛋白B的调控作用机制,同时对生物信息学手段预测的靶标mRNA相关生理功能进行进一步的研究.
3 结论
溶藻弧菌是海水中存在数量最多的病原菌,给世界范围内的海水产养殖业带来巨大经济损失.溶藻弧菌病害的传统防治手段为抗生素的使用,但长期使用易造成细菌耐药性的产生及药物残留等问题,开发新型安全的防治手段已成为迫在眉睫的问题,而这就需要明晰溶藻弧菌的毒力及其调控机制.sRNA是一类非编码的小RNA,通过转录后调控实现对环境等变化的快速响应.细菌体内存在多种sRNA,而每一种sRNA分子又存在多种靶标mRNA分子,因此sRNA广泛参与细菌的多种生理功能的调控,尤其对于病原菌的毒力和致病性具有重要调控作用.
RyhB作为一种sRNA分子,广泛存在于不同细菌体内,参与铁代谢、毒力因子合成、致病性、耐药性等多种生理进程[17,18].本文通过生物信息学手段在溶藻弧菌MVP01基因组中成功筛查得到RyhB编码基因,对其基因序列进行了克隆及分析,发现RyhB在不同细菌中存在一定的同源性,尤其在其上游启动子区域都存在铁摄取调控元件Fur的结合区,即Fur BOX,而且碱基组成高度保守.同时,通过生物信息学手段对RyhB在溶藻弧菌体内的靶标mRNA进行了预测,发现RyhB存在多个靶标mRNA,包括铁摄取、鞭毛合成、渗透压等相关组分.随后,通过同源重组构建了缺失其全基因序列的无标记基因框内缺失突变株,同时利用pBAD33质粒构建了相应的回补菌株.通过对比不同菌株不同生理特性发现:RyhB对溶藻弧菌铁载体的合成以及运动性都具有一定的正向调控作用,与生物信息学预测的靶标基因功能相符合,表明生物信息学手段分析的可靠性.
