基于“肺肠理论”和胆汁酸代谢网络探讨定喘汤对呼吸道合胞病毒感染大鼠肠道菌群调节的研究
2019-01-08崔振泽徐超迟磊
崔振泽, 徐超, 迟磊
呼吸道合胞病毒(respiratory syncytical virus,RSV)感染是引起婴幼儿时期毛细支气管炎的最常见病原,发病率较高,且相当多患儿未来会发展至支气管哮喘,严重危害儿童健康[1],其临床症状除表现为典型的咳嗽、气促外,还会出现恶心、呕吐、腹泻或便秘等胃肠道反应。有多种文献报道,呼吸道病毒侵害机体后,均可导致肠道组织发生病理改变[2-3]。祖国医学早已有言“肺与大肠相表里”,而现代医学也发现呼吸系统和消化系统两大黏膜器官之间有着密切关系[4]。所以说,无论是中医还是西医都已经深刻认识到肺部感染可能导致肠道损伤,也可能进一步影响了肠道菌群的变化。而已知RSV感染患儿常伴有大便性状和(或)次数改变,但是否会导致肠道菌群失调尚不得而知,亦未见相关报道。
代谢组学可以从代谢终端产物的角度整体性和系统性地阐释中医证的实质及中药复方的药效与作用机制。且前期的研究中发现,来自《摄生众妙方》的定喘汤不仅可以抑制RSV病毒复制,而且还可以通过调节免疫平衡来达到止咳平喘的功效[5]。本研究建立RSV感染大鼠肺炎模型,采用液相色谱质谱联用(LC-MS)技术分析正常对照组、RSV模型组和药物干预组大鼠血清中代谢物的相对含量变化,以初步阐释定喘汤调节RSV感染大鼠后机体胆汁酸代谢及肠道菌群的作用机制。
1 材料与方法
1.1 病毒 RSV Long株,来源于中国预防医学科学院病毒所毒种室,冻存于-80 ℃冰箱备用。测定大鼠RSV病毒半数致死量LD50为1×10-2/mL。
1.2 动物 健康3周龄左右的SPF级Wistar大鼠27只,雌雄各半,体质量均为(30±10)g,由辽宁本溪长生生物技术有限公司提供[许可证号:SCXK(辽)2010-0001]。
1.3 药物 参照《摄生种妙方》,定喘汤组由麻黄、杏仁、半夏、桑白皮、白果、款冬花各9 g,苏子6 g,黄芩12 g,甘草3 g组成,以上药物均购于辽宁中医药大学附属医院中药局。
1.4 试剂与仪器 Realtime PCR试剂盒(DRR047A,DRR820A,TaKaRa宝生物工程有限公司);乙腈(Merck,Germany);甲酸(Sigma-Aldrich,USA);超纯水(电阻率18.2 MΩ·cm)由MilliQ系统制备(Millipore,USA)。7500Real Time PCR仪(美国Applied Biosystems);Nano2000型超微量紫外分光光度计、低速冷冻离心机(美国,Thermo);电泳仪(DYY-10C);MicroChemi 4.2化学发光成像系统;ACQUITY UPLC BEH C8色谱柱(2.1 mm×50 mm,1.7 μm)(Waters,USA);Waters ACQUITY超高效液相色谱系统(Waters,USA);AB triple TOFTM 5600质谱(Applied Biosystems,USA)。
1.5 方法
1.5.1 定喘汤的制备 10倍量水浸泡30 min,煎煮90 min,趁热过滤;第2次用8倍量水煎煮60 min。合并2次滤液,再浓缩后制成含生药2 g/mL的药液备用。
1.5.2 造模、给药和模型评价 采用病毒液滴鼻法建立大鼠RSV感染模型。将Wistar大鼠按随机数字表法分为3组,即正常组、RSV模型组和定喘汤组,每组9只。除正常组外,其余各组在乙醚麻醉下经鼻腔接种RSV Long株病毒液,0.1 mL/只,正常组在同等条件下接种等量不含病毒的生理盐水,每日1次,连续接种3 d。各组在RSV Long株病毒液滴鼻2 h后开始灌胃,定喘汤组给药剂量相当于60 kg成人临床等效量,正常组与RSV模型组均予等体积的生理盐水灌胃,每日1次(人与大鼠等效剂量公式为:大鼠的剂量=6.3X mg/kg)。
模型评价分为一般行为观察和病理改变两方面。特征指标测定包括:(1)肺指数:各组大鼠分别于感染第7天,于无菌条件下取肺组织,称各组大鼠肺脏重量,计算肺指数。肺指数=肺脏重量(g)/体质量(g)×100%。(2)病理切片:取新鲜大鼠肺组织经固定、脱水、透明、浸蜡、包埋、切片、HE染色等处理,中性树胶封固,观察各组大鼠肺组织炎症变化情况。
1.5.3 样品的采集和处理 正常组、RSV模型组及定喘汤组大鼠分别于感染第3天,摘眼球取血,将血置于血清分离管中,放置2 h,3 000 r/min离心15 min,收集血清,后置于-80 ℃冰箱内冻存。
测定前,取血清,室温解冻,8 000 r/min离心10 min,取上清液100 μL,加入400 μL纯水,涡旋1 min,8 000 r/min离心10 min,取上清液即可。
1.5.4 LC-MS代谢组学分析 液相条件:色谱分离系统采用Waters ACQUITY超高效液相色谱(UHPLC)(Waters,USA)。采用ACQUITY UPLC BEH C8(2.1 mm×50 mm,1.7 μm)色谱柱,柱温60 ℃,进样量5 μL。流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈。洗脱梯度:5% B保持0.5 min,2 min时线性升至60% B,8 min时线性升至100% B,保持2 min,0.1 min内回到初始比例5% B以平衡色谱柱,总分析时长12 min。流动相流速为0.4 mL/min。
质谱条件:使用AB triple TOFTM 5600质谱(Applied Biosystems,USA)作为检测系统。雾化气流流速:55 psi;辅助加热气流流速:55 psi;气帘气流速:35 ps;一级扫描范围m/z 80~1 000 Da,碰撞电压10 V;二级扫描范围m/z 60~1 000 Da,碰撞电压40 V;正离子喷雾电压5.5 kV,离子源温度550 ℃;负离子喷雾电压4.5 kV,离子源温度450 ℃。
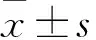
2 结果
2.1 定喘汤干预RSV感染大鼠的效应评价
2.1.1 一般行为观察 RSV感染大鼠后的第3天,与正常组相比,大鼠的精神状态、反应度、皮毛状态等一般情况发生了较差的变化;应用定喘汤干预后,大鼠的精神状态、反应度、皮毛状态等一般情况明显好转,见表1。

表1 定喘汤对RSV感染大鼠一般状态的影响
2.1.2 特征指标测定
2.1.2.1 肺指数 RSV感染组大鼠第3天的肺指数明显增加,与正常组相比,差异有统计学意义(P<0.05);与RSV感染组比较,定喘汤组大鼠的肺指数明显降低,差异有统计学意义(P<0.05),见表2。
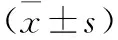
表2 定喘汤对RSV感染大鼠肺指数的影响
注:与正常组比较,aP<0.05;与RSV模型组比较,bP<0.05。
2.1.2.2 病理变化 见表3和图1(见封三)。
2.2 定喘汤干预RSV感染大鼠血清中代谢物谱分析 PCA能从总体上反应各组样本之间的总体代谢差异和组内样本之间的变异度大小,其可以对原始数据样品分布进行总体呈现,考察定喘汤干预RSV感染大鼠后血清中代谢物变化,结果见图2。如图所示,正常组、RSV模型组与定喘汤组的血清样本在PCA得分图中完全分离,说明3组的血清代谢物谱有明显的差异,定喘汤可能影响RSV感染大鼠血清中的代谢物,从而对其体内的代谢紊乱进行调节。

图2 3组大鼠血清代谢产物散点分布图
2.3 定喘汤对RSV感染大鼠血清中相关代谢标志物的影响 与正常组大鼠比较,RSV感染组大鼠血清中柠檬酸(CA)、牛磺胆酸(TCA)、牛磺熊脱氧胆酸(TUDCA)、鹅脱氧胆酸(CDCA)、7-酮基脱氧胆酸(7-ketodeoxycholic acid)及苯乙酸(Phenylacetic acid)水平显著升高,甘氨鹅脱氧胆酸(GCDCA)显著下降,差异有统计学意义(P<0.05);与RSV模型组比较,定喘汤组大鼠血清中柠檬酸(CA)、牛磺胆酸(TCA)、牛磺熊脱氧胆酸(TUDCA)、鹅脱氧胆酸(CDCA)、甘氨鹅脱氧胆酸(GCDCA)、7-酮基脱氧胆酸(7-ketodeoxycholic acid)及苯乙酸(Phenylacetic acid)均有所回调,差异有统计学意义(P<0.05)。见表4。

表3 定喘汤对RSV感染大鼠病理变化的影响
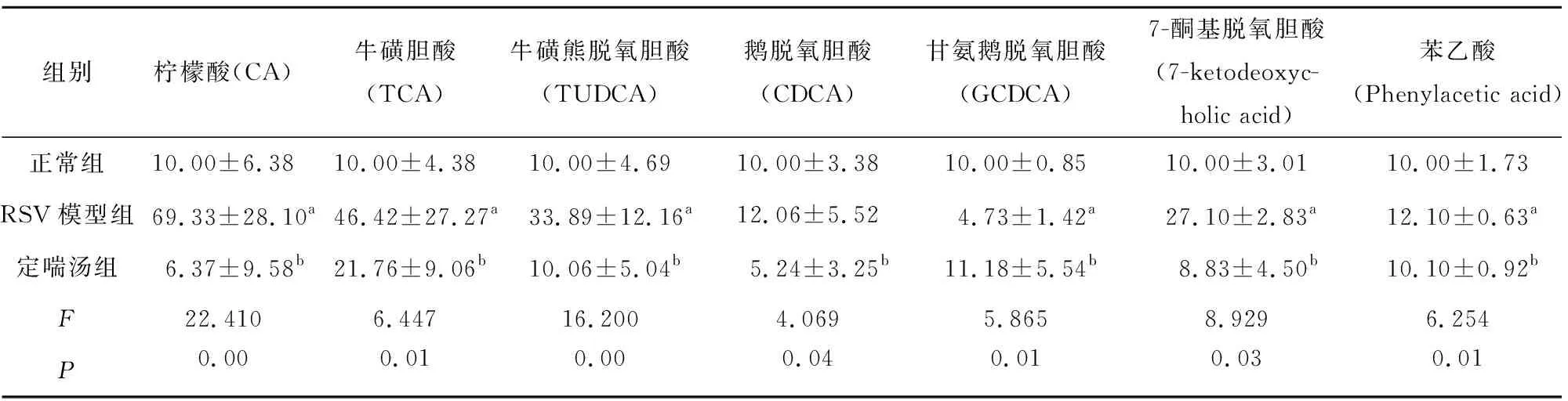
表4 定喘汤对RSV感染大鼠血清中代谢产物的影响
注:与正常组比较,aP<0.05;和模型组比较,bP<0.05。
3 讨论
在中医理论中,“肺与大肠相表里”不仅仅是指肺与大肠的里外深浅等解剖位置,更是以脏腑、气化和经络为基础,来诠释肺和大肠两者病理生理关系。如《素问·咳论》云:“肺咳不已,则大肠受之;大肠咳状,咳而遗矢”;又如《症因脉治泄泻论》云:“又有痰积在肺肺移于大肠清肺经之痰则大肠之泻自止”,均阐释了若肺的生理功能运行失常,则易下遗至大肠。临床实践也充分证明了这一点,患儿如出现咳嗽、气促及喘息等症状,往往也会合并腹胀、便秘、腹泻等,且预后往往较差。许多中医名家已把“肺肠理论“运用到临床实践中多年,疗效显著[6-7],而定喘汤在治疗毛细等喘息类疾病伴恶心、呕吐、腹泻症状出现时效果也颇为不错。定喘汤立方旨在宣升开肺,降逆平喘、清热化痰,方中以麻黄、黄芩、桑白皮宣发风热、驱邪外出,以白果、款冬花、半夏、苏子、杏仁、甘草降气化痰,止咳平喘。本方宣升与清降并用,发散与收敛兼施,从多个方面体现其药理作用,使气机升散有度,降泄得宜,可充分发挥化痰平喘的功效。不仅如此,RSV感染患儿出现的恶心、呕吐、腹泻或便秘等胃肠道症状通过此方也得到了缓解,无论患儿肺气上逆出现咳嗽的同时也伴有胃气上逆所致的恶心、呕吐,还是内热导致的腹泻及便秘,定喘汤均可以发挥其降气、清热、收敛涩肠的功效得到解决。故从临床角度可证实,定喘汤既可治疗RSV感染后引起的呼吸系统症状,又可缓解其导致的胃肠道症状。
RSV感染可使机体胆汁酸代谢发生改变,同时也间接影响了肠道菌群的变化。人及动物的肠道内拥有复杂的微生物群落,并发挥着生物屏障、免疫调节及营养支持等作用,而这其中胆汁酸与肠道细菌却具有相互依赖、相互竞争、相互抑制的复杂关系[8-9],因此本实验通过RSV感染大鼠后机体胆汁酸代谢变化来间接探讨了其肠道内菌群变化。PCA散点图显示,正常组和RSV感染组的血清样本能够完全分离,说明两组的血清胆汁酸代谢物谱有明显的差异,进而提示RSV感染后机体胆汁酸代谢出现紊乱。结果显示,RSV感染大鼠后机体柠檬酸(CA)、牛磺胆酸(TCA)、牛磺熊脱氧胆酸(TUDCA)、鹅脱氧胆酸(CDCA)、甘氨鹅脱氧胆酸(GCDCA)、7-酮基脱氧胆酸(7-ketodeoxycholic acid)及苯乙酸(Phenylacetic acid)均发生改变。脱氧胆酸属于次级胆汁酸,是初级胆汁酸在肠道内受到细菌作用,进行7α脱羟作用生成的胆汁酸;而鹅脱氧胆酸则是次级胆汁酸被肠道的代谢产物重吸收生成的,可见胆汁酸代谢是受肠道菌群影响的。生理状态下,肠道内胆汁酸激活FXR后,可以维持肠道菌群稳态,防止细菌移位,抑制有害细菌的生长[10-11]。而本结果显示RSV感染大鼠后机体胆汁酸代谢产物发生了变化,这在一定程度上说明了其肠道菌群也相应的发生了变化,即RSV感染大鼠存在肠道菌群失调的状态。
进一步研究发现,病毒可通过黏膜-免疫反应损伤肠道黏膜并改变肠道菌群组成,流感病毒感染小鼠后可使其肠道内肠杆菌和肠球菌明显增加,乳酸杆菌和双歧杆菌的量则显著降低[12],且有文献报道,在RSV诱导的哮喘急性发作小鼠模型中,口服约氏乳酸杆菌可以明显改善RSV诱导的哮喘反应[13]。可见,呼吸道病毒感染不仅会导致局部菌群变化如上呼吸道、下呼吸道,还会导致远端如肠道菌群结构的改变,而肠道的菌群变化反过来通过全身反应又可影响呼吸道的防御作用。
RSV感染大鼠经定喘汤干预后发现,其不仅通过胆汁酸代谢而且可直接通过肠道吸收来调节菌群紊乱。大量研究均证明中药能够显著调整肠道菌群失调、促进有益菌生长、抑制有害菌过度繁殖,平衡这些益生菌和致病菌的数量,从而使肠道内环境保持健康的状态[14]。PCA散点图显示,定喘汤和RSV感染组的血清样本能够完全分离,说明两组的血清胆汁酸代谢物谱有明显的差异。结果显示,定喘汤干预后胆汁酸变化趋于平缓变化,各指标均有所回调,提示定喘汤可能影响RSV感染大鼠血清中的胆汁酸代谢物,从而对其体内的胆汁酸代谢紊乱及肠道菌群进行调节。其中苯乙酸属于多酚类,由黄酮类化合物经肠道微生物代谢C环断开,生成B环酚酸类物质,黄酮醇经代谢C环开裂生成。诸多实验证明黄酮类化合物对肠道细菌的数量和种类有一定的影响[15],某些黄酮类化合物具有抗菌作用,会抑制肠道细菌的生长某些黄酮类化合物及其代谢产物可以刺激降解菌生长使其成为优势菌群。由此可见,肠道菌群在整个过程中起着关键作用,与黄酮类化合物在体内的代谢密不可分。多酚以及其被肠道菌群代谢的产物,能选择性调节肠道中易感微生物的生长,选择性的促进有益菌群(如乳酸菌)生长,抑制有害菌的增殖,也即引发肠道微生态的改变[16]。
本文通过中医“肺与大肠相表里”“肺肠同治”理论,基于在定喘汤干预RSV感染大鼠效应验证基础上,应用LC-MC技术分析大鼠血清中胆汁酸代谢产物,结合模式识别和数据分析,发现7个与定喘汤抗RSV感染作用相关的潜在的胆汁酸代谢标志物,进而验证了定喘汤不仅可以直接作用于RSV感染引起的肺部炎症,调节免疫平衡,止咳平喘,而且还可通过调节机体胆汁酸代谢途径间接调节肠道菌群紊乱,即“肺肠同治”,也为深入探讨定喘汤的作用机制和临床应用提供依据。
