环孢素A代谢物的研究概况Δ
2020-05-29王晓雪陈文倩李朋梅张相林
陈 鑫,王晓雪,唐 坤,李 江,陈文倩,秦 伟,张 丹,李朋梅,张相林#
(1.中日友好医院药学部,北京 100029; 2.桂林医学院附属医院药学部,广西 桂林 541001)
1 概述
环孢素A(cyclosporine A,CsA)是由8种氨基酸组成的环状11肽,是一种强有效的钙调神经蛋白免疫抑制剂[1]。在临床上,CsA常被用于预防肾、肝、心脏和肺等器官移植患者及骨髓移植后患者的排斥反应[2-3];也被用于类风湿关节炎等自身免疫性疾病[4]。但CsA的不良反应较多,使用时需要进行治疗药物监测。
2 CsA的体内转化与个体差异
CsA主要由胃肠道中肝药酶CYP3A家族中的CYP3A4、CYP3A5代谢[5-6]。从尿液或胆汁中分离得到的代谢物仍然是环状多肽,其数量已超过30种[7-8]。CsA发生单一氨基酸的羟基化或N-去甲基化生成初级代谢物[9]。主要的初级代谢物有3种,亲脂性最接近CsA的AM4N为4号氨基酸(4-AA)发生N-去甲基化;醚溶性的AM1为1-AA羟基化;AM9为9-AA羟基化。初级代谢物进一步发生环化、羟基化和氧化等,生成次级代谢物[10]。AM1环化得到AM1c,9-AA羟基化得到AM19;AM19及AM1c9可由AM1及AM1c经9-AA羟基化生成。AM9、AM1的4-AA发生N-去甲基化得到AM4N9、AM14 N。AM1氧化得到AM1A。CsA及其主要代谢物的结构见图1、表1;CsA主要代谢物的转化路径见图2。
在自身免疫性疾病患者体内,AM1和AM4N的血药浓度分别为CsA的35%和4.5%[11]。AM1在肾移植患者体内的血液浓度约为CsA的7倍[12];在肝移植患者血液中的平均谷浓度为CsA的174%[13]。AM9在肾移植、肝移植和心脏移植患者血液中的浓度相近,约为CsA的50%~60%[14]。AM1的血药浓度受疾病和移植类型的影响更显著,个体差异大。
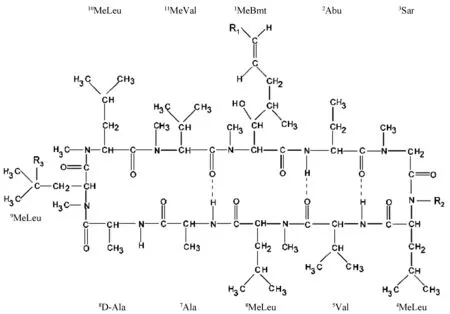
图1 CsA及其主要代谢物的结构
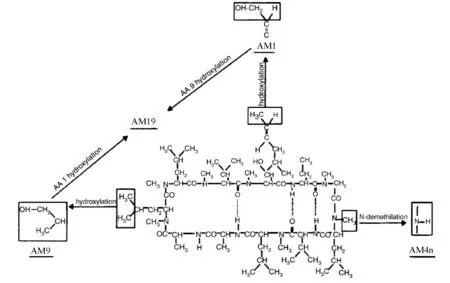
图2 CsA主要代谢物的转化路径
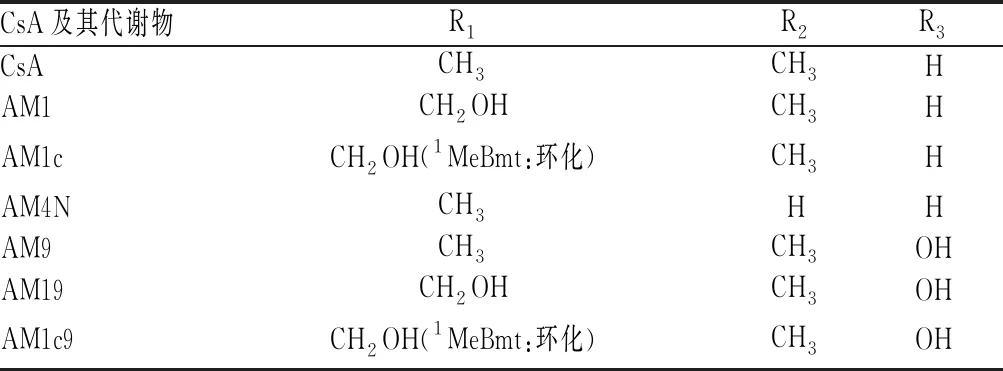
表1 CsA及其主要代谢物的结构
注:1MeBmt表示1号氨基酸(4R)-4[(E)-2-丁烯基]-4,N-二甲基-L-苏氨酸
Note:1MeBmt means amino acid No.1 (4R)-4[(E)-2-butenyl]-4,N-dimethyl-L-threonine
CsA及其代谢物主要通过胆汁清除[15]。利福平、苯妥英和苯巴比妥等酶诱导剂可促进CsA的转化,使CsA浓度降低而其代谢物浓度升高[16]。酮康唑等酶抑制剂则可使CsA转化减少,CsA浓度升高,CsA代谢物生成减少,且对次级代谢物的生成抑制更显著[17]。
CYP3A4在CsA的代谢过程中占据主导地位,可催化3种主要的初级代谢物形成[18];而CYP3A5只能催化AM9产生较可观的数量[19]。CYP3A4催化生成AM9的效率约为CYP3A5的2~3倍,选择性更高[19]。
在肾脏CYP3A5表达者中,由于肾小管上皮细胞内CYP3A5*1等位基因的存在及CYP3A5蛋白的表达,AM19、AM1c9经肾微粒体转化的形成增加[19];肾脏内AM19、AM1c9的蓄积浓度更高,并且不受胃肠道及肝脏CYP3A5基因型对次级代谢物全血蓄积的影响[20]。但是,CYP3A5的基因多态性对于CsA代谢清除率的影响有限[21]。CYP3A5*1*1基因型患者的CsA口服清除率比CYP3A5*3*3基因型的患者低37.87%[22]。CsA及其代谢物的总浓度在三种CYP3A5基因型患者体内的差异无统计学意义(P>0.05),但是CsA谷浓度却差异显著。CYP3A5*3变异对CsA的代谢几乎无影响[23]。因此,可通过CYP3A5的表达及功能的差异,部分解释全血及肾脏中CsA代谢物浓度的个体间差异。
3 CsA代谢物的免疫抑制活性
体外淋巴细胞增殖实验(有丝分裂原反应)及混合淋巴细胞反应(mixed lymphocyte reaction,MLR)等实验结果证明,AM1、AM9和AM4N都能抑制同种异体反应性T细胞的增殖[16]。AM1、AM9和AM4N在不同模型中的免疫抑制活性不同,大致相当于CsA的10%~30%,表明CsA代谢物只具有较弱的效应[24]。CsA代谢物还能抑制MLR中白细胞介素-2的产生和细胞毒性T淋巴细胞的产生[25]。
CsA与其代谢物之间或CsA代谢物之间存在协同作用[26]。当体内活性代谢物的浓度较高时,较低浓度的CsA也能发挥较强的免疫抑制效果[9]。AM1对淋巴细胞的抑制作用较强,且当低浓度CsA存在时,AM1的抗淋巴细胞增殖作用增强[27]。但直接口服很难使AM1达到产生效应的浓度[28]。AM1与CsA的浓度比(AM1/CsA)可在治疗期间出现改变,骨髓移植患者的AM1/CsA在治疗期间的5个月内增加了3倍[14];对于AM1/CsA更高的肝移植患者,同时监测二者的血药浓度,对于临床疗效的预测更有意义[29]。
CsA初级代谢物AM1、AM9或AM4N的免疫抑制活性较强,而次级代谢物的免疫抑制活性较弱[30]。AM1的血药浓度相对于其他代谢物更高,体外免疫抑制活性也更显著。AM9的体外免疫抑制活性弱于AM1。AM1转化后的次级代谢物中,AM19几乎没有活性,AM1c则活性较弱。CsA及其代谢物的活性由强至弱依次为:CsA>>AM1>AM9、AM4N、AM1c、AM1c9及AM19>>AM4N9、AM14 N及AM1A[31]。
近来还发现,AM1及二氢CsA、三氢CsA和去甲基羧基CsA等代谢物与CsA的比值与舒张压具有相关性;AM1、AM9与CsA的比值与心血管危险因素(如肥胖、糖尿病和高尿酸血症)也有关联[32]。
4 CsA代谢物的毒性作用
肾脏内CsA代谢物的高浓度,可增加钙调神经蛋白免疫抑制剂的肾毒性风险[33]。但代谢物的作用有限,因此,其毒性与CsA相当或稍弱[34-35]。
肝移植患者中,AM1c9的浓度与肌酐清除率呈负相关,在血清肌酐水平升高的同时或之前即出现代谢物浓度升高[36]。AM1及AM4N能引起肾小球滤过率降低,增加羟甲基化代谢物的累积[37]。在出现肾损伤的肾移植患者中,羟甲基化代谢物比例更高,其中三羟基化代谢物可能最适合作为肾毒性出现的标志物[37]。
CsA与酮康唑合用时,肾毒性风险降低,推测次级代谢物与肾毒性关系更密切[38]。AM19及AM1c9能增加内皮素的释放,改变肾系膜细胞功能,可能是引起肾损伤的原因[39]。在肾移植患者中,AM19及AM1c9与C反应蛋白、白细胞介素-6的浓度具有正相关性[40]。在CsA治疗后肾功能不全或表达CYP3A5的患者中,血液及尿液中AM19、AM1c9的浓度较高,肾毒性的发生风险也更高[36,40]。但也有研究结果认为,次级代谢物浓度的升高可能是肾损伤的结果,而非引起肾毒性的原因[20]。
5 CsA代谢物对检测的干扰
高效液相色谱法(high performance liquid chromatography,HPLC)及高效液相色谱串联质谱法(high performance liquid chromatography-mass spectrometry,HPLC-MS)可分别单独检测血液、胆汁和尿液中的CsA及其代谢物[41-45]。HPLC或LC-MS可检测到多种CsA代谢物,其中以AM1、AM9和AM19为主,AM1的质量浓度为23~717 μg/L,AM9的质量浓度为<15~144 μg/L,AM19的质量浓度为<15~507 μg/L;AM4N、AM1A和AM1c较少,AM4N的质量浓度<31 μg/L,AM1A的质量浓度为<15~269 μg/L,AM1c的质量浓度最低;AM14 N、AM1c9的质量浓度则低于检测下限。
放射免疫分析(radioimmunoassay,RIA)使用的多克隆抗体与CsA代谢物及CsA存在交叉反应,代谢物对CsA的检测有贡献;主要CsA代谢物的交叉反应率:AM1为8%,AM9为15%,AM4N为4%,AM1c为2%,AM19为5%,因此,RIA测得的CsA浓度要高于HPLC[46]。在胆汁中,RIA检测到的CsA及其代谢物的总浓度为HPLC检测到的CsA浓度的18~36倍,但仍低于CsA吸收量的50%[47]。对于荧光偏振免疫分析(fluorescence polarization immunoassay,FPIA),代谢物与单克隆抗体间发生交叉反应对检测结果的贡献程度更低,测得的药物浓度更接近于循环中存在的免疫抑制剂的浓度[48]。但对于CsA,FPIA的检测结果同样偏高[49]。
移植类型、术后时间和采血时间都会对CsA代谢物与CsA的比值造成影响[50-51]。温度、血容量、红细胞比容、CsA浓度和全血样品的孵育时间直接影响到CsA及其代谢物在血浆和细胞中的分布,并可影响血浆样品中的相对含量[52]。CsA及其代谢物的溶解性质不同。CsA与AM4N在4 ℃时更易溶于水,AM1在37 ℃时更易溶于水,AM9在4、22或37 ℃时的溶解性相同[52]。在37 ℃,红细胞比容范围为24%~47.8%时,血浆中CsA及其代谢物的相对浓度为5%~95%;随着温度降低,血浆中可检测的量也随之减少;当CsA、AM9、AM1或AM19的质量浓度>500~1 000 μg/L时,其在血浆中分布的相对含量随之增加[52]。移植患者的病理状态也可影响代谢物的分布。糖尿病患者体内AM9/CsA比值低于非糖尿病肾移植患者,其他代谢物(AM1、AM19及AM1c)与原型药的比值未发现明显差异[53]。而在高甘油三酯血症和高尿酸血症患者中,AM1/CsA的比值更高[32]。
6 总结
CsA的代谢物数量多,部分代谢物的转化途径仍处于推论阶段。CYP3A5基因型的差异对于CsA的代谢也具有影响。迄今对3种主要的初级代谢物的研究较多。AM1、AM9和AM4N不仅具有较为显著的免疫抑制活性,其肾毒性也同样需要关注。次级代谢物中的AM19及AM1c9与肾毒性关系密切。代谢物的种类与分布、检测方法都对CsA的浓度测定有不同程度的影响。因此,应进一步研究代谢物的代谢谱,掌握CsA与其代谢物的药动学过程,验证代谢物的体内免疫抑制活性及肝肾毒性,确定代谢物与CsA之间的协同作用关系,建立同时测定CsA及其特定代谢物浓度的方法,根据CsA与其代谢物之间的关系,更精确地进行治疗药物监测。
