鼻渊舒口服液对慢性鼻-鼻窦炎患者鼻腔表皮葡萄球菌细菌生物膜形成的影响*
2019-01-07谢慧李玲珑窦豆曹刘余菲刘奕彤
谢慧 李玲珑 窦豆 曹刘 余菲 刘奕彤
慢性鼻-鼻窦炎(chronic rhino-sinusitis,CRS)是 耳鼻咽喉科常见的慢性疾病之一[1]。研究证实CRS的反复发作以及难治愈性与鼻-鼻窦黏膜表面细菌生物膜(bacterial bioform,BF)形成有关[2]。传统的抗生素对形成BF的细菌没有作用,这也是慢性感染持续存在的原因。
BF形成受众多因素调控,其中细菌群体感应系统(quorum sensing system,QS)是目前已知的调控细菌行为学改变的主要通路之一[3-5]。QS系统是细菌根据群体中密度变化来调控自身基因表达的一种群体行为机制,广泛存在于G+及G-菌中,自诱导分子(autoinducer,AI)是其重要信号分子。微生物能合成和分泌自诱导分子如AI-2[6],后者能监控周围环境中细菌数量变化。当细菌的数量积聚增加到一定程度,自诱导分子能够进出细胞体内与受体结合,激活靶基因与基因编码酶的表达,当胞外信号分子浓度达到某一阈值时,细菌启动一系列基因表达,从而调节诸多行为,如BF形成、毒力因子释放等[7,8]。许多革兰菌包括表皮葡萄球菌[9,10]均可以编码产生AI-2信号,AI-2信号可影响生物膜形成构成,常作为衡量BF存在与否的重要指标。而luxS是合成AI-2的关键酶。当luxS表达被干扰以后,可降低AI-2水平,降低细菌的生长和生物膜的形成能力,减弱细菌毒力。因此许多研究着眼于研究病原菌中luxS/AI-2调控的最终目的是建立一种新的抗微生物感染的药物靶点[9]。
前期临床研究显示鼻渊舒口服液治疗CRS效果良好,但体外抑菌实验显示其并不优于抗生素[11-14],抑制非致病菌BF形成可能是鼻渊舒口服液治疗CRS的作用机制之一。本文通过探讨鼻渊舒口服液对成渝地区CRS患者鼻腔表葡菌BF相关通路luxS/AI-2的影响,探讨鼻渊舒口服液治疗CRS的作用机制。
材料与方法
1 材料
1.1病例收集及菌株采集
2015年10月~2016年8月成都中医药大学附属医院及重庆永川区中医院耳鼻咽喉科门诊符合慢性鼻-鼻窦炎诊断标准(2012,昆明)和鼻渊胆腑郁热证(2012,《中医耳鼻咽喉科学》)诊断标准,具体纳入标准如下:①符合西医慢性鼻-鼻窦炎及中医鼻渊胆腑郁热证的诊断标准;②性别不限,年龄在18~60岁之间;③无需手术且未行鼻部手术治疗者;两周内未曾采用同类药物治疗,未使用鼻喷雾剂及鼻腔洗剂;④无其他慢性疾病病史,如糖尿病、高血压、心脏病、肝病等;⑤知情同意,自愿受试。予以鼻渊舒口服液每天3次,每次10ml治疗2周。在治疗前后,取受试者鼻道窦口复合体处分泌物,鉴定优势菌种后分离保种。对照组:源自招募的正常人,无鼻塞、流脓涕、头昏痛症状,经检查无异常方纳入。
对照表皮葡萄球菌标准菌株:ATCC1228。
1.2材料
胰蛋白胨大豆肉汤培养基(TSB):青岛高科园海博生物技术有限公司。哈氏弧菌BB170 ATCC购于美国菌种公司(天津bio公司)。琼脂糖(电泳级):GENE TECH上海有限公司;批号:111760。AB培养基、还原性硫乙醇酸盐转运液、LB液等均由成都中医药大学实验中心提供。
1.3仪器和设备
引物合成及探针修饰:上海生工生物工程有限公司;Taq DNA PCR反应试剂盒:TAKARA大连宝生生物;Trizol:美国 invitrogen批号 50563209;dNTP:美国普洛麦格(Promega)公司;批号 251230;逆转录试剂盒:EU Fermentas批号:00098448;DNA分子量标准(DNA Marker:Marker I,显示条带:100、200、300、400、500、600bp,北京康为世纪公司;批号:16911K。酶标仪、恒温培养箱、超净工作台、FTC2000实时荧光定量基因扩增仪、水平电泳仪、Gel DOC 1000凝胶成像系统等由成都中医药大学实验中心提供
2 实验方法
2.1鼻腔优势菌群鉴定
成都中医药大学附属医院检验科,通过微生物形态学鉴定及全自动鉴定系统方法完成优势菌种鉴定及分离保种。
2.2BF阳性率测定
将保种细菌接种于TSB培养液中增菌,浓度调至达0.5麦氏单位时接种于96孔平板中37℃恒温培养箱中培养24h,PBS冲洗3次,加入甲醇固定,加入结晶紫染色冲洗多余染料并烘干,加入冰乙酸溶解后于酶标仪590nm波长处测定其数值。
2.3生物膜信号AI-2活性检测
哈氏弧菌BB170作为指示剂检测。具体如下:根据Bassl经典法以及文献[15-18]稍作修改。分别接种各样本单一菌落到 TSB,37℃培养,取 1hr,2hr,3hr,4hr,5hr,6hr,8hr,16hr,20hr,22hr,24hr 样本菌液测量OD值,绘制表葡菌生长曲线;同时取相同时点上述菌液1.5ml制作无细胞上清液,-70℃冻存备用。接种BB170单菌落至AB培养液中,30℃振摇24h后,并1:5000稀释作报告菌株。在96孔板上加入报告菌种及样本体积溶液;每个样本每个时间点作3个附孔,取平均值进行统计。使用全波长酶标仪测其发光值,TSB培养基作为空白对照、AB培养基作为背景发光值;检测菌株种间生物信号AI-2活性,以诱导发光倍数表示,计算方法:(标本样品诱导发光值读数-空白对照读数)/背景发光值读数。
2.4luxS基因转录水平测定
NCBI中查询表葡菌目的基因的序列,设计引物及探针序列。引物序列(5'-3'):F:AGACCATACTAAG GTTGTTG,R:GTTCCTTATTGGGCTGTTTG。探针序列 probe sequence:CTTCCATAGTCCCGGCTAGAC。提取总RNA,反转录成cDNA,扩增;在FTC2000型荧光定量PCR仪将反应体系放入,样本系统荧光发光强度进行实时(real-time)检测。45循环的扩增反应结束后,采集到每一循环反应时各反应管的荧光强度增长指数(DRn),分析绘制扩增动力学曲线。根据动力学曲线确定每个样品管中荧光强度增加到某一特定阈值(threshold)时的扩增循环数(Ct值),以2-△△Ct来显示luxS基因的相对表达量。
结果
1 鼻腔优势菌种分布
通过微生物形态学鉴定及全自动鉴定系统,对照组中约60%为表葡菌。鼻渊舒口服液治疗前两个地区CRS患者中约61.1%为表葡菌;治疗后约63.8%为表葡菌(具体细菌分布见表1、图1)。
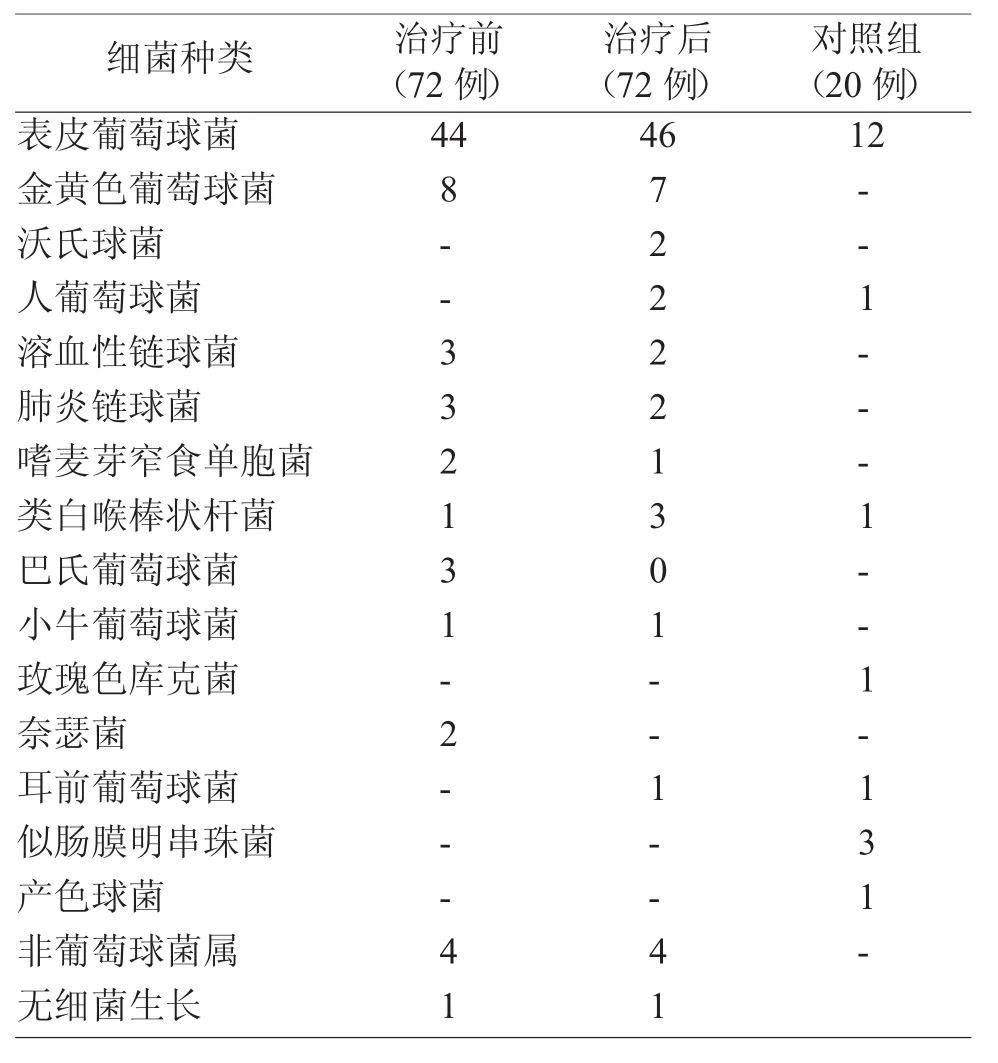
表1 鼻腔优势菌种分布
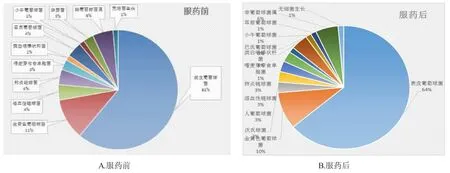
图1 鼻腔优势菌种分布
2 表葡菌BF阳性率检测结果
选取鼻腔优势菌种为表葡菌者进行BF培养。治疗前鼻腔优势表葡菌BF阳性率为73.6%,治疗后鼻腔优势表葡菌BF阳性率降低为33%。正常人中鼻腔优势表葡菌BF阳性率10%。
3 表葡菌BF信号AI-2的生长曲线及活性变化
本实验发现,CRS患者鼻腔表葡菌BF阳性样本中,AI-2的活性变化有两种情况:一是表现出相应的AI-2生长曲线和活性变化趋势,即BF+伴AI-2+,这与既往报道一致,说明AI-2活性与表葡菌生长曲线有关;部分样本却表现出AI-2检测与对照组无差异,即BF+,AI-2-的情况发生。具体如下:
3.1BF+,AI-2+菌株CRS患者治疗前后AI-2生长曲线和活性变化
成都地区CRS患者鼻腔表葡菌BF+样本中,约33%可诱导BB170发光与对照组有差异。永川地区约25%表葡菌BF+菌株可诱导BB170发光与对照组有差异。其余BF+样本无法诱导BB170生物发光,见图2。
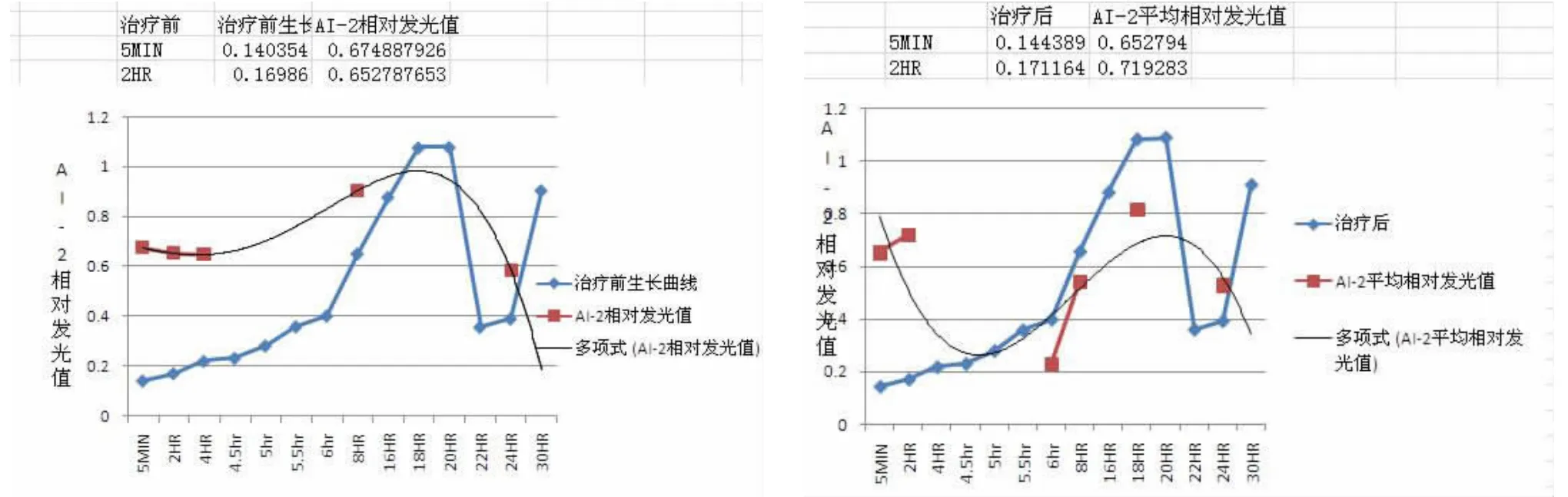
图2 BF+,AI-2+菌株治疗前、后AI-2信号发光趋势与细菌生长曲线
3.2BF+,AI-2-菌株CRS患者治疗前后AI-2生长曲线和活性变化
在进行实验中发现成渝两地BF+样本还有与对照相比无意义的变化趋势的生物膜信号AI-2,即BF+,AI-2-情况。如图 3。
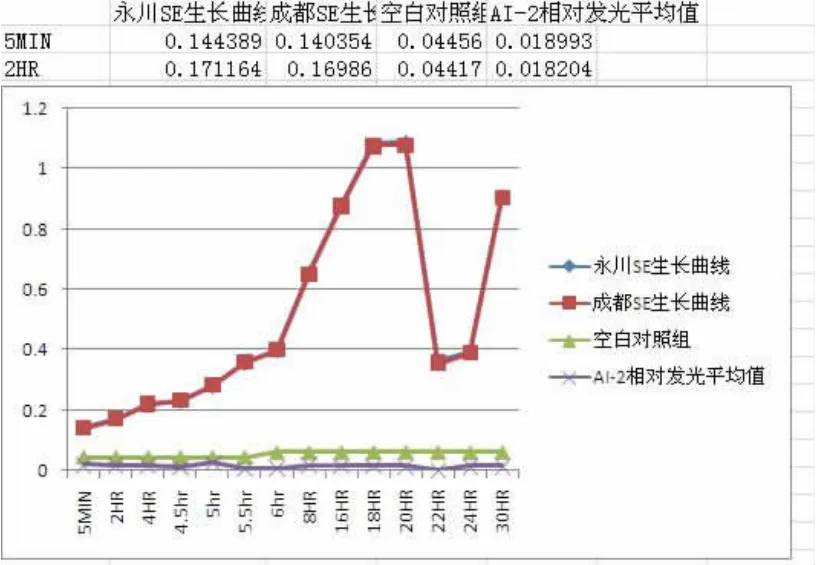
图3 BF+,AI-2-菌株治疗前后AI-2相对发光趋势与细菌生长曲线图
3.3BF-,AI-2-菌株治疗前后AI-2生长曲线和活性变化
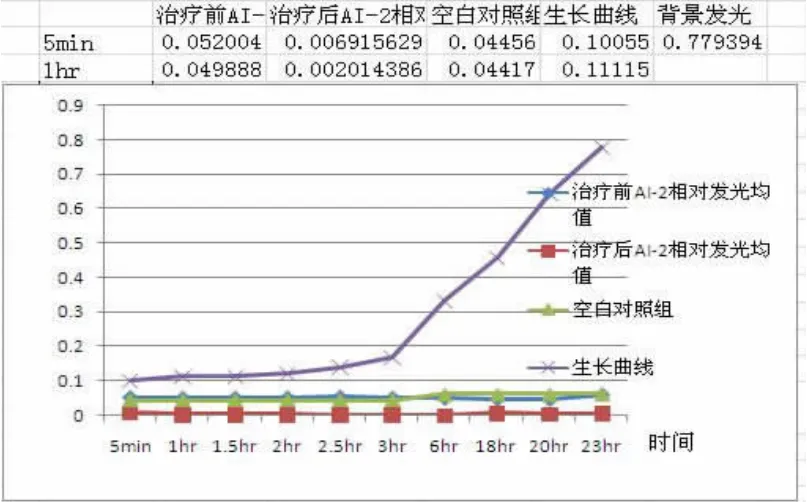
图4 BF-菌株治疗前后AI-2相对发光趋势与细菌生长曲线示意图
治疗前两地所有临床分离优势菌为表葡菌但BF-样本,AI-2活性低下,不具备调节BF能力。
AI-2在细菌对数生长早期及中晚期升高均未超过0.8,无调节细菌形成生物膜作用,AI-2变化趋势与细菌生长曲线无直接相关性,见图4。
4 鼻渊舒口服液治疗前后表葡菌luxS基因表达变化
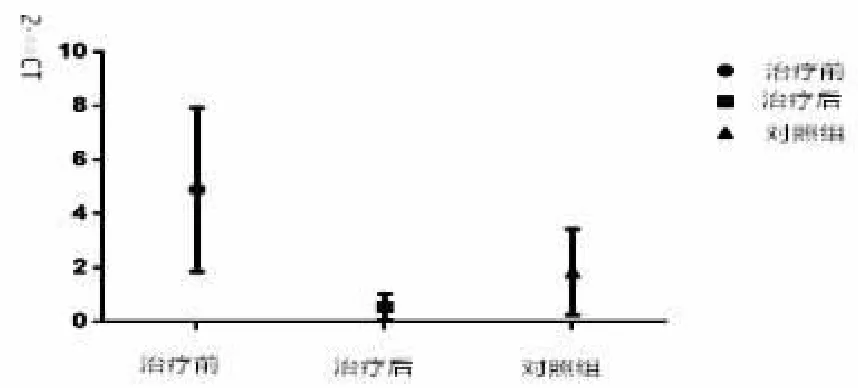
图5 治疗前后luxS基因表达量变化
选择AI-2活性变化趋势明显的28份标本送检,所有送检样本中均检出了表葡菌中有luxS表达;治疗前高于正常对照组(P<0.05),治疗后luxS表达下降,与治疗前相比(P<0.05);治疗后与正常对照组差异无统计学意义(P>0.05),见图5。
5 表葡菌AI-2发光值与luxS基因表达相关性分析
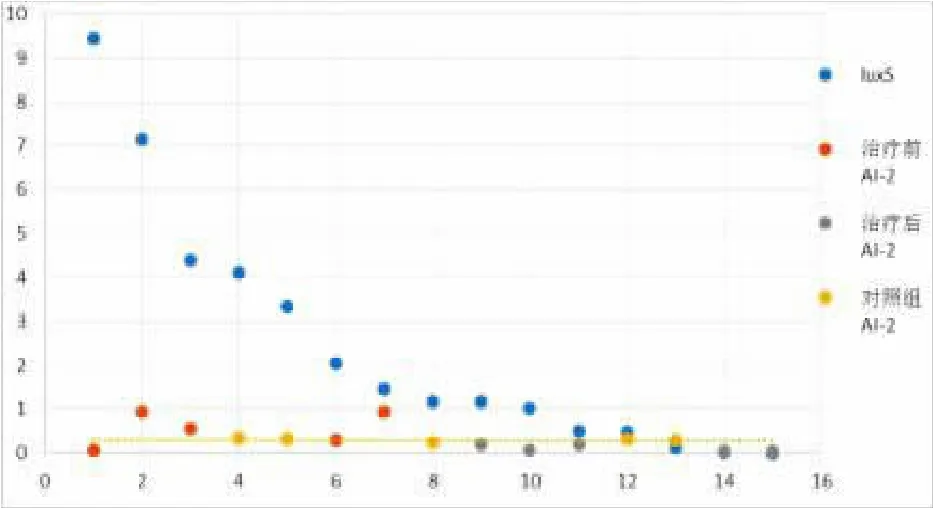
图6 以luxS测值为参照,对比治疗前后以及对照组AI-2
以2-△△CT计算后将luxS的结果从高至低排列,纵坐标1为比较坐标。高于1表示正调控,低于1表示负调控。比照luxS将相应样本的AI-2进行排列,并对luxS和AI-2的测值结果进行相关性分析,以对照组的结果(均值=0.31)作为参照,治疗前高于对照组均值,治疗后几乎均低于对照组均值。治疗后相对于治疗前AI-2有降低的趋势,与luxS降低的趋势一致,两者成正相关的关系,见图6。
讨论
本研究发现正常人及CRS患者鼻腔优势菌种均为表葡菌。表葡菌是鼻腔主要条件致病菌,其生物行为学改变对CRS发生最具意义的表现即BF形成[19-21]。本研究证实鼻渊舒口服液可拮抗鼻腔优势表葡菌BF生成,降低BF种间信号AI-2活性。治疗前后表葡菌生长曲线变化说明鼻渊舒口服液并未明显改变细菌生长速率及形态,但改变了细菌生物学行为,同时证明自诱导物AI-2仅与细菌生长浓度相关。进一步说明表葡菌BF产生与细菌浓度相关,与细菌量无直接关系。治疗前后表葡菌生长曲线及AI-2活性变化发现:BF+,AI-2+菌株,在细菌对数生长早中期,细菌生长速率高,易产生细菌交流信息,AI-2浓度随细菌浓度升高达峰值,使用鼻渊舒口服液治疗后可以有效降低BF+,AI-2+峰值及维持时间,说明鼻渊舒口服液可以阻碍细菌间信息交流,改变细菌生物学行为。故本实验结果说明细菌对数生长期是细菌发生生物变化最大时期,细菌活跃度越高则细菌间信息交流性越大,与其他研究结果一致[22]。
同时我们亦发现少数BF+,AI-2-菌株存在,说明形成BF的形成可能存在其他调控通路。我们推测AI-2信号是促进BF形成的条件之一,但不是全部条件,CRS表葡菌BF的形成应该是多通路共同调节。本研究也证实无论何种通路形成BF,鼻渊舒口服液均可有效拮抗。
luxS编码产物luxS是合成AI-2的标志性酶[23],研究显示AI-2在BF形成调控中起重要作用[24-26]。本实验提示服药前后luxS基因表达高峰时间与AI-2峰值间有着约2小时的时间差,但16小时后发光量皆已稳定,AI-2浓度又可以直接调节luxS表达[20],因此本研究依据AI-2结果参考观察时间窗。本研究治疗后表葡菌luxS基因表达下调,与现有文献报道不符,推测原因可能是本次研究采用治疗前后临床分离株,与文献中采用体外培养观察标准菌株有所不同;也可能是因为BF的调控基因有很多并且相互之间呈复杂的网状关系,在luxS基因调控途径以外仍有其他调节通路,本研究发现鼻渊舒口服液能够有效低BF形成率,因此其治疗机制可能是抑制luxS的同时也抑制其他BF形成的正调控基因表达以实现对BF形成率的下调。
