水溶性丙烯酰胺共聚物的缓蚀性能
2019-01-02,,,,
,, ,,
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,化学与化工学院,青岛 266100;2.海军装备技术研究所,北京 102442)
碳钢在酸洗、清洁、除垢等过程中都会遭受酸溶液的腐蚀。缓蚀剂的加入可以有效减缓腐蚀介质对金属材料腐蚀,是一种经济高效的防腐蚀方法[1-5]。含有氮、氧、硫、杂环或不饱和键的有机类缓蚀剂由于性能优异而被广泛使用[6-7]。随着环保要求的不断提高,有机缓蚀剂的毒性大大限制了其使用。聚合物类缓蚀剂近些年逐渐走进研究学者的视野,相对于低分子缓蚀剂,该类缓蚀剂具有缓蚀效率高、持久性好,绿色环保等优点[5,8-10],因此开发新的聚合物缓蚀剂具有重大意义。本工作将水溶性良好的丙烯酰胺(AM)和2-丙烯酰胺-2-甲基丙磺酸(AMPS)的共聚物(PAA)用作缓蚀剂,其分子结构如图1,利用失重法,极化曲线,电化学阻抗法以及接触角测试等方法对缓蚀剂PAA进行了缓蚀性能评价和缓蚀机理的初步探讨。
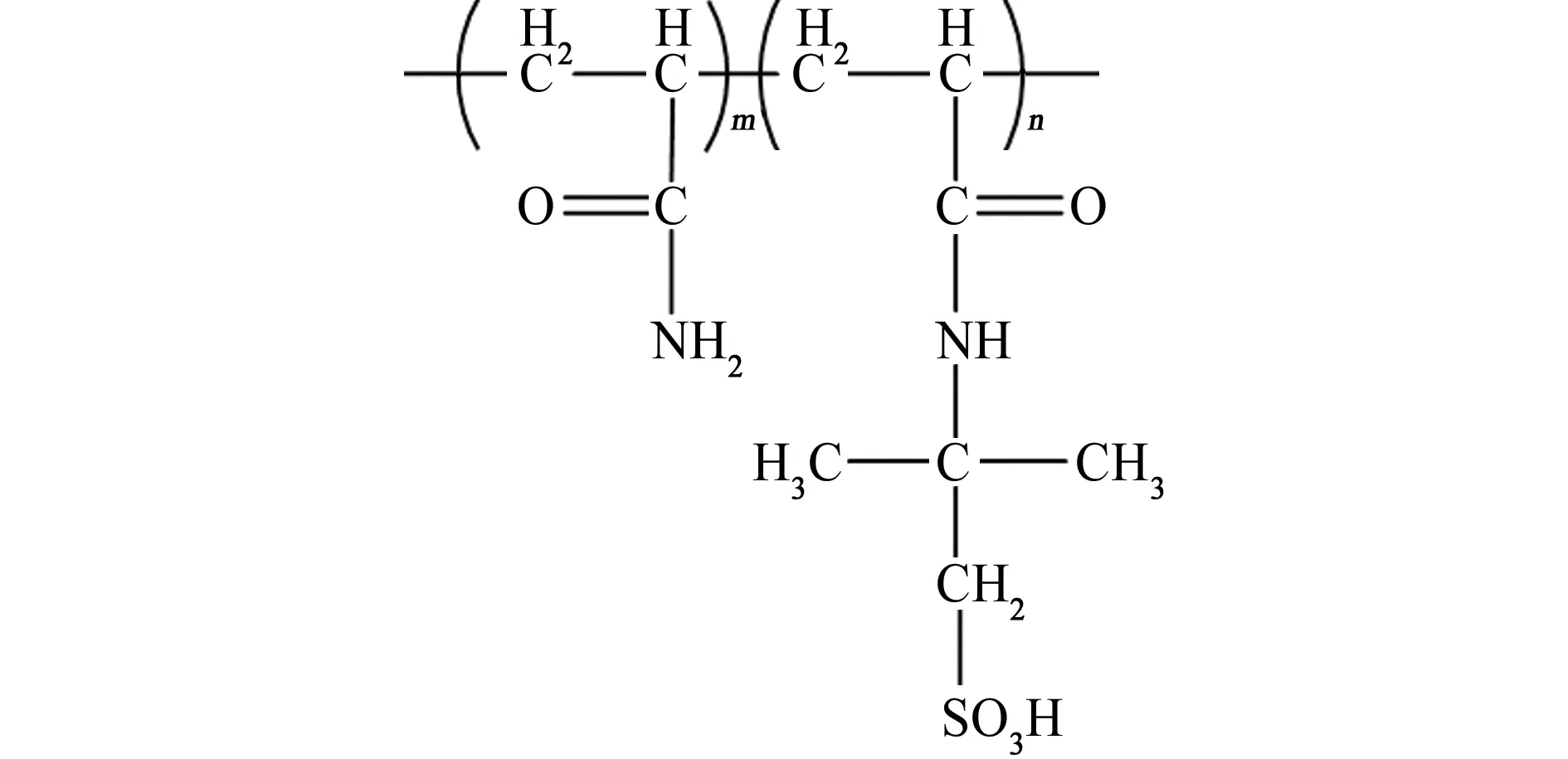
图1 缓蚀剂PAA的结构Fig.1 The structure of inhibitor PAA
1 试验
1.1 共聚物缓蚀剂的合成
试验所用共聚物PAA采用自由基胶束聚合法合成,将一定量的AM、AMPS各自溶解在适量蒸馏水中,混合均匀后滴加1 mol/L NaOH调控pH至7~9。加入一定量的十二烷基硫酸钠,然后将混合液倒入装有搅拌装置的三口瓶中并置于恒温油浴中反应,整个反应过程在N2氛围中进行。用漏斗逐滴加入引发剂偶氮二异丁基盐酸盐AIBA,恒温反应5 h,得到透明的胶状聚合物,向反应得到的聚合物中加入乙醇,加入量为混合液体积的2~3倍,析出沉淀,用乙醇反复浸泡洗涤纯化,在40 ℃下真空干燥24 h即可得到PAA,取出保存备用。合成的共聚物溶解度在室温环境中可达到5.03 g,具有较好的水溶性。
由于此方法只合成了一种相对分子质量的聚合物,无法预测分子量及共聚单元对缓蚀性能的影响,后续我们将继续进行不同分子量和不同共聚单元聚合度的聚合物的合成,以便进一步研究。
1.2 共聚物缓蚀剂的缓蚀性能测定
1.2.1 静态失重法
试验材料为Q235钢,主要成分(质量分数)为:C 0.18%,Si 0.02%,Mn 0.45%,S 0.02%,P 0.01%,Fe 99.32%。失重试验用试样的尺寸为50 mm×10 mm×3 mm,试验前将试样用金相砂纸(100~2 000号)逐级打磨,然后用无水乙醇清洗,干燥,称量。用游标卡尺测量各边长度。试样在室温下浸入空白和含不同量缓蚀剂(缓蚀剂加入量为100,200,300,400,500 mg/L)的1 mol/L盐酸溶液中8 h,试样取出后在除锈液中除锈5 min,然后依次用蒸馏水、无水乙醇清洗,干燥至恒重,称量。采用三个平行样取平均值以减小误差。
腐蚀速率的计算公式如下:
(1)
式中:v为腐蚀速率,w0和w分别为失重试验前后试样的质量,A为试样的总面积,t为腐蚀时间。
缓蚀率的计算公式如下:
(2)
式中:v0和v分别为试样在未添加和添加缓蚀剂PAA的1 mol/L盐酸溶液中的腐蚀速率。
1.2.2 电化学方法
电化学测试在P4000电化学工作站上完成,采用三电极体系,其中Q235钢为工作电极(工作面积为10 mm×10 mm,其余部分用环氧树脂密封),铂片为辅助电极,饱和甘汞电极为参比电极。工作电极的工作面用砂纸逐级打磨后依次用水和无水乙醇清洗、干燥。试验温度为25 ℃,试验溶液为1 mol/L盐酸溶液。测试前将工作电极置于试验溶液中45 min至电位稳定。
极化曲线法的扫描范围为±250 mV(相对于开路电位),扫描速率为1 mV/s,试验数据采用origin软件分析作图。阴极塔菲尔斜率(bc)、阳极塔菲尔斜率(ba)等电化学参数由Tafel外推法获得,缓蚀率由公式(3)计算可得:
(3)
式中:Jcorr,0和Jcorr分别为试样在未添加和添加缓蚀剂PAA试验溶液中的腐蚀电流密度。
电化学阻抗谱的激励信号幅值为10 mV,测试频率范围为10 mHz~100 kHz,数据采用Zview软件拟合。缓蚀率由公式(4)计算可得:
(4)
式中:Rct,0和Rct分别为试样在未添加和添加缓蚀剂PAA试验溶液中的电荷转移电阻。
1.2.3 形貌表征
将试样置于不含和含500 mg/L PAA的1 mol/L盐酸溶液中24 h后取出,依次用水和无水乙醇清洗,干燥备用。表面形貌观察采用OLS4000激光共聚焦显微镜;紫外可见光谱仪采用Hitachi UV310;接触角测试采用仪器DSA 100。
2 结果与讨论
2.1 静态失重试验结果
由图2和表1可见:在常温(25 ℃)环境中,随着缓蚀剂量的增加,缓蚀率变化不大,这是由于缓蚀剂分子在金属表面的吸附达到饱和状态,缓蚀剂含量对其影响不大;当温度升至60 ℃时,缓蚀效果明显降低,说明温度对缓蚀剂的影响较大,温度越高,缓蚀效果越差。这是因为温度升高,缓蚀剂的吸附作用降低,金属腐蚀加快。
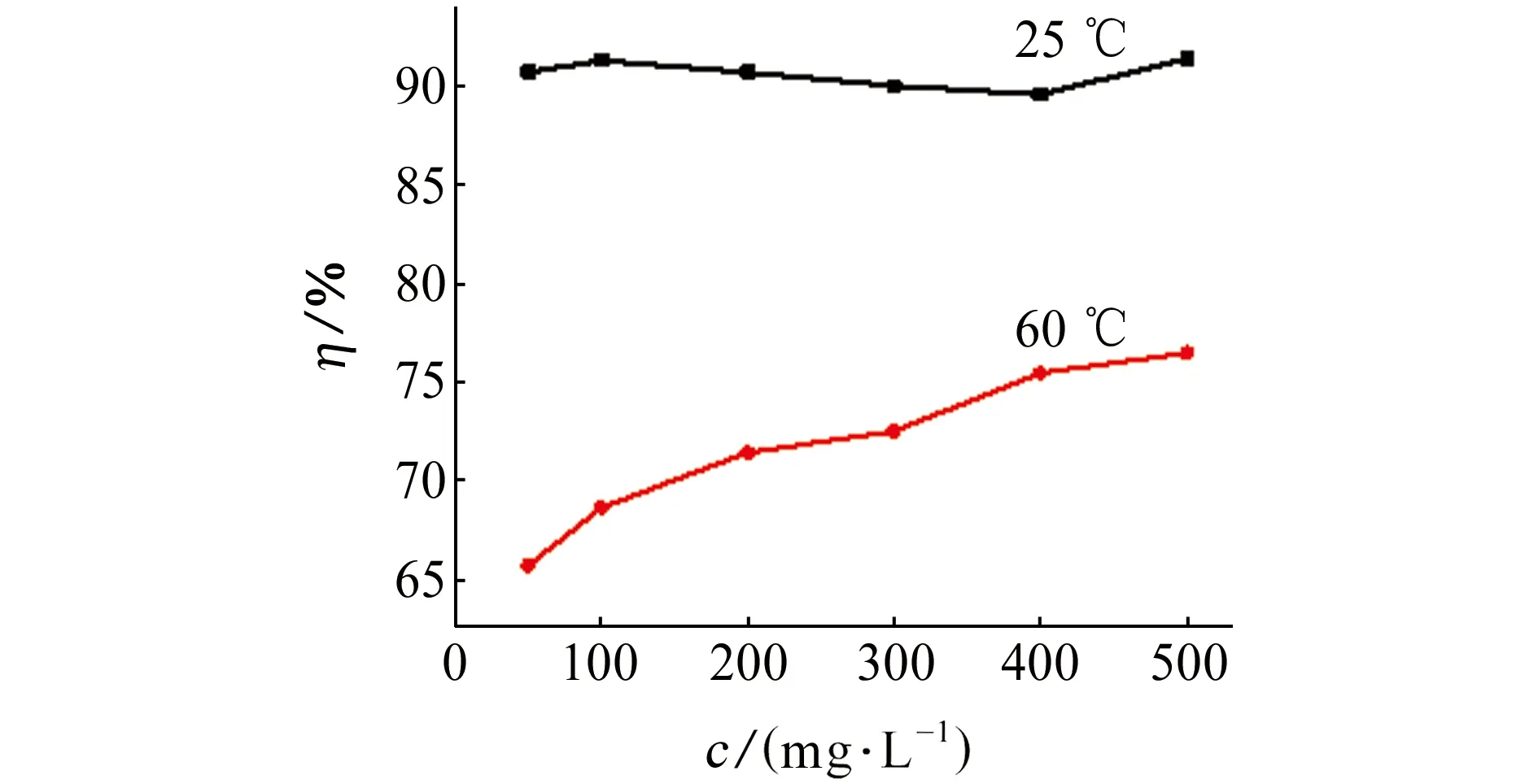
图2 不同温度下PAA含量对缓蚀率的影响Fig.2 Effect of PAA content on corrosion inhibition rates at different temperatures
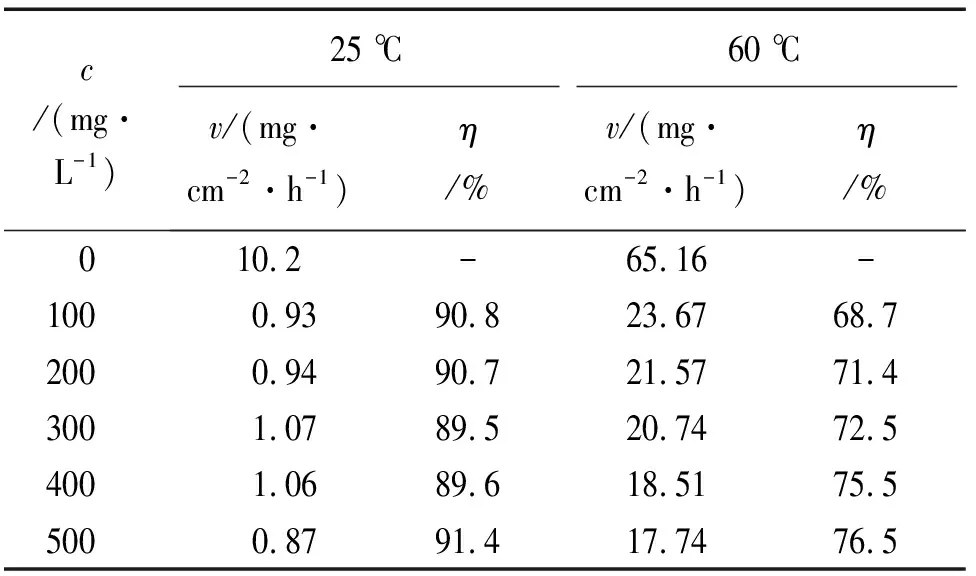
表1 不同温度下PAA含量对试样在1 mol/L盐酸溶液中腐蚀速率的影响极其缓蚀率Tab.1 Effect of PAA content on the corrosion efficiency of samples in 1 mol/L HCl solution and it′s inhibition rates at different temperatures
2.2 动电位极化曲线结果
由图3和表2可见:加入缓蚀剂后,阴阳极反应均受到了一定程度的抑制,但自腐蚀电位偏移不明显(<85 mV),这表明PAA是一种混合抑制型的缓蚀剂[11]。随着缓蚀剂量的增加,缓蚀率略有增加,当缓蚀剂质量浓度达到500mg/L时,缓蚀率可以达到98.4%。且阳极极化曲线的形状发生了改变,这可能是由于电位较高时,阳极极化程度较大,金属离子在溶液中的扩散增强,使缓蚀剂分子的吸脱附平衡遭到破坏,吸附速率小于脱附速率,保护膜遭到破坏[12]。
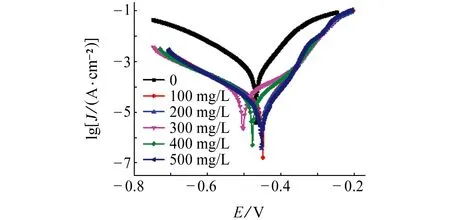
图3 25 ℃时试样在含不同量PAA的1 mol/L盐酸溶液中的极化曲线Fig.3 Polarization curves of samples in 1 mol/L HCl solution containing different content of PAA at 25 ℃
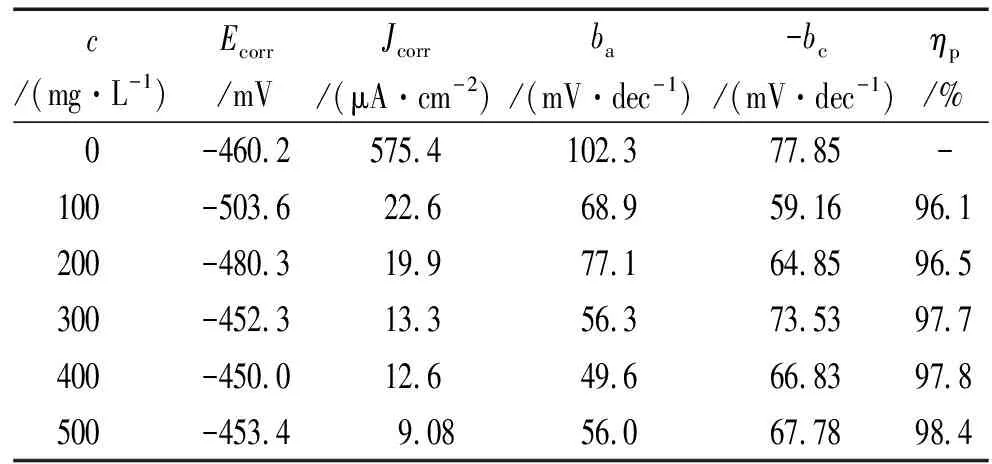
表2 极化曲线相关电化学参数拟合结果及缓蚀率Tab.2 Fitting results of electrochemical parameters related to polarization curves and corrosion inhibition efficiency
2.3 电化学阻抗谱结果
由图4可见:Nyquist图只有一个高频容抗弧,说明电极表面的反应是由电荷传递过程控制的,容抗弧的半径越大,电阻值越大,腐蚀越困难,保护效果越好[13]。采用图5所示等效电路进行拟合,其中Rs为溶液电阻,Rct为电荷转移电阻,CPE为常相位角元件,拟合数据见表3。由表3可见:加入缓蚀剂后,Rct值较在空白溶液中的明显增大,说明缓蚀剂分子能够在金属表面形成一层保护膜,减缓腐蚀[14]。随着缓蚀剂量的增加,容抗弧的半径增大,Rct增大,说明保护膜的致密性增强,对金属基体的保护效果增强。当缓蚀剂的质量浓度为500 mg/L时,缓蚀率可以达到95.8%。电化学测试结果与失重试验结果一致。

图4 25 ℃时试样在含不同量PAA的1 mol/L 盐酸溶液中的Nyquist图Fig.4 Nyquist plots of samples in 1 mol/L HCl solution containing different content of PAA at 25 ℃
2.4 缓蚀剂的后效性
由图6和表4可见:随着浸泡时间的延长,电容弧直径增大,浸泡时间为96 h时达到最大值,继续延长浸泡时间,容抗弧半径减小。PAA的缓蚀率也随浸泡时间的延长先增大,在96 h时缓蚀率最高,之后缓蚀率降低,但均能达到97%以上。这表明PAA的缓蚀性能优异。另外缓蚀剂形成的保护膜具有非常好的稳定性,浸泡时间长达一个月,缓蚀率依然维持较高水平,说明PAA具有良好的后效性。
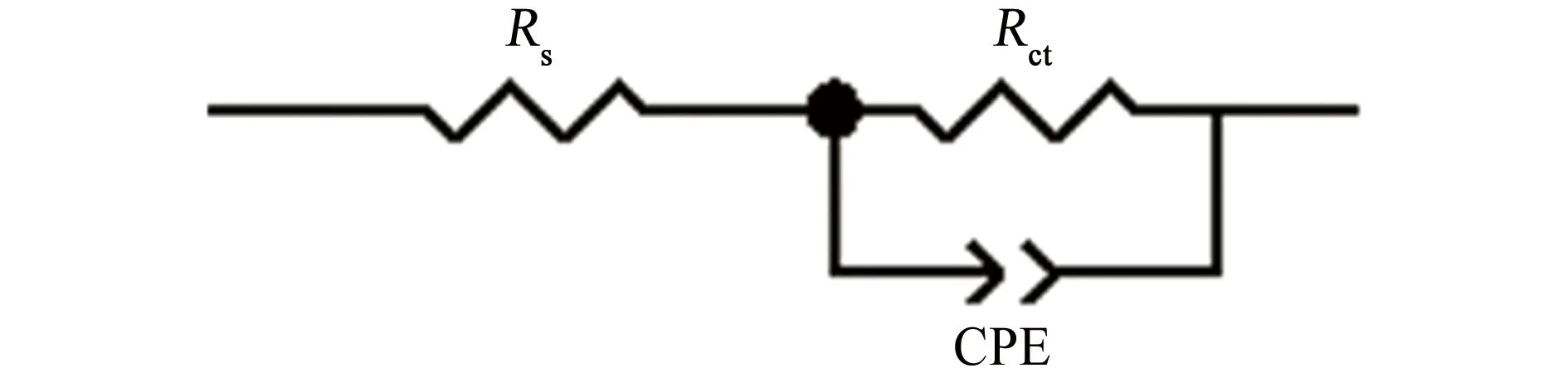
图5 电化学阻抗谱的等效电路Fig.5 Equivalent circuit of EIS

表3 图4的拟合结果Tab.3 Fitting results for Fig.4
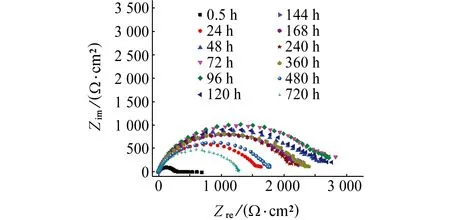
图6 试样在含500 mg/L PAA的1.0 mol/L HCl溶液中浸泡不同时间后的Nyquist图Fig.6 Nyquist plots of sampls after immersion in 1.0 mol/L HCl solution containing 500 mg/L PAA for different times
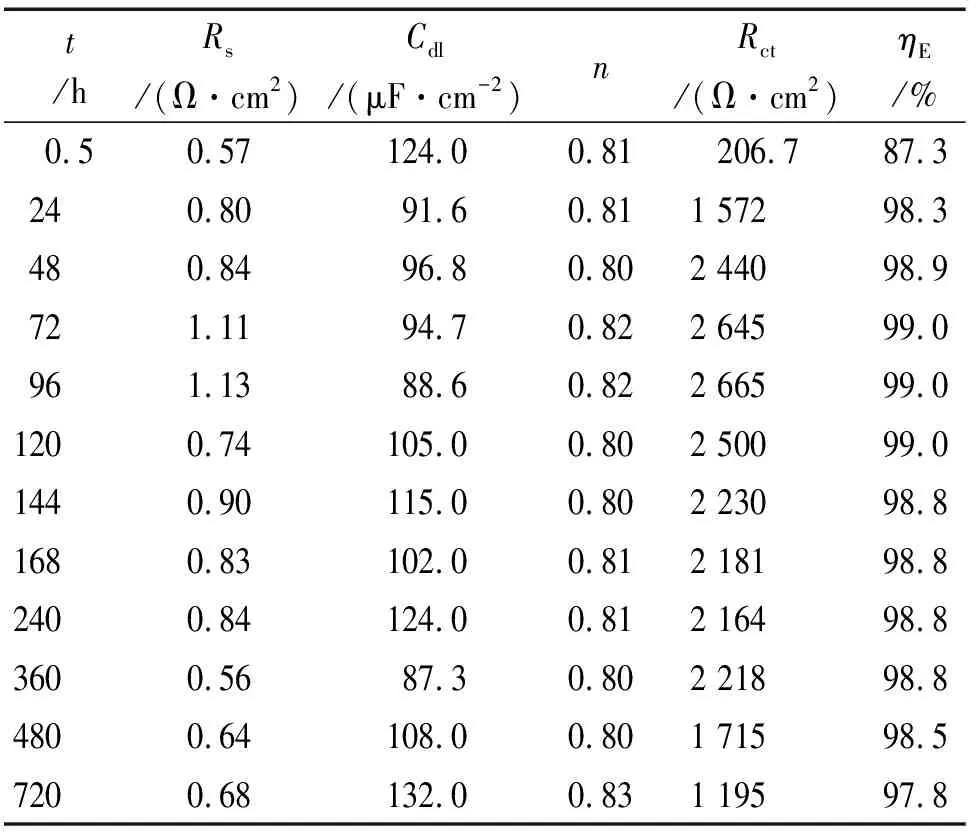
表4 图6的拟合结果Tab.4 Fitting results for Fig.6
2.5 吸附机理研究
当缓蚀剂作用为几何覆盖作用时,可以将缓蚀率近似当做表面覆盖度[15-17]。以c/θ对c作图得图7,两者呈直线关系,回归系数R2为0.999 8,表明缓蚀剂分子在碳钢表面的吸附遵循Langmuir吸附等温式[18]。Langmuir吸附等温式如下:
(5)
式中:Kads为吸附平衡常数,c为缓蚀剂质量浓度,θ为表面覆盖度。
根据直线的截距可以求出吸附平衡常数,再由式(6)可以求出吉布斯自由能[19]:
(6)
式中:Csolvant为55.5,R为理想气体常数,T为热力学温度。
根据拟合曲线可以计算出Kads(86 580.1),进而得到标准吉布斯自由能ΔGads为-38.12 kJ·mol-1。吉布斯自由能为负值,说明吸附过程是一个自发过程,而且ΔGads介于-20~-40 kJ·mol-1,说明缓蚀剂分子在碳钢表面的吸附是物理吸附与化学吸附综合作用,其中化学吸附的作用稍强[3,19]。
2.6 形貌观察
由图8可见:在未添加缓蚀剂的1 mol/L 盐酸溶液中浸泡24h后,试样腐蚀严重,表面有较深的腐蚀坑;而添加500 mg/L PAA后,试样表面较平整,没有出现较深的腐蚀坑,腐蚀程度明显降低。这说明缓蚀剂PAA能够有效抑制碳钢在500 mg/L盐酸溶液中的腐蚀。

(a) 无PAA (b) 含500 mg/L PAA图8 试样在不含和含500 mg/L PAA的1 mol/L盐酸溶液中浸泡24 h后的表面形貌Fig.8 Surface morphology of samples after immersion in 1 mol/L HCl solution for 24 h without (a) and with (b) 500 mg/L PAA
2.7 接触角测试结果
由图9可见:在1 mol/L盐酸溶液中添加PAA后,试样表面表现出良好的疏水性能。这是由于聚合物分子中的N、 O、 S原子的孤对电子与铁原子成键,而甲基则起到疏水作用,阻碍腐蚀介质到底金属表面,从而起到缓蚀作用[20]。
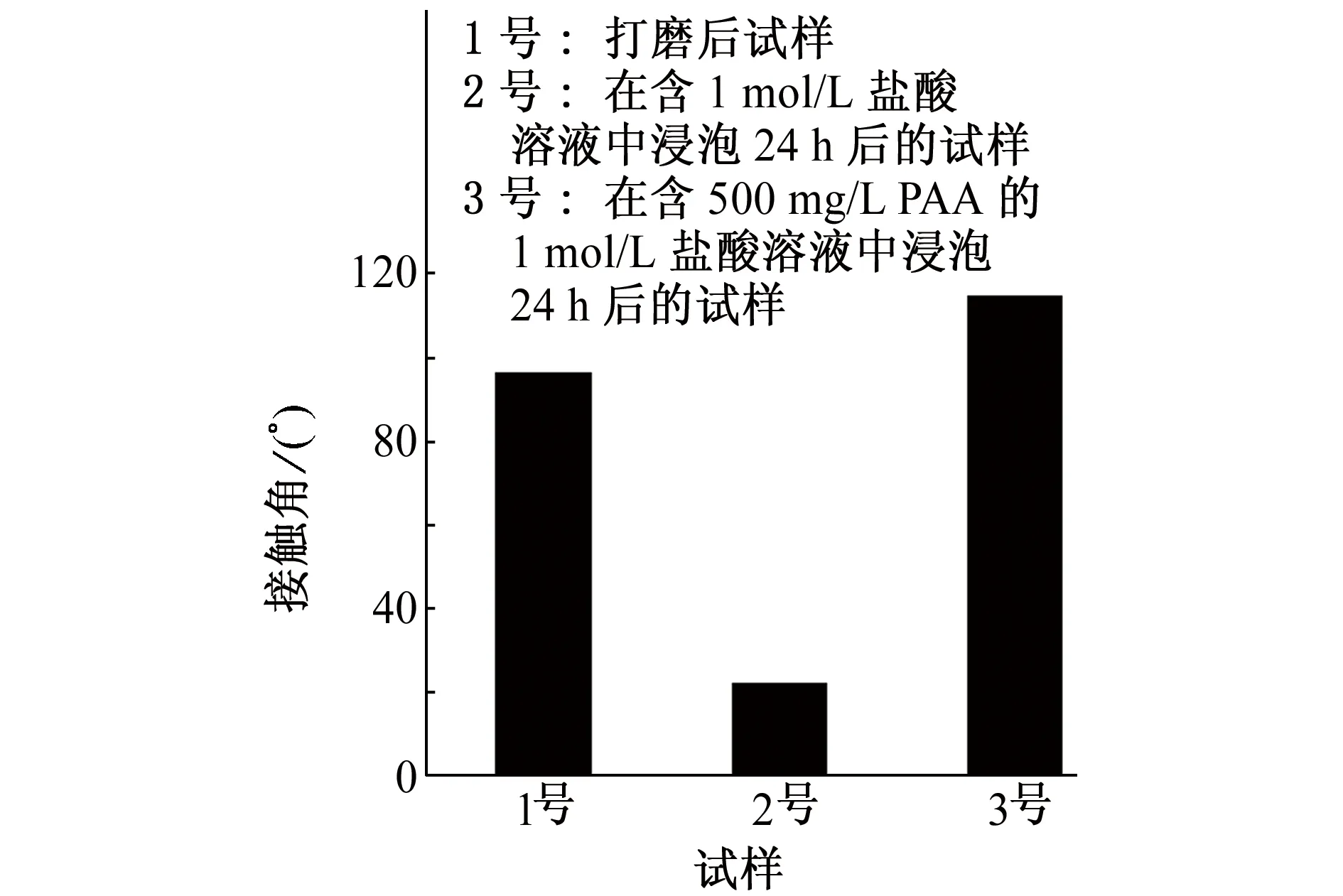
图9 试样的接触角Fig.9 Contact angles of the samples
2.8 紫外可见光谱分析
由图10可见:345 nm左右出现较强的吸收峰,此峰为腐蚀产物金属阳离子的吸收峰。2号溶液中的此吸收峰要比3号溶液中的强,即盐酸溶液中加入缓蚀剂后,腐蚀产物浓度较小,即试样的腐蚀减弱。缓蚀剂可以与金属阳离子形成配合物,在金属表面形成一层保护膜,从而减缓金属的腐蚀[21]。
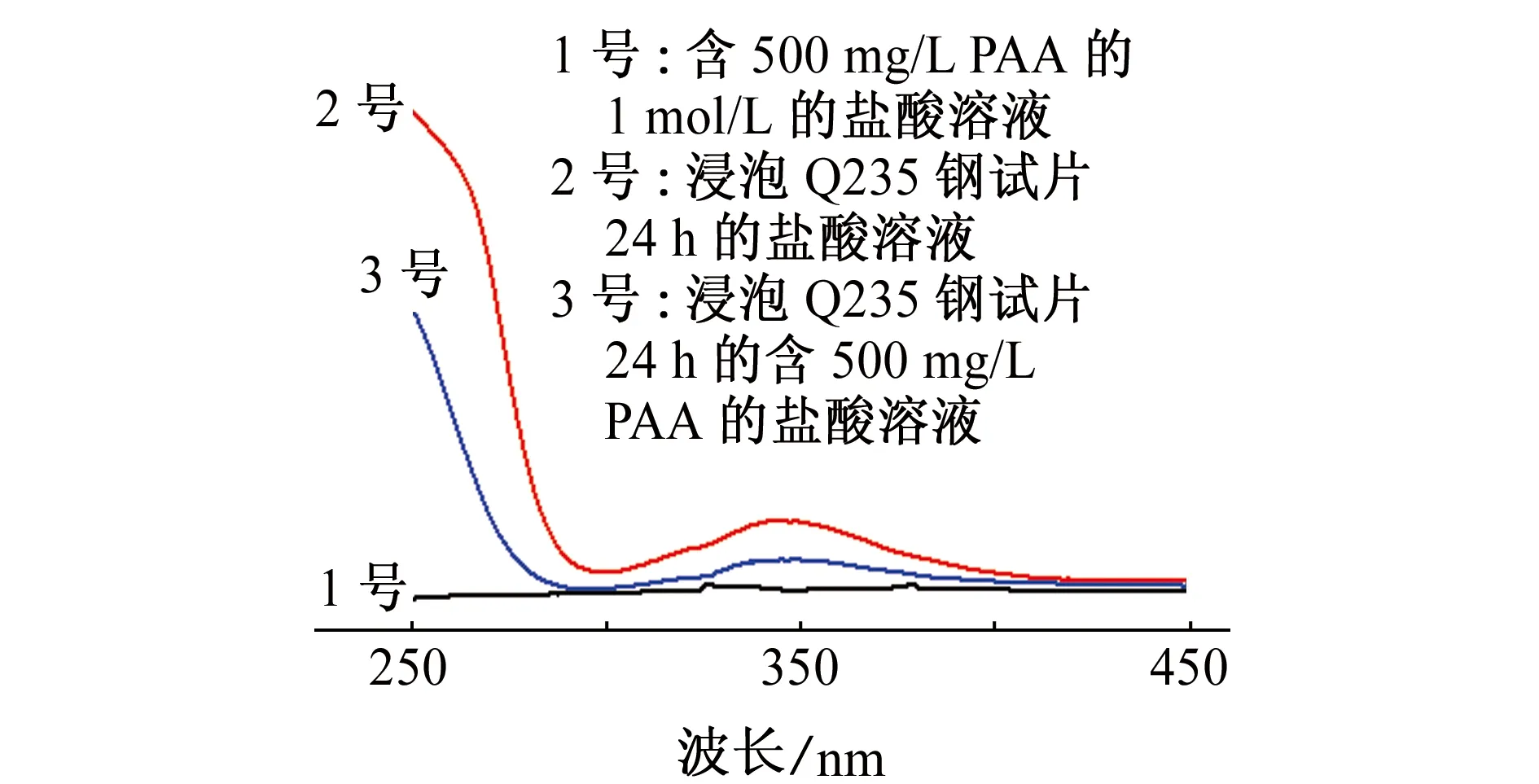
图10 不同溶液的紫外可见光谱Fig.10 UV-visible spectra of different solutions
3 结论
(1) 共聚物PAA对碳钢在1 mol/L盐酸溶液中具有良好的缓蚀作用,缓蚀剂添加量较小时就有较高的缓蚀率,但随着缓蚀剂量的增加,缓蚀率增加不显著,说明添加较少量的缓蚀剂PAA就能起到很好的缓蚀效果,有利于节约成本。
(2) PAA在金属表面的吸附符合Langmuir吸附等温式,缓蚀剂分子能够自发地吸附在金属表面,形成一层疏水性良好的保护膜,吸附作用是物理吸附与化学吸附的综合作用。
(3) PAA是一种混合抑制型缓蚀剂,缓蚀剂分子可以在金属表面形成一层保护膜,使电极表面的阻抗增大,减缓腐蚀。
