B细胞非霍奇金淋巴瘤组织中YAP1和P53的表达及意义
2018-12-28何新明林喜娜陈贵东古婉仪
沈 艳,何新明,林喜娜,杨 通,陈贵东,古婉仪,顾 霞
1广州医科大学附属第二医院 病理科, 广东广州 511447;2广州医科大学附属第一医院 病理科,广东广州510120
非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)是一组来源于淋巴结或结外淋巴组织的恶性肿瘤,其发病率和病死率较高。NHL种类繁多,包括B细胞和T/NK细胞淋巴瘤两大类、数十种类型,在临床表现、形态学、免疫表型和遗传学等方面具有高度异质性,目前其治疗方法主要是化疗,但部分患者疗效不佳或不持久。近年来淋巴瘤治疗的研究热点集中在通过分子靶向来干扰关键信号转导途径,从而抑制肿瘤细胞的存活和增殖,以提高疗效。Hippo通路是近年来发现的一条在生物进化上高度保守的细胞信号转导通路,具有维持细胞增殖和凋亡平衡、调控器官体积等功能[1-4]。YAP1蛋白 (Yes-associated protein 1)是Hippo信号通路的核心效应因子,具有转录共激活因子活性[2]。研究发现Hippo-YAP1通路与P53蛋白存在交互作用[3],该通路异常可导致人体多种疾病包括肿瘤的发生。目前,以Hippo-YAP1通路为靶点的治疗策略为肿瘤治疗提供了新思路[5-6]。虽然Hippo-YAP1通路在肿瘤中的研究已成为热点,但迄今其在淋巴瘤方面的研究报道十分少见。本研究检测了YAP1蛋白在B细胞非霍奇金淋巴瘤(B cell non-Hodgkin's lymphoma,B-NHL)中的表达,并分析其与p53蛋白表达的相关性,旨在进一步探讨B-NHL发生的分子机制,为临床诊断和治疗提供新思路。
材料和方法
1 标本来源 收集广州医科大学附属第一医院病理科2012 - 2017年经病理检查确诊为的B-NHL的存档标本60例,入选标本由两名资深病理专家复读切片,对其组织学类型进行回顾性分析并确诊。诊断标准参照2016年版WHO关于淋巴组织肿瘤分类[7]。其中,男38例,女24例,年龄20 ~89岁,中位年龄63岁。另选取25例反应性增生淋巴组织(reactive hyperplasia of lymphoidtissue,RHL)标本作为对照组。
2 主要试剂 浓缩型鼠抗人单克隆抗体YAP1(克隆号:GT256)购自美国GeneTex公司,工作浓度按1∶800进行稀释。即用型P53鼠抗人单克隆抗体为Dako公司产品,免疫组化GTVisionTMⅠ/HRP试剂盒、DAB显色试剂盒购自基因科技有限公司。
3 组织芯片的制作 在石蜡包埋标本的HE切片上选择具有代表性的一个区域进行标记,用组织芯片仪在相应标本蜡块(即供体蜡块)上标记的相应部位打孔采集组织芯(直径2 mm),然后将组织芯转移至另一个空白蜡块(即受体蜡块)相应孔位上,每个组织芯之间的间距为1.5 mm,制成阵列蜡块。对阵列蜡块进行4μm厚连续切片,再将切片转移至载玻片上,即获得组织芯片。
4 YAP1、P53蛋白检测 采用免疫组织化学GTVision染色法:石蜡切片脱蜡至水,蒸馏水冲洗,PBS液浸泡5 min,加枸橼酸,微波抗原修复,中火3 min×3次;自然冷却至室温;PBS液冲洗3 min×3次;3%过氧化氢封闭内源性过氧化物酶活性孵育10 min;PBS液冲洗3 min×3次;滴加一抗,其中YAP1抗体按1∶800进行稀释,室温箱孵育60 min,PBS冲洗3 min×3次;滴二抗(GTVisionTMⅠ型聚合物),室温孵育30 min,PBS冲洗3 min×3次;DAB显色,自来水充分冲洗,苏木精复染,乙醇脱水,二甲苯透明,树胶封片。每批染色均设阳性对照和阴性对照。以已知阳性反应片做阳性对照,以PBS替代一抗做阴性对照。
5 结果判断YAP1表达 定位于细胞质和(或)细胞核,P53表达定位于细胞核,阳性细胞呈黄色或棕黄色颗粒为阳性细胞。YAP1采用半定量方法判断结果:1)按细胞染色强弱评分:0分为不着色;1分为浅黄色;2分为棕黄色;3分为棕褐色;2)记取组织芯片中200个肿瘤细胞,阳性细胞所占百分比。计数阳性染色细胞占细胞总数的百分比:0分无阳性细胞;1分阳性细胞数<10%;2分阳性细胞数10% ~ 50%;3分阳性细胞数>50%。按以上两项乘积判断结果:0为阴性,1 ~ 2为(+),3 ~ 4为(++),>4为(+++)。P53按阳性百分比分级:(-)无阳性肿瘤细胞或阳性肿瘤细胞<30%;(+)阳性肿瘤细胞≥30%。
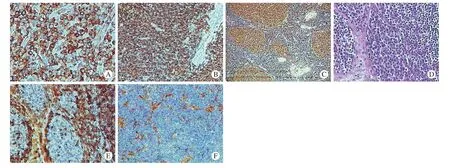
图1 YAP1蛋白在各淋巴组织中的表达 A:DLBCL中呈强阳性表达,定位于胞质(IHC×200); B:SLL中呈弥漫强阳性表达(IHC×100); C:RHL中呈强阳性表达,阳性细胞弥漫分布于滤泡区和滤泡间区,其中滤泡生发中心表达强度最高(IHC×50); D:RHL中局部(图左侧)可见成熟浆细胞富集(HE×200); E:在成熟浆细胞中呈阴性表达,其周围淋巴细胞呈阳性表达(IHC×200); F:在DLBCL间质血管内皮呈阳性表达(IHC×50)Fig. 1 YAP1 expression in different lymphoid tissues A: High expression in DLBCL, and the cellular immunolocalization was cytoplasmic,IHC×200; B: Diffused strong positive expression in SLL, IHC×100; C: High expression in RHL, and the positive cells were distributed in the follicular and interfollicular regions, and the expression intensity of follicular germinal center was the highest, IHC×50;D: Mature plasmacytes enriched locally (left part) in RHL, HE×200; E: Negative expression in mature plasma cells and positive expression in peripheral lymphocytes, HE×200; F: Positive expression in the interstitial endothelium of DLBCL, IHC×50
6 统计学处理 实验数据用SPSS17.0软件进行处理,组间率的比较采用Fisher确切概率法,一致性分析采用Kappa检验,P<0.05为差异有统计学意义。
结 果
1 B-NHL类型与分组 60例B-NHL包括弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL) 49例,小淋巴细胞淋巴瘤(small lymphotic lymphoma,SLL) 7例,套细胞淋巴瘤(mantle cell lymphoma,MCL) 4例。鉴于DLBCL生物学行为呈高侵袭性,而SLL和MCL为相对惰性,且病例数较少,为便于统计学分析,将后两者合并为惰性组B-NHL。同时,按CD10、BCL-6和MUM1的表达将DLBCL分为生发中心B细胞型(germinal center B cell-like,GCB)和非生发中心B细胞型(non-germinal center B cell-likenon-GCB)两个亚型,其中GCB型10例,non-GCB 39例。
2 YAP1在B-NHL和RHL中的表达 YAP1在B-NHL和RHL中的表达均定位于细胞质。其中在DLBCL中的表达阳性率为61.2%,在惰性组B-NHL和RHL中表达阳性率均为100%。YAP1在DLBCL表达的阳性率低于惰性组B-NHL和RHL (P<0.05)。其中YAP1在GCB型和non-GCB型DLBCL的表达阳性率分别为60%(6/10)和61.5%(24/39),两组差异无统计学意义(P>0.05)。在RHL中,YAP1在滤泡生发中心的染色强度高于滤泡套区和滤泡间区,虽然为弥漫表达模式,但在成熟浆细胞中未见表达。此外,YAP1在少数B-NHL血管内皮细胞的胞质中亦呈中-高强度阳性表达,而在RHL中血管内皮呈阴性或弱阳性表达。见表1,图1。
3 P53在B-NHL和RHL中的表达 P53在B-NHL中的总体表达阳性率为16.7%(10/60),其中在DLBCL中表达阳性率为18.4%(9/49),在惰性组B-NHL中仅1例SLL呈阳性表达,阳性率为9.1%(1/11),而在25例RHL中未见表达,阳性率为0。P53在DLBCL和惰性组B-NHL表达的阳性率高于RHL (P<0.05),但在DLBCL和惰性组B-NHL间差异无统计学意义(P>0.05)。见表1。
4 YAP1、P53表达在B-NHL中的相关性 YAP1蛋白在P53蛋白阳性组与阴性组的表达率分别为60%(6/10)和70%(35/50),两组间YAP1蛋白表达率无统计学差异(P>0.05)。在B-NHL中,YAP1蛋白表达与p53蛋白表达无显著相关性(P>0.05)。见表2。
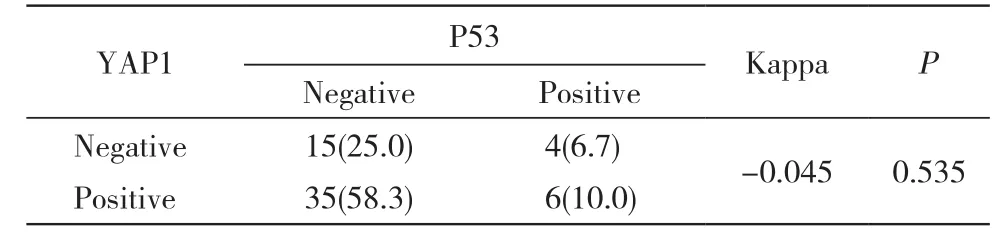
表2 YAP1和P53在B-NHL中表达的相关性Tab. 2 Correlation between expression of YAP1 and P53 in B-NHL (n, %)
讨 论
Hippo通路最早是由Edgar在果蝇(Drosophila)体内发现,对细胞增殖、分化和凋亡起着重要调控作用[8-9]。该通路在生物进化上高度保守,其在哺乳动物中信号传递顺序则后来由Dong等[10]通过小鼠模型实验首次确定。YAP1是Hippo信号通路下游的关键效应因子,具有转录共激活因子活性。通常情况下,磷酸化失活的YAP1定位在细胞质中,经去磷酸化后被活化,然后迅速由细胞质移至细胞核内,与转录因子结合从而激活靶基因的转录与表达[11-12]。Hippo-YAP1通路在机体多种生理病理过程中发挥重要的生物学功能,如调控器官大小、促进组织再生、维持干细胞自我更新等[13-14]。
近年研究发现,YAP1在卵巢癌、宫颈癌、肝癌、胃癌、非小细胞肺癌等多种人类实体肿瘤中呈高表达,且与肿瘤的高侵袭性和不良预后有关[15-19],提示YAP1在这些肿瘤发生发展过程中起着癌基因和抗凋亡作用。然而,最近对结直肠癌和乳腺癌等实体肿瘤的部分研究则得到相反的结论,认为YAP1可能作为一种抑癌基因参与了这些肿瘤的发生[20-21]。虽然,活化的YAP1通常情况下富集在细胞核内发挥作用,但新近研究表明,胞质定位的YAP1可通过促进β-catenin降解、抑制Wnt信号通路等方式起到肿瘤抑制因子作用[22]。综上,目前学者们认为YAP1在人类恶性肿瘤中扮演着原癌基因或抑癌基因的双重角色,究竟以何角色发挥作用,则与起源细胞/组织/器官种类、肿瘤类型、YAP1的亚细胞定位、信号通路交互方式等因素有关。
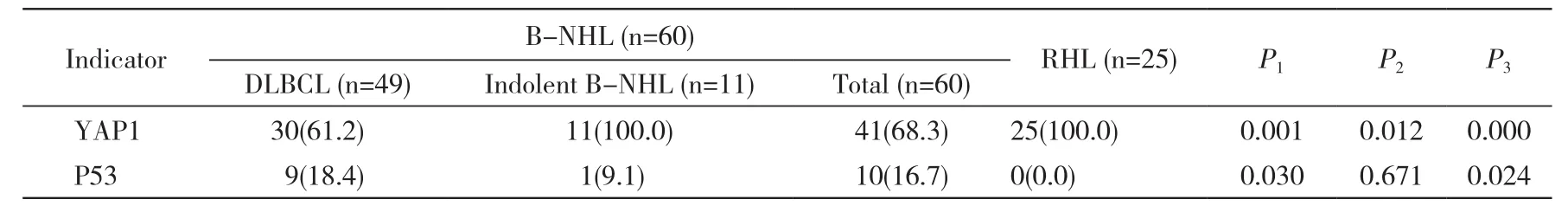
表1 YAP1、P53在B-NHL和RHL中的表达Tab. 1 Positive expression of YAP1 and P53 in B-NHL and RHL (n, %)
虽然YAP1已成为近年来肿瘤的研究热点,但迄今鲜见有关其在淋巴瘤方面的研究报道。本研究结果显示YAP1在良性反应性淋巴组织中广泛表达,阳性细胞为弥漫分布于淋巴滤泡、滤泡间区的各阶段淋巴细胞,其中以滤泡生发中心表达强度最高,但在成熟浆细胞中呈阴性表达,提示YAP1在成熟B细胞分化过程中发挥作用,具体机制尚待进一步研究。在B-NHL中,YAP1在生物学行为相对惰性的SLL和MCL亚型中的表达情况,与在良性反应性淋巴组织中的表达相似,均呈中-强度弥漫表达;而在侵袭性较高的DLBCL亚型中,38.8%的病例YAP1蛋白缺失、呈阴性表达。由于淋巴细胞在成熟过程中要经历很多阶段,而淋巴瘤在许多方面重复着正常淋巴细胞的分化阶段,因而淋巴瘤分类在一定程度上反映了对应的正常分化阶段的形态、遗传学特征和免疫表型[7];鉴于此,结合本研究中YAP1在RHL和B-NHL中表达的特点,进一步表明YAP1在处女B细胞至浆细胞前的各分化阶段(即处女B细胞→生发中心B细胞→记忆B细胞)中发挥重要作用。此外,由于YAP1在RHL的生发中心B细胞中呈强阳性表达,但在对应生发中心B细胞起源的一些DLBCL中呈阴性表达,提示YAP1可能作为肿瘤抑制基因参与了部分DLBCL的发生发展。
p53基因定位于人类染色体的17p13.1,是重要的肿瘤抑制基因。该基因的突变或失活是多种肿瘤发生发展过程中的重要因素。迄今已证实至少50%的实体性肿瘤存在p53基因的缺失或突变。虽然在血液病和淋巴瘤中,p53缺失和突变的频率没有其他肿瘤高,但它与淋巴瘤发生、进展、化疗耐药等密切相关,并且可能是侵袭性淋巴瘤的预后不良因子[23-24]。新近研究发现,p53与Hippo-YAP1通路之间存在交互作用,p53基因状态可影响Hippo-YAP1通路的促癌或抑癌效应的转化。野生型P53蛋白能够与YAP1启动子结合从而激活YAP1转录,而YAP1蛋白作为转录共激活因子,又能促进p53基因转录,两者相互作用形成正反馈调控环,参与诱导细胞凋亡和抑制肿瘤形成[25]。突变型P53蛋白则能够与YAP1直接结合形成YAP1/突变型P53蛋白复合体,进而与转录因子NF-Y结合形成一个多蛋白复合体,该复合体能够与CCNA、CCNB和CDK1等基因的调控区相结合而增强基因转录、促进细胞增生和肿瘤形成[26-27]。本研究结果显示,突变型P53蛋白在B-NHL表达的阳性率为16.7%,其中在DLBCL阳性率为18.4%,与文献报道相似[28]。虽然突变型P53蛋白在B-NHL中表达阳性率不高,但分析结果显示它在B-NHL和RHL间表达有显著差异,推测它可能在少数B-NHL中起到了促进作用。另外,本研究数据未发现突变型P53蛋白表达与YAP1蛋白表达之间存在显著相关性,表明突变型P53蛋白和YAP1可能通过不同的途径和机制参与了部分B-NHL的发生发展。
综上,本研究显示B-NHL中存在Hippo通路的异常,YAP1蛋白可能作为肿瘤抑制因子参与了部分B-NHL的发生发展,但与突变型P53蛋白的表达无相关性,其具体作用机制尚有待从分子水平进一步阐明。
