手术治疗伊马替尼耐药后肿瘤局部进展胃肠道间质瘤患者的疗效观察
2018-12-28孙林德徐文通
成 驰,孙林德,徐文通
解放军总医院 普通外科,北京 100853
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是最常见的间叶源性肿瘤[1],通常DOG-1、CD117[2]免疫蛋白表达阳性,目前认为其与酪氨酸激酶受体C-KIT和血小板衍生生长因子受体A(PDGFRA)的基因突变[3-4]有密切关系,少数病例涉及其他分子改变,包括SDHX、BRAF、NFI、可K/N-RAS及PIK3CA等基因突变[5]。每年的发病率大概在14.5/1 000 000。目前外科手术仍是治疗局限性胃肠道间质瘤的主要方式,但GIST术后容易复发。以伊马替尼为代表的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的应用,使晚期患者的中位生存期延长了近3倍[6-7]。然而伊马替尼治疗的完全缓解(CR)率<5%,绝大多数病人为部分缓解(PR)或疾病稳定(SD),其5年无进展生存期(progression-free survival,PFS)仅为20%。然而半数对伊马替尼治疗敏感的患者可由于出现继发性基因突变在接受治疗后2年左右出现继发性耐药,伊马替尼治疗的中位无进展生存期为18 ~ 24个月[8]。一旦发生耐药患者的病情将迅速进展,而此后的治疗十分棘手。关于手术在治疗局部进展性GIST患者的研究很少。对出现耐药局部进展的患者,耐药病灶的切除可能会使TKI治疗获益时间延长。一些报道表明切除了局部进展疾病可延长生存期。本文回顾性分析解放军总医院收治的34例伊马替尼耐药后肿瘤局部进展的患者,探讨手术联合药物治疗与单独药物治疗伊马替尼耐药后局部进展患者的临床获益情况。
资料和方法
1 一般资料 资料概要:本研究纳入2006年1月-2017年9月于本院治疗的晚期GIST患者,共34例。全部患者GIST诊断明确,免疫组化CD117染色阳性。所有患者临床特征见表1。纳入标准:1)经病理组织学确诊的GIST;2)完全切除原发病灶后出现转移复发或者初次诊断就发生转移并行伊马替尼治疗后继发性耐药;3)转移肿瘤组织CD117阳性。排除标准:1)年龄<18岁、妊娠或哺乳期妇女;2)治疗依从性差;3)伴有其他系统恶性肿瘤。筛选出34例均为伊马替尼治疗后二次耐药出现病情局部进展的患者,所有患者在入组前均行伊马替尼400 mg/d治疗6个月,观察完全缓解(CR)、部分缓解(PR)或稳定疾病(SD)后的局部进展(少量肿瘤病灶较前进展,且进展肿瘤灶术前评估为可切除病灶)情况。
2 治疗及随访 10例患者单纯接受了伊马替尼加量600 mg/d或更换索坦进行治疗,24例对进展肿瘤病灶进行手术切除,术后继续服用伊马替尼治疗。评估患者的一般情况、血液学检查结果、临床疗效及不良反应等情况;每1 ~ 3个月行腹部增强CT了解疾病情况。参照Choi标准[9]即根据肿瘤直径及密度进行客观近期疗效评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),确认是否进展。记录两组的无进展生存期,定义为从伊马替尼耐药后的治疗起至疾病进展或随访截止日期;记录总生存期(overall survival,OS),定义为从伊马替尼耐药后的治疗起到任何原因死亡或随访截止日期。
3 统计学处理 数据统计使用SPSS18.0进行分析。计量资料以±s表示;组间比较采用成组t检验。计数资料以例数及百分比表示,组间比较采用精确概率检验。此外,建立Kapla-meier生存曲线模型,生存期组间比较采用Log rank检验。P<0.05为差异有统计学意义。
结 果
1 两组基线资料比较 联合组与单药组患者的年龄、性别以及原发部位所占的比例差异无统计学意义。见表1。
2 两组疗效比较 随访日期截止到2018年3月,联合组24例,8例存活(33.3%),疾病稳定(SD)3例(12.5%),疾病进展(PD)5例(20.8%);死亡16例(66.7%)。单药组2例存活(20%),疾病稳定(SD)1例(10%),疾病进展(PD)1例(10%),去世8例(80%)。联合组平均随访42.6个月,其中1年、3年生存率为100%、87.5%,中位OS为48.9个月;单药组平均随访26.3个月,其中1年、3年生存率为90%、30%,中位OS为30.7个月。其中6例患者出现轻度水肿等不良反应,给与对症处理后症状改善,未出现不可耐受的不良反应。
3 两组PFS比较 截止到随访日期,单药组10例患者中位PFS为10.5个月(95% CI:7.4 ~ 13.8个月),联合组24例患者中位PFS为17.8个月(95%CI:15.2 ~ 20.5个月),联合组的PFS要优于单药组(Log rank检验χ2=5.484,P=0.019)。见图1。4 两组总生存期OS比较 截止到随访日期,单药组10例患者中位OS为30.7个月(95% CI:22.2 ~38.2个月),联合组24例患者中位OS为48.9个月(95% CI:41.9 ~ 56.0个月),联合组的OS要优于单药组(Log rank检验χ2=6.492,P=0.011)。见图2。
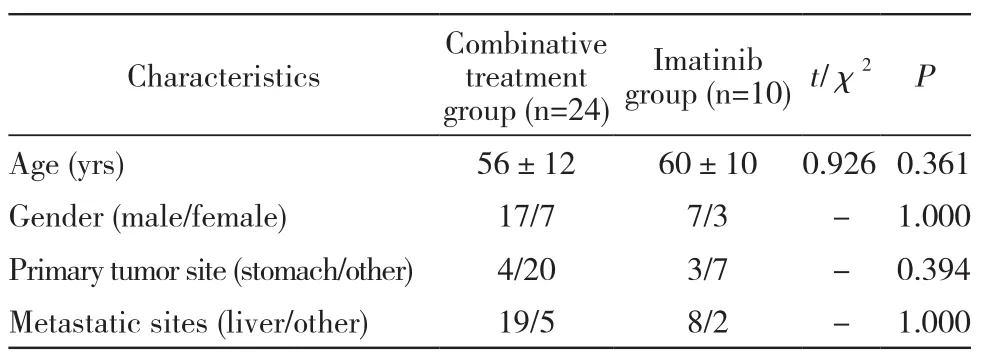
表1 34例转移性GIST 患者基本资料Tab. 1 Basic data of 34 patients with metastatic GIST
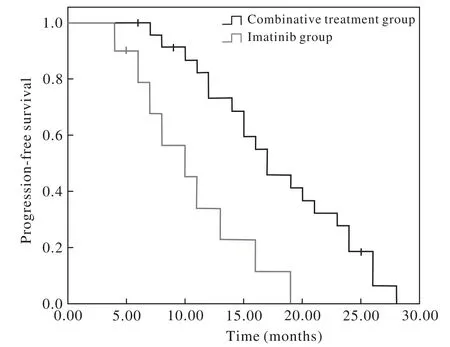
图1 联合组与单药组肿瘤无进展生存期曲线Fig. 1 Progression-free survival of patients in two groups
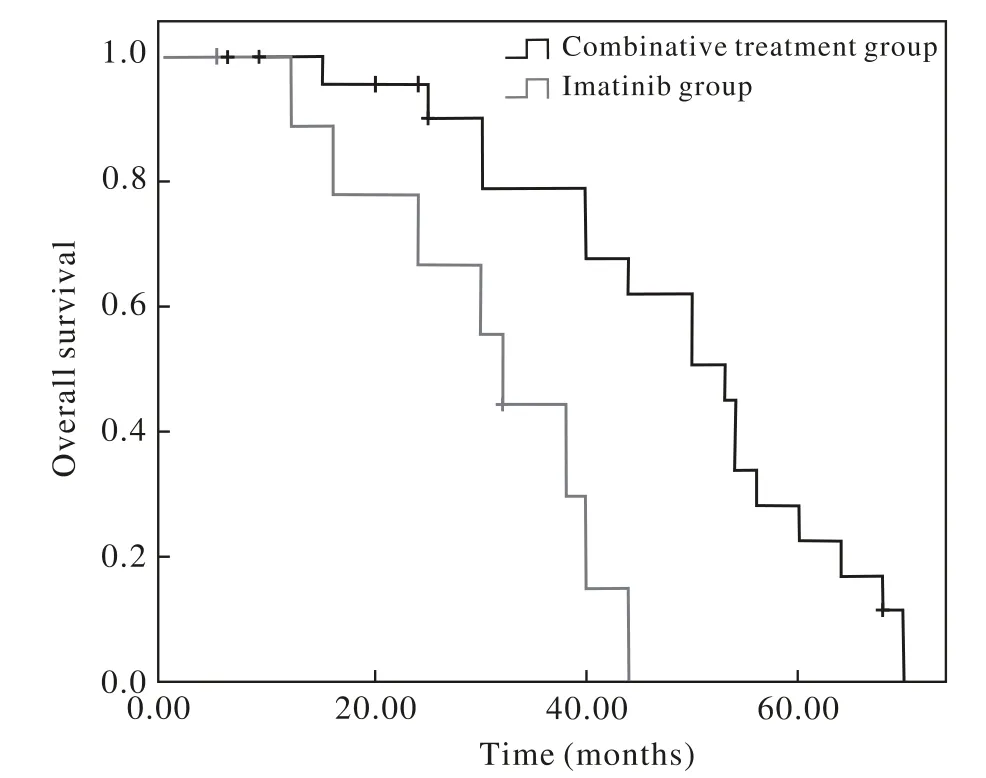
图2 联合组与单药组总生存期曲线Fig. 2 Overall survival of patients in two groups
讨 论
胃肠道间质瘤靶向治疗过程中伊马替尼的耐药已成为一个临床关注的热点。半数病人由于出现继发性基因突变,而在接受治疗后2年左右出现继发性耐药[8,10]。GIST患者出现耐药后肿瘤进展通常包括两种情况,即局部进展及广泛进展。对于局部进展的患者其所有的耐药进展病灶是可以完全切除的;而广泛进展是指多个部位出现耐药进展且进展的病灶无法完整切除。对于伊马替尼标准剂量治疗无效或肿瘤缓解后再次进展的患者,增加剂量是美国国家综合癌症网络(NCCN)和欧洲肿瘤内科学会(ESMO)共同推荐的治疗选择[11],尽管通过增加伊马替尼剂量可使部分病人重新获益,但有效率仅为29%,且中位PFS为21 ~ 24周,中位OS不超过90周[12]。另一种方法就是改用二线药物舒尼替尼,可使患者中位PFS达到27周,但舒尼替尼仅对KIT基因继发突变位于外显子13或14的患者有效,对于外显子17或者18继发突变效果不佳,其总体有效率为30%。而且无论增加伊马替尼治疗剂量还是改用二线的TKI药物其耐受性及安全性均明显下降。
中国胃肠间质瘤诊断治疗共识[13]指出伊马替尼标准剂量治疗期间发生肿瘤局限性进展的患者(即部分病灶出现进展而其他病灶仍然稳定甚至部分缓解),在手术可以完整切除局部进展病灶的情况下,建议实施手术,术后根据病情评估与需要,选择继续维持原剂量、加量或更换索坦治疗。Al-Batran等[14]证实晚期GIST患者在伊马替尼治疗期间表现出局灶性疾病进展的患者可能在手术切除治疗中获益,Hasegawa等[15]表示对能进行完全切除的GIST耐伊马替尼治疗的患者进行外科手术是有效的,其中位PFS约为11个月。Raut等[16]回顾性研究发现局部进展组患者手术切除进展病灶后无论是PFS还是OS均得到了改善,其中位PFS和中位OS分别为7.7个月和29.8个月,因而提出对于肿瘤在靶向治疗中获得良好控制者,可能从手术治疗中获益,束平等[17]在研究伊马替尼耐药的复发转移性胃肠道间质瘤再手术的作用时发现手术患者的总生存期优于未手术患者,中位生存时间分别为44.0个月及19.5个月,从而得出对伊马替尼耐药的复发或转移性胃肠道间质瘤患者进行手术可能提高总体生存期的结论。
手术干预的合理性可能在于清除已经发生耐药的细胞克隆,减轻肿瘤的负荷,使伊马替尼治疗再次有效。
本研究结果显示,接受手术与未接受手术患者的PFS及OS存在统计学差异(P<0.05),即手术可以显著提高局部进展患者的生存率。我们的研究支持在伊马替尼治疗期间局部进展的GIST患者手术切除抗药性病灶可使病人获益,特别是对高剂量伊马替尼或其他TKI不耐受的患者。通过切除已获得耐药性的病灶,可延长转移性疾病患者的生存期。
综上所述,手术干预可使伊马替尼耐药的局部肿瘤进展GIST患者获益,手术联合靶向药物治疗有望成为治疗对伊马替尼耐药晚期GIST的最佳治疗模式[18],但本研究为回顾性研究,可能存在选择偏倚且样本量不足,需要进一步扩大样本量探索并积累更多经验来判断手术干预的价值。
