制大黄-川芎药对通过TLR4/Myd88/NF-κB信号对造影剂诱导大鼠肾小管上皮细胞凋亡及肾组织炎症因子IL-6、IL-1β的影响
2018-12-13许丽萍吕铁钢
郝 健 许丽萍 吕铁钢
(内蒙古医科大学附属医院肾内科,内蒙古 呼和浩特 010050)
造影剂肾病(CIN)主要是由于使用含碘造影剂(CM)而引起的急性肾损伤,通常伴随血清肌酐(Scr)在48~72 h内较基础值显著上升25%或增加0.5 mg/dl(44 μmol/L)〔1~3〕。研究报道,肾小管上皮细胞凋亡是CM致肾损伤和肾衰竭的主要原因〔4〕。彭炎强等〔5〕研究表明,姜黄素能够通过其抗氧化活性来预防CM对大鼠肾小管上皮细胞损伤,从而预防CIN发生。Yue等〔6〕研究发现阿托伐他汀可通过Toll样受体(TLR)4/髓样分化因子(MyD)88信号通路减轻CM引起的急性肾损伤。此外,龚学忠等〔7〕研究报道,制大黄-川芎药对能通过p38/丝裂原活化蛋白激酶(MAPK)通路抑制肾小管上皮细胞凋亡进而保护CIN大鼠肾功能。本研究通过CIN大鼠模型来进一步揭示制大黄-川芎药对缓解CM引起的肾损伤的潜在作用机制。
1 材料与方法
1.1实验材料 雄性SD大鼠24只,体重(200±20)g购自中科院上海实验动物中心;消炎痛、Nω-硝基-L-精氨酸甲酯(L-NAME)均购自Sigma公司;碘海醇(iohexol)购自通用电气药业公司;原位末端标记(TUNEL)试剂盒购自美国Roche公司;Bcl-2、Bax、TLR4、Myd88、核转录因子(NF)-κB抗体购自CST公司;白细胞介素(IL)-6、IL-1β的酶联免疫吸附法(ELISA)检测试剂盒购自上海依科赛公司;中药制大黄、川芎购自内蒙古医科大学附属医院中药房,水煎浓缩成每毫升含生药2.25 g备用。
1.2CIN大鼠模型构建 大鼠随机分为3组,正常对照组(Control组)、CIN模型组(CIN组)、制大黄-川芎药对组(Drug pair组)。Drug pair组于造模前每日行20倍成人标准体重(60 kg)常规用量的制大黄-川芎水煎液灌胃,连续灌胃7 d;Control组、CIN组分别于造模前行等体积磷酸盐缓冲液(PBS)灌胃7 d。7 d后,CIN组和Drug pair组进行CIN模型构建:尾静脉注射消炎痛(10 mg/kg),15 min后注射L-NAME(10 mg/kg),15 min 后注射适量350 mg/ml的碘酒(2 g/kg),Control组注射等体积的PBS。动物手术实验均在相应规章制度下进行,并均获得内蒙古医科大学附属医院动物实验伦理委员会的批准。
1.3大鼠肾功能指标检测 造模后24 h后,尾静脉取血并分离血清,采用全自动生化分析仪测定Scr和尿素氮(BUN);称量大鼠体重并记录,处死大鼠,取肾组织并称重,计算各组大鼠肾指数。
1.4TUNEL染色 取肾组织固定,石蜡包埋,切片,脱蜡、水合,蛋白酶K处理,加入适量TUNEL工作液,加底物显色显微镜下观察,细胞核呈棕黄色为凋亡细胞,随机选取3个视野,以肾小管上皮凋亡阳性细胞占总细胞数的比率为肾小管上皮细胞凋亡率。
1.5Western印迹检测蛋白表达 将肾组织称重,加入适量RIPA裂解液冰上研磨,4℃,离心10 min,取上清,二喹啉甲酸(BCA)法测定蛋白浓度。取适量蛋白样品配成上样缓冲液并加热变性,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白样品并转至PVDF膜,5%脱脂牛奶封闭后分别用Bcl-2、Bax、TLR4、Myd88、NF-κB和GAPDH一抗及辣根过氧化物酶耦联的二抗孵育,电化学发光(ECL)液曝光显影,Image J软件分析各组样品相对表达量。
1.6ELISA检测IL-6、IL-1β表达 根据试剂盒说明,使用大鼠特异的ELISA试剂盒测定IL-6、IL-1β在肾组织中的含量,后将涂层板置于ELISA检测仪中读取每个样品在450 nm处的吸光值,计算样品含量。
1.7统计学处理 采用SPSS19.0软件进行独立样本t检验、单因素方差分析、LSD-t检验。
2 结 果
2.1各组肾病理指标变化比较 与Control组相比,CIN组Scr、BUN和肾指数均显著升高(均P<0.05);与CIN组比较,Drug pair组Scr、BUN和肾指数均显著降低(均P<0.05),由此得知,制大黄-川芎药对能够有效防止造影剂造成的肾功能减弱。见表1。
2.2各组肾小管上皮细胞凋亡率比较 CIN组肾小管细胞凋亡率〔(32.69±5.74)%〕较Control组〔(3.41±0.03)%〕明显增多(P<0.05),与CIN组相比,Drug pair组肾小管细胞凋亡明显减少〔(13.32±1.98)%,P<0.05〕。
2.3各组肾小管上皮细胞凋亡相关蛋白表达比较 与Control组相比,CIN组Bcl-2表达显著降低,Bax表达显著升高;Drug pair组较CIN组Bcl-2表达明显升高,Bax表达明显降低(均P<0.05),见图1、表2。
2.4各组TLR4/Myd88/NF-κB信号蛋白表达比较 与Control组相比,CIN组TLR4、Myd88、NF-κB蛋白表达均显著升高(P<0.05);Drug pair组较CIN组TLR4、Myd88、NF-κB蛋白表达均明显下调(P<0.05),见图2、表3。
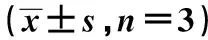
表1 各组肾病理指标变化
与Control组相比:1)P<0.05;与CIN组相比:2)P<0.05,下表同

图1 肾组织中Bcl-2、Bax蛋白表达检测

组别Bcl-2BaxControl组0.32±0.030.11±0.01CIN组0.09±0.011)0.49±0.051)Drug pair组0.21±0.022)0.22±0.022)

图2 各组肾组织中TLR4/Myd88/NF-κB信号通路蛋白表达检测

组别TLR4Myd88NF-κBControl组0.88±0.091.36±0.150.83±0.09CIN组1.16±0.121)2.02±0.231)1.12±0.111)Drug pair组0.93±0.082)1.41±0.162)0.91±0.102)
2.5各组炎症因子IL-6、IL-1β分泌水平比较 与Control组相比,CIN组IL-6、IL-1β分泌显著增加(均P<0.05);Drug pair组较CIN组显著降低了炎性细胞因子IL-6、IL-1β分泌水平(均P<0.05),见表4。
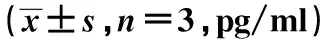
表4 各组肾组织中炎症因子IL-6、IL-1β分泌水平水平
3 讨 论
CIN是应用CIN时发生的重要并发症,是继肾灌注不足和肾毒性药物之后,第三大医院获得性急性肾损伤原因,约占所有医院获得性肾衰竭的11%〔8,9〕。临床上使用等渗和(或)低渗对比剂、加强水合作用、使尿碱化、在手术前24~48 h停止使用肾毒性药物等措施预防CIN。对于有效预防CIN的药物,目前研究主要集中在N-乙酰半胱氨酸(NAC)、抗氧化剂(抗坏血酸)、前列腺素E1、腺苷受体抑制剂(茶碱)、低剂量多巴胺、钙拮抗剂等,但是目前尚无明确的证据支持这些药物的治疗效果和有效剂量〔6,10~12〕。龚学忠等〔4〕发现其能有效抑制CM诱使的肾小管上皮细胞凋亡,保护CIN大鼠肾功能。此外,以制大黄、川芎为主要药物的经验方川黄方能有效治疗CM导致的急性肾损伤及慢性肾脏病基础上的急性肾损伤〔3,13〕。
CIN的病理生理学较为复杂,炎症可能发生在最初的低氧和活性氧(ROS)介导的损伤之后,具有炎症、血管损伤和缺氧的正反馈循环;与炎症相关的因素包括释放氧自由基的氧化应激反应,内皮功能障碍或凋亡及导致肾髓质缺血和缺氧的肾血管收缩〔6〕。研究发现,造影剂可导致肾髓质缺血缺氧,进而导致肾脏脂质过氧化,肾髓质外区氧自由基的产生,从而引起肾小管损伤,且病理检查显示管腔、透明管状物、扁平管状上皮细胞显著扩张,并伴有局灶性间质炎症〔14,15〕,提示CIN发生发展与肾脏炎症密切相关。
TLR4是在肾小管上皮细胞、肾小球系膜细胞、足细胞和其他肾细胞中表达〔16~19〕,TLR4可能参与了肾间质炎症的发生和受损肾小管的修复。TLR4在炎症信号转导中起重要作用,可通过调节下游信号分子如NF-κB的表达来激活免疫和炎症反应,进而释放大量的炎性细胞因子和效应细胞分子,最终导致肾脏炎症〔20,21〕。TLR4与相应配体的结合触发下游信号转导途径,包括Myd88和Myd88独立途径〔22〕。TLR2和TLR4与肾缺血再灌注损伤有关,用脂多糖刺激小鼠肾小管上皮细胞可导致TLR4表达和趋化因子分子分泌增加〔23,24〕。此外,移植有TLR4缺陷型小鼠肾脏的受体正常小鼠无显著急性肾损伤现象,相反,缺乏TLR4基因的受体小鼠移植了含有正常TLR4基因的小鼠肾脏后则呈现处严重的内毒素诱导的急性肾损伤〔25〕。NF-κB可调控炎性细胞因子IL-6和IL-1β的表达〔26〕。本研究结果表明,制大黄-川芎药对保护CIN具体机制可能与抑制TLR4表达,调节TLR4/Myd88/NF-κB信号转导,进而降低IL-6、IL-1β等下游炎症因子的表达来防止肾小管上皮细胞损伤有关。
