双分子荧光互补分析法检测α-突触核蛋白的聚集及在细胞间的传播
2018-12-13任晓曦韩玉坤张建亮
任晓曦 赵 云 韩玉坤 郑 焱 杨 慧 张建亮
(首都医科大学基础医学院神经生物学系 北京脑重大疾病研究院 帕金森病研究所 教育部神经变性病重点实验室,北京 100069)
帕金森病(PD)是一种常见的神经退行性疾病,其主要的病理改变是黑质纹状体内多巴胺能神经元的选择性丢失及路易体形成〔1,2〕。α-突触核蛋白是路易体内的主要成分。证据表明,α-突触核蛋白可能是一种朊蛋白样的蛋白质,他可以聚集成有毒的多聚体形式并在细胞间成“种子”样传播〔3〕。目前认为α-突触核蛋白的寡聚体,可能就是“种子”的一种形式,α-突触核蛋白的寡聚体在被细胞摄取之后,可以使细胞内正常的α-突触核蛋白错误折叠并以它为核心发生聚集,在聚集的过程中不仅会对细胞产生毒性作用,还会有新的α-突触核蛋白寡聚体形成。新的α-突触核蛋白寡聚体被细胞排出后,继续影响周围细胞,开启一个恶性循环〔4〕。因此如果能及早检测出传播的α-突触核蛋白,不仅可以为PD的诊断提供重要的证据,而且还能在PD的早期对其进行干预治疗,缓解PD病理进程。本文中,我们利用高灵敏的荧光素酶human Gaussiaprinceps luciferase(hGLuc)作为报告蛋白〔5〕,构建了一套可以检测α-突触核蛋白聚集及传播的系统,该方法可以有效地检测α-突触核蛋白的聚集及在细胞间的传播,这为PD的早期诊断提供了思路,为PD的早期干预治疗提供了可能。
1 材料与方法
1.1材料 DMEM和胎牛血清(FBS,Gibco),线性聚乙烯亚胺(MW,25 000,PEI)(polysciences,Inc.),腔肠素(Yeasen),α-突触核蛋白抗体(BD),α-actin抗体(冠星宇),Phusion高保真DNA聚合酶,Dpn1(NEB),Amicon® Ultra-4 3KD离心过滤器(Millipore)。
1.2质粒构建 模板pCDNA3.1(+)-α-突触核蛋白,hGLuccDNA序列(优宝生物)。构建pCDNA3.1(+)-α-突触核蛋白-linker-hGLucN,模板上游引物:GGCTTCAGGTTCGTAGTCTTGATAC;模板下游引物:TAACCACTAGTCCAGTGTGGTGG;片段上游引物:CTACGAACCTGAAGCCGGAGGCGGAGGCTCCGGAGGCGGA GGCTCCGCCAAGCCCACCGAGAAC;片段下游引物:CACTGGACTAGTGGTTAGCCTATGCCGCCCTGTG;构建pCDNA3.1(+)-α-突触核蛋白-linker-hGLucC,模板上游引物:GGCTTCAGGTTCGTAGTCTTGATAC;模板下游引物:TAACCACTAGTCCAGTGTGGTGG;片段上游引物:CTACGAACCTGAAGCCGGAGGCGGAGGCTCCG-GAGGCGGAGGCTCCGAGGCGATCGTCGACATTCC;片段下游引物:CACTGGACTAGTGGTTAGTCACCACCGGCCCCC。
1.3细胞培养及质粒转染 将SK-N-SH细胞接种于含有10% FBS的DMEM培养基中,置于5%CO2,37℃细胞培养箱中培养,待细胞密度在80%左右时利用PEI对细胞进行转染。
1.4Western印迹 转染48 h后收集细胞,使用RIPA裂解液裂解细胞,4℃条件下12 000 r/min离心30 min,取上清液,利用二喹啉甲酸(BCA)法测量蛋白质浓度。12%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,聚偏二氟乙烯(PVDF)膜半干转1h,封闭后孵育抗体。
1.5Dot印迹 转染48 h后,收集培养基,使用3 kD离心过滤器将3 500 μl培养基浓缩至100 μl,取1 μl滴与硝酸纤维素(NC)膜上,晾干后用5%脱脂牛奶封闭,随后孵育抗体。
1.6α-突触核蛋白预制原纤维制备 将人源重组α-突触核蛋白单体溶于0.1 mol/L 磷酸盐缓冲液(PBS)中,终浓度为5 mg/ml。随后1 000 r/min,37℃震摇7 d。100 000 r/min离心30 min,分离出聚集成纤维状态的α-突触核蛋白,分装后-80℃保存。
1.7荧光素酶活性检测 将SK-N-SH细胞接种到96孔板中,转染48 h后,弃掉培养基用0.01 mol/L PBS洗3遍,加入Coelenterazine,native,20 μmol/L,酶标仪检测。
1.8统计学方法 采用Graph Pad Prism 6 软件进行单因素方差分析。
2 结 果
2.1BiFC分析法原理及质粒构建 为了构建BiFC分析法〔6〕,首先要将hGLuc的N端(1~93)和hGLuc的C端(94~169)分别与α-突触核蛋白的C端融合〔5,7,8〕,记作L1和L2。为了降低蛋白质空间构象产生的空间位阻,我们在α-突触核蛋白和hGLuc的N端/C端之间插入了一段由10个氨基酸(GGGGSGGGGS)组成的连接子(linker)〔6〕,以使hGLuc的N端/C端可以相对自由的转动(图1)。这样,在同时表达L1和L2的细胞中,如果α-突触核蛋白发生聚集,那么hGLuc的N端和C端就会随之相互靠近,使hGLuc恢复酶活力。恢复酶活力的hGLuc可以催化底物Coelenterazine分解,产生可以被探查到的荧光信号,见图1。

图1 质粒结构图及BiFC分析法原理图
2.2融合蛋白可以在SK-N-SH细胞中表达 质粒构建完成后,我们接下来在SK-N-SH细胞中验证融合蛋白是否表达。我们利用转染试剂将质粒瞬时转入SK-N-SH细胞中,48 h后利用Western印迹检测质粒表达情况。结果显示,两种质粒均可在SK-N-SH细胞中表达,见图2。
2.3BiFC分析法可以检测α-突触核蛋白的聚集 在SK-N-SH细胞系中同时表达L1和L2,48 h后,加入底物Coelenterazine,利用酶标仪读数。结果显示,共同转染组(171.33±14.27)与转染空载质粒组(48.50±5.41)荧光强度差异显著,这说明L1和L2随着α-突触核蛋白聚集而相互靠近,从而使hGLuc恢复了酶活性。为排除L1或L2单独就具有酶活性的情况,将L1或L2分别转染入SK-N-SH细胞系中,48 h后,加入底物Coelenterazine,利用酶标仪读数,结果显示,单独转染L1组(42.33±6.13)和单独转染L2组(44.83±8.51)与转染空载质粒的细胞组没有明显差别,这说明L1或L2单独不具有酶活性。

图2 Western印迹检测融合蛋白L1和L2在SK-N-SH 细胞中表达
2.4结果特异性验证 体外通过GST蛋白纯化的方式得到人源重组α-突触核蛋白单体。随后将α-突触核蛋白单体在体外震摇7 d,获得α-突触核蛋白预制原纤维(PFF)。因为当α-突触核蛋白聚集成纤维状态时,会在溶液中形成沉淀,所以通过超速离心的方式可以将未聚集成纤维状态的α-突触核蛋白,即上清液与聚集成纤维状态的α-突触核蛋白,即沉淀分离开来,见图3。最后将纤维状态的α-突触核蛋白经过超声处理后,利用BiFC分析法检测,结果显示,荧光强度随着PFF浓度的增高而增高,当体系中PFF浓度为0.03 μg/μl时,荧光强度明显增高(1.27±0.08),这说明利用BiFC分析法可以很好地表征α-突触核蛋白的聚集,同时也说明了该方法可以检测到α-突触核蛋白聚集体的存在。
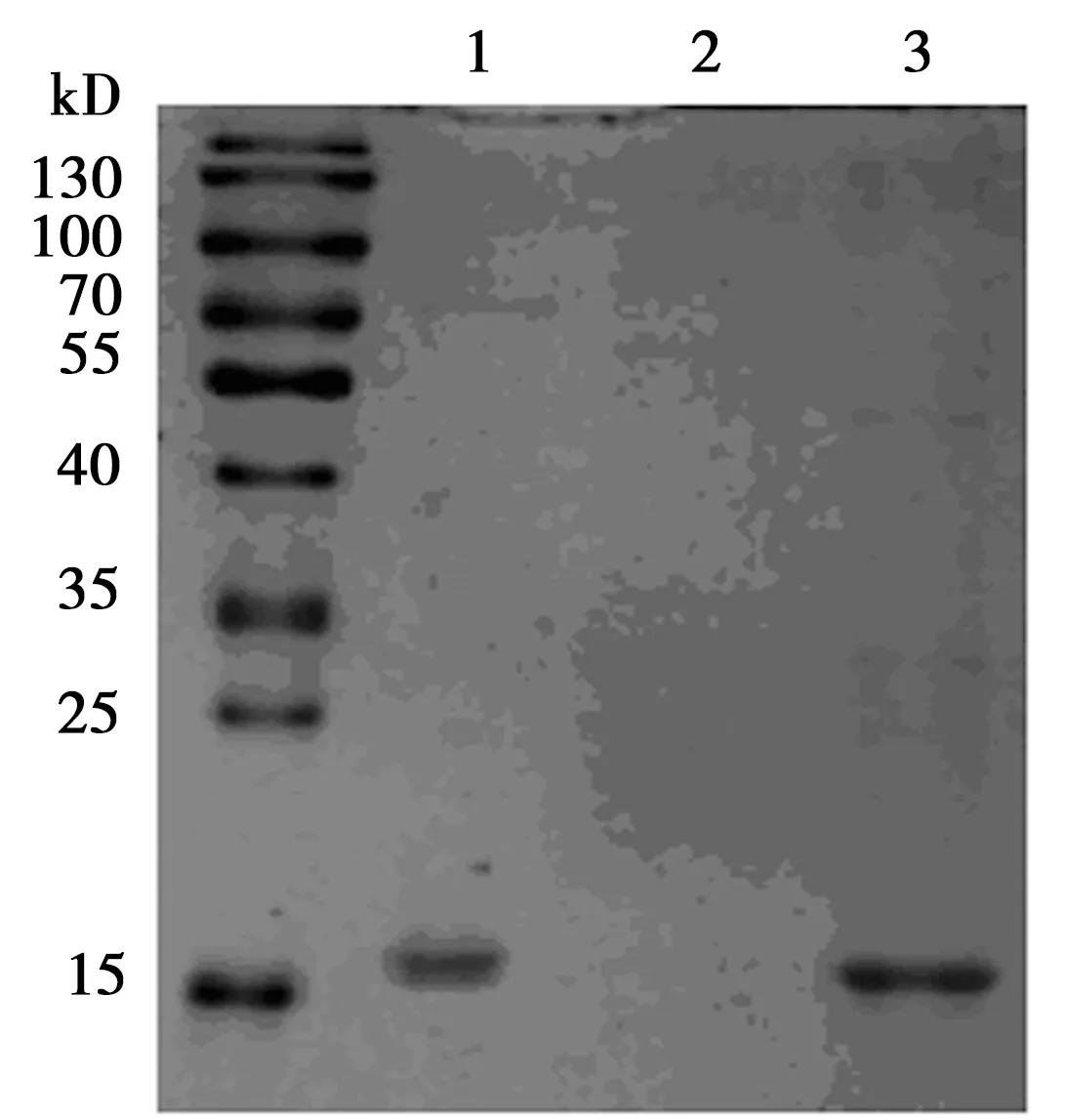
1:α-突触核蛋白单体;2:上清液;3:沉淀图3 人源重组α-突触核蛋白SDS-PAGE
2.5BiFC分析法可以检测到α-突触核蛋白的传播 将L1或L2及空载质粒分别转染入SK-N-SH细胞中,48 h后收集培养基,记为L1(m)、L2(m)和空载质粒(m)。Dot印迹结果证明了L1(m)和L2(m)中有α-突触核蛋白的存在,而空载质粒(m)中没有(图4)。随后将L2(m)和空载质粒(m)分别加入到已经转染了L1的SK-N-SH细胞中(转染36 h后),记为L1+L2(m)组和L1+空载质粒(m)组;L1(m)和空载质粒(m)分别加入到已经转染了L2的SK-N-SH细胞中(转染36 h后),记为L2+L1(m)组和L2+空载质粒(m)组。继续培养12 h后,加入底物Coelenterazine,利用酶标仪读数。结果显示,L1+L2(m)组的荧光强度(26.25±2.17)要明显高于L1+空载质粒(m)组(21.00±0.89),同样L2+L1(m)组的荧光强度(29.20±5.00)要明显高于L2+空载质粒(m)组(19.00±2.28)。而L1+L2(m)组和L2+L1(m)组的荧光强度没有统计学差异,L1+空载质粒(m)组与L2+空载质粒(m)组的荧光强度也没有统计学差异。以上结果说明BiFC分析法可以检测到α-突触核蛋白在细胞间的传播。

图4 Dot印迹检测培养基中的α-突触核蛋白
3 讨 论
在本研究中,我们利用高灵敏的荧光素酶hGLuc作为报告蛋白,将其N端(1~93)与C端(94~169)分别与α-突触核蛋白的C端融合,并将L1和L2在SK-N-SH细胞中共同表达,结果显示L1和L2随着α-突触核蛋白聚集而相互靠近,从而使hGLuc恢复了酶活性。随后我们加入PFF,诱导内源性α-突触核蛋白的聚集,结果显示荧光强度随着PFF浓度的增高而增高,当体系中PFF浓度为0.03 μg/μl时,荧光强度明显增高,这说明利用BiFC分析法可以很好地表征α-突触核蛋白的聚集,同时也说明了该方法可以检测到α-突触核蛋白聚集体的存在。最后将L1和L2分别在SK-N-SH细胞中表达,结果表明BiFC分析法可以检测到α-突触核蛋白在细胞间的传播。
α-突触核蛋白是PD中的关键蛋白质,它可以聚集成有毒的多聚体形式,α-突触核蛋白可以在细胞与细胞之间传播〔9,10〕。不仅如此,其寡聚体犹如一颗种子,在进入细胞后可以诱导细胞内正常的α-突触核蛋白发生聚集并释放到细胞外从而影响周围细胞,开启一个恶性循环。而这个恶性循环无疑是PD发生发展的关键因素。但是传统方法,如非变性聚丙烯酰胺凝胶电泳,密度梯度离心法,排阻色谱或者原子力显微镜观察等,不仅费时费力,而且也很难检测到α-突触核蛋白的聚集和在细胞间的传播。本研究中的BiFC分析法为检测α-突触核蛋白的聚集和在细胞间的传播提供了新的解决思路。这不仅为PD的早期诊断提供了思路,为PD的早期干预治疗提供了可能,而且也为抑制α-突触核蛋白聚集的药物筛选提供了帮助。
