构建思维模型 提升化学方程式教学质量
2018-12-07罗炳杰
罗炳杰
(厦门市大同中学,福建 厦门 361003)
学生书写方程式时往往缺乏思路不知所措甚至胡乱书写,主要原因是结构、概念、原理及规律等知识孤立开来没有整合,造成死记硬背不知所以然,书写时顾此失彼。为此,笔者认为化学方程式教学的关键是构建认知模型,运用模型书写化学方程式。
一、构建分类模型,以分类观指导化学方程式书写
书写化学方程式要整体把握。其思维模型为:反应方向(反应能否进行)→反应条件→物质和能量变化→反应限度→反应规律等。通过此思维模型固化书写化学方程式步骤,避免书写方程式时顾此失彼、漏洞百出。
元素化合物性质的学习,通常采取分类法。其思维模型为:物质的一般通性→物质的氧化还原性→物质的特殊性。如学习SO2的性质按照以下步骤:酸性氧化物的通性→SO2的氧化性和还原性→SO2的特性(漂白性)。烃的化学性质,其思维模型为:结构→通性(加成、取代、氧化)→特性,烃的衍生物,其各类物质之间转化模型为:烷烃→卤代烃→醇→醛→酸→酯,此模型反映了官能团的氧化顺序,有机物官能团命名顺序以及它们之间的转化关系,通过分类模型指导各类物质化学性质的学习,有利于形成知识网络,促进知识的组织化、结构化。
二、构建规律模型,以规律指导化学方程式书写
化学反应通常按照以下六种不同分类方法,分别是基本反应类型(化合、分解、置换、分解)、氧化还原反应与非氧化还原反应、可逆反应与不可逆反应、放热反应与吸热反应、离子反应与非离子反应、自发与非自发反应等,如何帮助学生快速认知不同物质间的化学反应,可构建以下不同的思维模型。
1.复分解反应模型——“三强制取三弱”
“三强”之一是“强酸”制取弱酸。强酸与弱酸盐反应制取弱酸和强酸盐,“强酸”是相对而言,其模型为:“强酸”+盐→弱酸+新盐,根据酸的Ka大小,常见弱酸其排列顺序(或提供质子的能力)为:H2C2O4>H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO>HCN>Al(OH)3,其离子结合质子能力的顺序为:。知道了不同酸的酸性强弱顺序,就可举一反三书写“强酸”制取弱酸的方程式。
例如,SO2+Na2CO3=Na2SO3+CO2↑ (H2SO3>H2CO3);
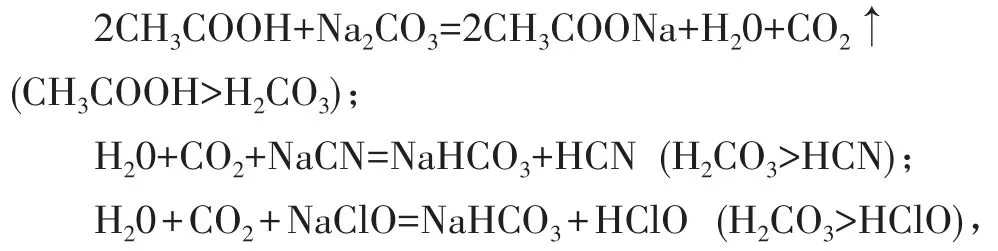
对于处在H2CO3与之间的酸,无论CO2通入多少其盐均生成等。
“三强”之二是“强碱”制取弱碱。“强碱”与盐反应生成弱碱和新盐,“强碱”是相对而言,其模型为:“强碱”+盐→弱碱+新盐,依据碱Ksp大小,常见弱碱其排列顺序为:Mg(OH)2>NH3·H2O>Fe(OH)2>Zn(OH)2>Cu(OH)2>Al(OH)3>Fe(OH)3,根据碱性顺序可书写化学方程式或离子方程式。例如,3NH3·H2O+AlCl3=Al(OH)3↓+3NH4Cl;Mg(OH)2溶于NH4Cl溶液,其离子反应方程式:。
“三强”之三是“易溶”制取难溶。“易溶盐”与盐反应生成更难溶盐和新盐,“易溶盐”是相对而言,其模型为:“易溶盐”+盐→难溶盐+另一种新盐,依据难溶盐K sp大小排序,其顺序为:AgCl>AgBr>AgI;MnS>FeS>ZnS>PbS>CuS>HgS。
例如,AgCl(S)+Br-(aq)=AgBr(S)+Cl-(aq);FeS(S)+Hg2+(aq)=HgS(S)+Fe2+(aq),“三强制三弱”即“强酸”制取弱酸;“强碱”制取弱碱;“易溶盐”制取难溶盐;“三强”制“三弱”的本质是K越大,反应越完全。通过模型整合了酸和碱的强弱顺序以及难溶盐的溶解性顺序,方便快速书写复分解反应方程式。
2.氧化还原反应模型——“二强制取二弱”
“二强制二弱”即:反应物的氧化性比氧化产物的氧化性强;反应物的还原性比还原产物的还原性强,其模型为:强氧化剂+强还原剂→弱氧化剂+弱还原剂,常见氧化剂物质顺序:F2>>Cl2>HNO3(浓)>HNO3(稀)>H2SO4(浓)>Br2>Fe3+>Cu2+>I2>S>H+>Fe2+;F2>O2>Cl2>Br2>I2>S;Ag+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+,常见还原剂顺序:S2->Fe2+>Br->Cl-以及金属活动顺序,根据上述氧化还原性强弱顺序,可快速书写以下方程式,例如:2Fe3++Cu=2Fe+Cu2+;Br2+2Fe2+=2Br-+2Fe3+;16H++2Mn2++5Cl2↑+8H2O,物质的氧化还原性由本性所决定,同时还与浓度大小有关。运用模型快速判断发生氧化还原反应可能性,并指导陌生氧化还原反应的书写。
3.其他常见反应模型
化学反应基本类型常用不同的模型来表示,如复分解反应用以下模型:AB+CD=AD+CB表示,对于化合反应用以下模型:A+B+C→D,对于具体一些反应还可再具体化,如,酸性氧化物制取酸反应模型:酸性氧化物+H2O=生成对应可溶性酸(对应是指化合价不变),例如,SO3+H2O=H2SO4;SO2+H2O=H2SO3;P2O5+3H2O=2H3PO4;SiO2+H2O≠H2SiO3。碱性氧化物制取碱反应模型有:碱性氧化物+H2O=生成对应的可溶性碱(化合价不变),例如,Na2O+H2O=2NaOH;CaO+H2O=Ca(OH)2;BaO+H2O=Ba(OH)2;Fe2O3+3H2O≠2Fe(OH)3。
酸性氧化物与相应酸式盐间的相互转化,其模型为:盐+相应的酸=酸式盐,例如,Na2CO3+H2O+CO2=2NaHCO3;Na2SO3+H2O+CO2=2NaHSO3;Na2S+H2S=2NaHS。酸式盐盐+相应的酸,例如,2NaHCO3+CO2↑;CaCO3,通过以上模型能将不同章节的化学方程整合成一个模型,促进知识间的联系。
三、构建综合转化模型,融会贯通化学反应
为了进一步熟练主干知识,融会贯通各物质之间的关系,树立元素观、守恒观、变化观等观念,通过不同模型将各物间联系起来,巩固各物质的性质,可采用不同的模型。如:模型1(直线型1)、模型2(置换型)、模型3(交叉型)、模型4(三角型)将物质间的转化关系表示出来。
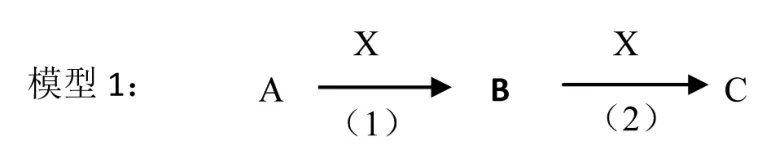
模型1中,当X为O2时:;当 X为 CO2时:;当 X 为强酸时:CO2;当X 为强碱时:;当 X 为铁时:Cl2→FeCl3→FeCl2。
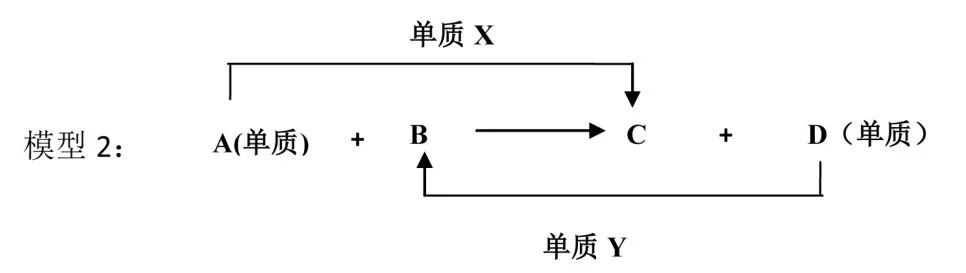
例1:2Mg+CO2=2MgO+C;
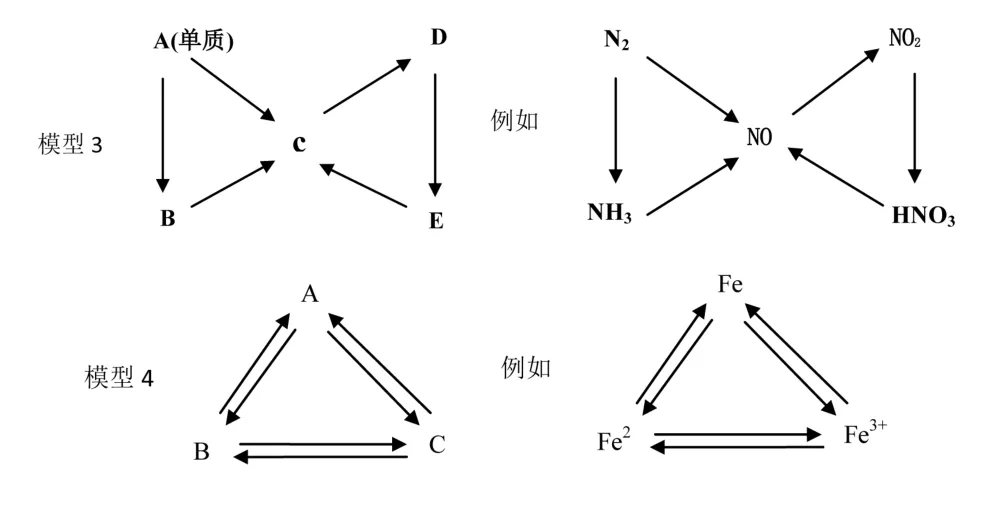
通过不同的模型,巩固元素及其化合物的主干知识,并对不能一步实现反应归纳,如H2S(或S)不能一步转化为SO2;如NH3(或N2)不能一步转化为NO2;SiO2、Fe2O3、Al2O3、CuO等物质不能与水反应等。
