果胶低聚糖制备及其体外增殖青春双歧杆菌的研究
2018-12-03巫晓燕蔡为荣
巫晓燕,蔡为荣
(安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
低聚糖(Oligosaccharide)主要存在于多种植物中,人体摄入后很难被吸收[1-2],有甜味,可在食品加工中作为添加剂使用,制作的食品热量低,更健康[3-5].功能性低聚糖主要有低聚异麦芽糖、低聚果糖、低聚木糖等[6],目前对果胶低聚糖(POS)的研究不多.果胶低聚糖广泛存在于植物的果皮中,是容易获得的功能性低聚糖,它们通常由酶解法、化学合成法、物理法等制备[7-9].孙丽娜[10]等筛选出最佳的果胶酶,并且以该果胶酶酶解果胶制备了聚合度1~2的低聚糖混合物,众多学者利用化学法进行了研究,此法可以获得聚合度单一的寡聚半乳糖醛酸[11-12].研究采用酶解法制备果胶低聚糖,可以获得低聚合度的果胶低聚糖.目前分离纯化果胶低聚糖的方法包括分级醇沉法、微生物发酵法、色谱柱分离法、超滤膜分离法等[13].研究选用超滤装置,分离效率更高、能耗比较低、易于操作,在未来糖类物质分离纯化的研究上应用更加广泛.
双歧杆菌(Bifidobacterium)是人体肠道中最重要的有益细菌,主要存在于人体的大肠,对人体有多种保健功能[14-15].普通人肠道中常见的双歧杆菌有两歧双歧杆菌(B.amphibius)、青春双歧杆菌(B.adolescentis)、婴儿双歧杆菌(B.infantis)、长双歧杆菌(B.longum)和短双歧杆菌(B.breve)[16].
青春双岐杆菌(B.adolescentis)具有很强的耐酸、耐氧性,对人体胃酸和胆碱有较强的适应力.采用微囊化技术,可大大降低胃酸、胆碱对有益菌的伤害,顺利到达胃肠道,对低聚糖的微胶囊化制备具有实际的研究意义.选择青春双歧杆菌作为唯一菌种,对双歧杆菌的益生作用进行代表性研究.目前发现双歧杆菌的有益作用包括以下几个方面:治疗慢性腹泻与抗生素相关性腹泻;有效缓解便秘;抑制癌症的发生和发展;保护肝脏;促进人体对乳糖的消化;营养作用[17-20].
柑橘皮是生产果胶低聚糖的有效来源,利用果胶酶将柑橘果胶分解,通过超滤膜过滤后得到不同分子量范围果胶低聚糖.由柑橘皮制备的双歧因子果胶低聚糖在肠道中具备消化性,是生产第二代双歧因子的极佳选择[21].
采用超滤膜分离成为3种不同组分的果胶低聚糖,分子截留量分别为3 KDa、5 KDa、10 KDa.在体外厌氧条件下,研究了低聚糖对青春双歧杆菌增殖的影响,并对其基本发酵性质进行了研究.
1 材料与仪器
1.1 实验材料
果胶低聚糖:由柑橘果胶通过酶法实验室制备.果胶裂解酶(酶活≥600 U/mL)(夏盛食品有限公司).菌种:青春双歧杆菌(B.adolescentis)(江南大学微生物实验室提供).试剂:DNS试剂[22];溶菌酶(美国BBI公司);乙醇;浓硫酸;氢氧化钠.
1.2 实验仪器
台式高速离心机(四川蜀科仪器有限公司);紫外可见分光光度计(上海元析仪器); W-CJ-2F型超净工作台(北京佳源兴业有限公司);超滤设备(MiLipore公司);SYQX-Ⅱ型厌氧培养箱(上海佰好仪器有限公司);高压蒸汽灭菌锅(上海申安医疗器械有限公司);笔试酸度计(深圳市宇辉科技有限公司).
2 实验方法
2.1 酶法制备果胶低聚糖
参照李拖平[23]等实验稍作修改,果胶可被果胶酶分解成多个低聚半乳糖醛酸,在强酸条件下被分解为半乳糖醛酸单糖.
①向配制好的果胶溶液中加入果胶内切酶;②反应一段时间后,可得到多糖、低聚糖和单糖的混合液;③将上述溶液中加入80%乙醇,沉析、过夜后置于离心机中离心15 min,转速为4 000 r/min;④完成后,上清液为单糖、低聚糖的混合液,沉淀为多糖混合物[24].
2.2 计算果胶低聚糖得率
吸取1.0 mL含有单糖和果胶低聚糖的清液,加入1.0 mL质量浓度为1.5 mol/L的硫酸,沸水浴90 min,再加1.0 mL质量浓度为3.0 mol/L氢氧化钠溶液中和,加入3.0 mL DNS试剂,把同体积1.0 mL未酸解清液稀释3倍,作为空白对照.依照标准曲线测定进行后续实验,于630 nm处测OD值,得半乳糖醛酸含量,计算低聚糖得率.

式中,a为OD对应还原糖(μg/mL);b为稀释倍数;V1为乙醇提取的溶液总体积(mL);c为底物的摩尔浓度(μmoL/mL);V2为酶促反应液底物体积(mL);M为半乳糖醛酸相对摩尔质量(μg/umol).
2.3 果胶低聚糖的超滤分级
将分子截留量为10 KDa的膜组件组装好,超滤条件为:压力0.020 Mpa,果胶低聚糖溶液温度35 ℃,果胶质量浓度1 g/L;将果胶低聚糖溶液通过超滤膜,分子量小于10 KDa的果胶低聚糖在压力作用下透过超滤膜流出.保留液返回,分子量小于10 kDa的果胶低聚糖溶液循环稳定后方可得到;再将分子量小于10 KDa的低聚糖溶液依次通过分子量为5 KDa和3 KDa的超滤膜,操作步骤同上,得到POS1(分子量<3 KDa),POS2(分子量3~5 KDa),POS3(分子量5~10 KDa)的低聚糖溶液,冷冻干燥,备用.
2.4 厌氧培养青春双歧杆菌
(1)配制培养基.活化培养基:酵母膏5.0 g,牛肉膏10.0 g,蛋白胨10.0 g,乙酸钠5.0 g,柠檬酸氢二铵2.0 g,磷酸氢二钾2.0 g,吐温-80 1.0 mL,硫酸锰0.25 g,硫酸镁0.58 g,葡萄糖10 g,pH 6.5±0.1;增殖培养基:以果胶、果胶低聚糖替换种子培养基中的葡萄糖,其他成分同种子培养基.
(2)青春双歧杆菌的活化、增殖.活化培养:取-80 ℃保存的青春双歧杆菌冻干菌,接种至活化培养基中,放置于厌氧培养箱中(90% N2,5% CO2,5% H2),37 ℃条件下培养48 h.挑取菌落于0.85%的无菌生理盐水中,经过梯度稀释配成菌悬液(浓度为1×106~1×108CFU/mL),4 ℃冰箱中保存.增殖培养:取9 mL增殖培养基置于具塞螺纹试管,121 ℃条件下灭菌25 min,趁热旋紧螺盖并转入厌氧培养箱,于 37 ℃条件下,接入2%青春双歧杆菌,在37±1 ℃条件下严格厌氧静置培养.
2.5 发酵性质的研究
通过无菌手套在厌氧培养箱中进行如下实验操作.
(1)发酵液pH的测定.分别在0 h、4 h、6 h、8 h、10 h、24 h、48 h时间点吸取发酵液样品,用笔试酸度计在室温下自动测定,每个样品平行测3次,取平均值,绘制pH曲线.
(2)绘制青春双歧杆菌生长曲线.将活化选育的青春双歧杆菌接种到MRS液体增殖培养基中,分别在0 h、4 h、6 h、8 h、10 h、24 h、48 h时间点吸取发酵液样品,于600 nm下测吸光度,以葡萄糖基础培养基作为空白对照,绘制果胶低聚糖对青春双歧杆菌生长曲线.
(3)绘制葡萄糖标准曲线.取6支试管编号,依次加入1 mg/mL葡萄糖标准溶液,蒸馏水和DNS试剂.摇匀,沸水浴15 min.放置冷却至室温,加入适量蒸馏水稀释到25 mL,混匀.0管在540 nm处做空白对照,分光光度计测1~5管OD值.
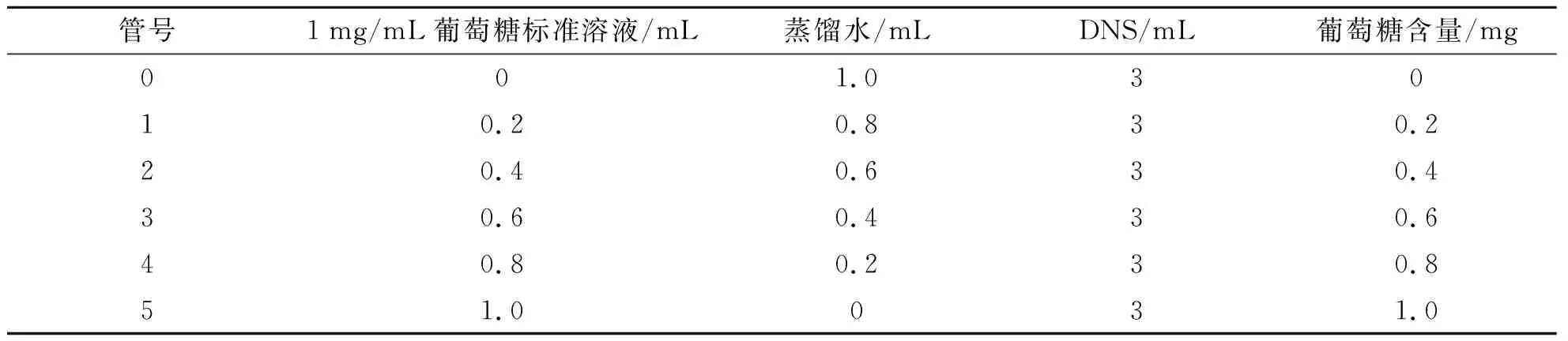
表1 葡萄糖标准曲线
(4)青春双歧杆菌基质消耗曲线的测定.青春双歧杆菌发酵液分别在0 h、4 h、6 h、8 h、10 h、24 h以及48 h收集.测定不同时间点的发酵液中的含糖量,绘制曲线.(方法同2.5(3)).
(5)果胶低聚糖增殖青春双歧杆菌.基础培养基中分别以果胶、果胶低聚糖作为唯一碳源,接种活化后的青春双歧杆菌到厌氧培养箱在37 ℃培养(2%接种量),以无糖培养基作为阴性对照.分别测定0 h、4 h、6 h、8 h、10 h、24 h、48 h的吸光度值,绘制生长曲线.Degawa Y[25]等利用PI值作为益生菌益生作用的评价指标,为进一步比较果胶组分对青春双歧杆菌增殖的影响,采用48 h发酵液吸光度法(波长600 nm)计算益生指标PI,计算PI高于0.5表示增殖作用明显.
式中,AP0、AP48为添加果胶、果胶低聚糖发酵青春双歧杆菌0 h和48 h的吸光度;AG0、AG48为添加葡萄糖发酵青春双歧杆菌0 h和48 h的吸光度;AC0、AC48为无糖培养基0 h和48 h的吸光度.
3 结果与分析
3.1 培养青春双歧杆菌发酵液pH和生长曲线图
青春双歧杆菌pH及其生长曲线如图1所示.由图1可知,0~6 h,处于适应期,pH下降,生长缓慢;6~24 h,处于对数期,生长迅速;24~48 h,生长趋于平缓,pH逐渐稳定.研究选择48 h作为青春双歧杆菌发酵的终点.从pH曲线可以看出,发酵液的pH持续降低,说明发酵过程产生了某些酸性代谢物,可降低肠道pH,抑制肠道腐败菌生长,有益于宿主的健康.
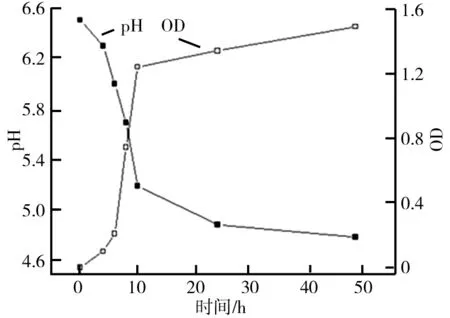
图1 青春双歧杆菌pH及其生长曲线
3.2 青春双歧杆菌还原糖消耗曲线
葡萄糖标准曲线如图2所示,回归方程为y=0.680 5x-0.034,R2=0.999 5,说明以葡萄糖为标准品在测量范围内满足测定的要求,可用于计算还原糖含量.用紫外可见分光光度计测定以果胶低聚糖为唯一碳源的青春双歧杆菌培养基在0 h、4 h、6 h、8 h、10 h、24 h和48 h的吸光度值,根据上述回归方程可计算不同时间点培养基中的还原糖含量,绘制青春双歧杆菌基质消耗曲线如图3所示.由图3可知,青春双歧杆菌在适应期,还原糖消耗较慢,处于对数期,还原糖消耗明显增多,在24 h之后还原糖消耗速率逐渐加快,最终的残糖含量为3.453 mg/mL.

图2 葡萄糖标准曲线 图3 青春双歧杆菌基质消耗曲线
3.3 果胶及果胶低聚糖对青春双歧杆菌的增殖影响
果胶及果胶低聚糖对青春双歧杆菌的增殖影响如图4所示.由图4可以看出,果胶、果胶低聚糖对青春双歧杆菌均具备较好的增殖作用,但相对而言,果胶低聚糖的增殖效果更好,且分子量越小,增殖效果越好.总体来看,在4~12 h,青春双歧杆菌快速生长,在24 h之后,青春双歧杆菌的生长趋于平缓.
3.4 青春双歧杆菌发酵48 h的PI值
青春双歧杆菌发酵48 h的PI值如图5所示.由图5可以看出,添加果胶低聚糖的青春双歧杆菌发酵液的PI值达到0.5以上,而以果胶作为碳源的青春双歧杆菌发酵液的PI值不超过0.3.由此可以看出,果胶水解后的益生作用变好(PI值增高),且分子量越小,越有利于促进青春双歧杆菌的增殖.

图4 果胶及果胶低聚糖对青春双歧杆菌的增殖影响 图5 青春双歧杆菌发酵48 h的PI值
4 结论
根据实验结果得出,在体外模拟实验中,果胶低聚糖能有效促进青春双歧杆菌的增殖,且低分子量的增殖效果更好.在厌氧培养发酵过程中产生了酸性代谢产物,可以降低肠道pH值,同时抑制肠道腐败菌的生长,有利于宿主的健康.但体外实验难以很好地模拟复杂的人体肠道环境,只能对实验结果进行初步测试.要想得出准确、完善的实验结论,就要认真进行下一步的体内实验.
