磷酸水解酶对大肠杆菌工程菌合成番茄红素的影响
2018-12-03刘洋洋王天民郭佳慧薛正莲邢新会
刘洋洋,王天民,郭佳慧,张 翀,3,薛正莲,邢新会,3*
(1.安徽工程大学 生物与化学工程学院,安徽 芜湖 241000;2.清华大学 化学工程系生物化工研究所,北京 100084;3.清华大学 合成与系统生物学中心,北京 100084)
番茄红素是存在于自然界中的一种天然色素,因最初从番茄中分离出来而得名.番茄红素广泛存在于人体的血液、肾上腺、肝脏、睾丸、前列腺、乳腺、卵巢、子宫、消化道等器官中[1].番茄红素具有极强的清除自由基、增强机体免疫力、抗癌治癌等诸多生理功能[2-4],因而已成为目前食品和医药领域的研究热点,在医药、功能食品、化妆品等行业得到了广泛应用[5].
磷酸水解酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基.研究发现磷酸水解酶在生物体中广泛存在,如在大肠杆菌基因组上HAC家族的磷酸水解酶就有十余个[6],是一类具有很宽底物谱和非特异性的蛋白质家族[7].近年来一些报道也陆续揭示了在大肠杆菌中影响萜类化合物的合成与磷酸水解酶系统有着密切联系,在大肠杆菌MEP途径中含有许多磷酸和双磷酸基团中间体,具有底物广谱性的磷酸水解酶可能对这些磷酸化合物具有催化活性[8],大肠杆菌代谢网络中存在一系列具有底物广谱性的磷酸水解酶,对类β-胡萝卜素合成途径中的重要前体法尼基焦磷酸(FPP)具有催化活性[9],nudB基因编码的磷酸水解酶能够催化类胡萝卜素合成途径中的焦磷酸异戊烯酯(IPP)及焦磷酸二甲基烯丙酯(DMAPP)的水解,通过在大肠杆菌中表达磷酸水解酶基因nudB,可以使得IPP的质量浓度(培养24 h后)下降40%左右[10].以上这些研究表明,大肠杆菌内源的磷酸水解酶系可能成为提高番茄红素生物合成的重要靶点.
以番茄红素作为目标产物,在生产番茄红素高产菌的基础上,通过筛选目标磷酸水解酶的表达量下调文库,研究磷酸水解酶与番茄红素产量之间的相互关系.
1 材料与方法
1.1 菌株和试剂
EscherichiacoliDH5α(北京博迈德)作为质粒构建的宿主菌,在液体LB (Luria-Bertani)培养基和固体LB培养基条件下,利用Gibson[11]或Golden Gate[12]组装方法构建研究中所需质粒.dCas9质粒(实验室保藏);E.coliDH1(美国标准生物品收藏中心);lyc001(实验室保藏);lyc011(研究中构建),作为宿主菌;用于构建生产番茄红素的菌株以及研究中构建的所有工程菌的出发菌;研究中PCR所用到的酶及试剂均来自于New England Biolabs以及全式金生物.质粒提取试剂盒和胶回收试剂盒来自Omega公司.基因组提取试剂盒来自TIANGEN公司.
所用抗生素名称及质量浓度分别为50 mg/L卡那霉素(北京鼎国生物技术有限责任公司)、15 mg/L卡那霉素、100 mg/L氨苄青霉素(北京鼎国生物技术有限责任公司)、15 mg/L氨苄青霉素;丙酮(北京现代东方精细化学品有限公司);番茄红素标准品(Sigma-Aldrich公司).
1.2 方法
(1)引物储备液及工作液的制备.将装有引物干粉的EP管8 000×g离心2 min,加入无菌水,无菌水的体积由管内引物的摩尔数决定,制得引物储备液.引物储备液的摩尔浓度一般为100 μM.将引物储备液稀释10倍,即得摩尔浓度为10 μM的引物工作液.引物储备液和工作液在-20 ℃冰箱长期保存.
(2)质粒构建.研究中主要构建的是含有双sgRNA的pTargetF质粒,构建该质粒可分为三个步骤,第一、二步骤利用Q5TM DNA Polymerase催化的PCR反应分别构建pTargetF质粒骨架和两个含有sgRNA的片段.第三步骤是利用Golden Gate组装原理的PCR反应将pTargetF质粒骨架和两个含有sgRNA的片段连接成含有双sgRNA的pTargetF质粒(能同时组装多个片段).利用化学转化法将构建好的质粒转化到E.coliDH5α中,并在摇床复苏30 min后涂LB平板.培养箱培养12 h,挑取单菌落测序.若未特殊说明则菌株均是37 ℃摇床200 r/min下培养.构建过程及pTargetF质粒图谱如图1所示.
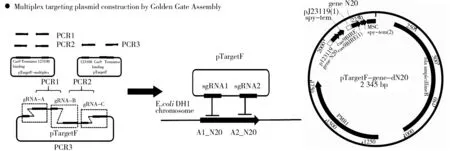
图1 基于Golden-Gate快速组装双sgRNA pTargrtF质粒
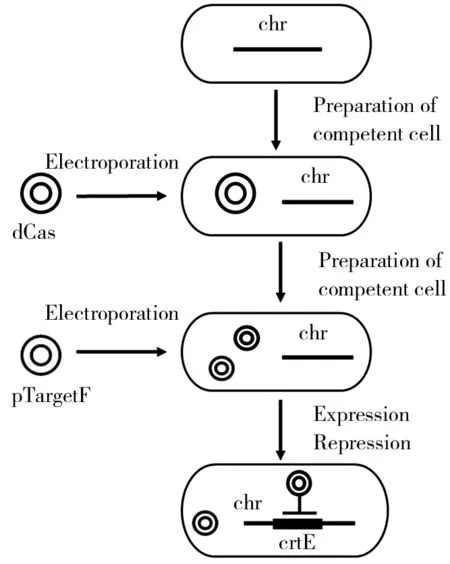
图2 基于CRISPRi系统的同源重组操作流程示意图
(3)菌株构建.主要构建的是pTargetF质粒和dCas9质粒.构建这类菌株可分为2步,如图2所示.第一步是电转感受态制备:将培养至OD600为0.6左右的菌液倒入预冷的BD管中,在已4 ℃预冷的高速冷冻离心机6 000 r/min离心5 min,弃上清,加入预冷的无菌水重悬细胞离心弃上清;重复两次上一步骤后加预冷的15%甘油重悬细胞,分装至无菌的1.5 mL EP管中.第二步为电转转化质粒:向感受态细胞悬液中加入所要电转的pTargetF质粒和dCas9质粒.贴壁加入在-20 ℃冰箱中预冷过的电转杯凹槽中;将电转仪调至1 800 V电转;电转后迅速加入LB液体培养基混匀并转移至无菌的1.5 mL EP管中于摇床振荡培养复苏.将复苏后的菌液涂布于相应抗性的平板上并置于37 ℃培养箱中培养.
(4)菌株培养.挑取无抗LB平板上生产番茄红素菌株的单克隆,接种于无抗LB液体中,置于37 ℃摇床过夜培养;将过夜培养的菌液作为种子液,测定其OD600值,以起始OD600=0.01为标准计算所需种子液体积,将相应体积的种子液接种于分装在24深孔板和50 mL摇瓶中的无菌和相应抗性LB液体中,摇床振荡培养24 h.
(5)番茄红素的测定.取一定量发酵液,在600 nm处用紫外分光光度计测菌体OD600.取300 μL发酵液转移至1.5 mL EP管中,离心弃上清,加入900 μL丙酮,重悬细胞;置于55 ℃水浴中30 min;离心取上清,此时番茄红素溶解于萃取所得的上清丙酮中.在474 nm处测定上清的吸光度,从而计算番茄红素质量浓度.实验中采用吸光光度法测定番茄红素的质量浓度.根据朗伯-比耳定律,
A=εbc,
式中,A为吸光度;ε为光被吸收的比例系数;b为比色皿的透光厚度.在实验中b=1 cm,c为溶液质量浓度.以丙酮标定零点,测定番茄红素在474 nm处吸光度随溶液质量浓度变化的标准曲线,求得ε=0.299 L·mg-1·cm-1.利用此标准曲线,测定萃取所得上清在474 nm处的吸光度,即可计算得番茄红素质量浓度,如式(1)所示:
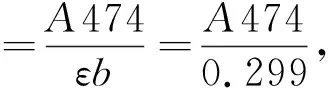
(1)
2 结果与讨论
2.1 初始菌株的优化
基于外源导入的crtEIB基因是合成番茄红素的关键基因,为了考察crtEIB拷贝数对于番茄红素产量的影响,将利用初始菌lyc001基因组PCR得到M1-37-crtEIB表达模块,并基于CRISPR/Cas9重组系统将该表达模块同源重组到lyc001基因组smf位点上,以增加crtEIB的拷贝数,得到一株新的菌命名为lyc011如图3所示.
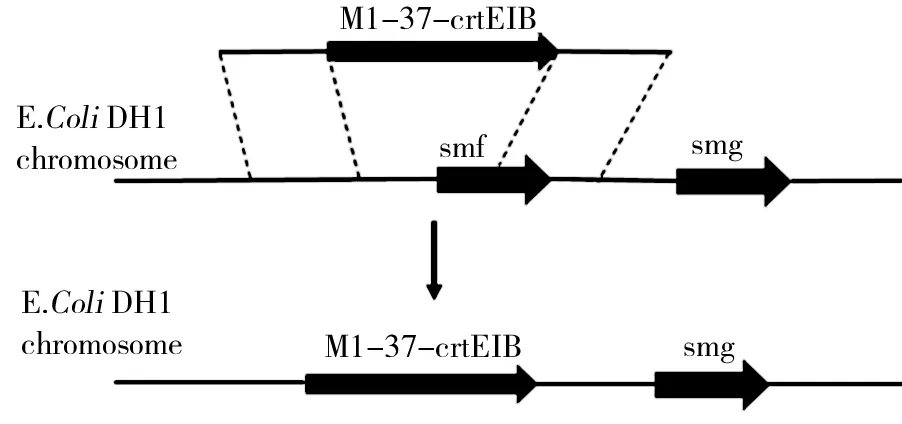
图3 smf位点增加crtEIB基因拷贝数
发酵24 h后lyc001和lyc011番茄红素产量的对比如图4所示.由图4可以看出,lyc011菌体生长与初始菌lyc001相比没有明显变化,说明增加crtEIB的拷贝数不会对菌的代谢产生负担,从而保证菌体的正常生长.而lyc011的单位干重产量相对于lyc001却提高了约34%,结合菌体生长情况可以表明番茄红素的增加不是因为菌浓减少而增加,而是番茄红素本身产量的增加.说明在初始菌lyc001基因组smf位点增加crtEIB基因簇拷贝数确实可以提高番茄红素产量,其原因可能是在产番茄红素的MEP途径中由于增加crtEIB基因拷贝数从而增加了前体物质FPP的利用,增加了番茄红素合成途径的通量,进而增加了番茄红素产量.因此在后续工作中将利用lyc011作为初始菌,进行磷酸水解酶基因的筛选及功能验证.
2.2 验证CRISPRi系统有效性
通过生物信息学筛选到的57个磷酸水解酶基因由于基因数目较多,需要选择效率更高耗时更短操作更简便的方法.结合实验室已有的方法,最终选择CRISPRi来抑制57个磷酸水解酶基因表达.在抑制这些磷酸水解酶基因表达前,先考察CRISPRi系统有效性.实验选择了番茄红素合成途径中的关键基因crtE作为验证目标,理论上抑制该基因的表达可以降低番茄红素的产量.在构建pTargrtF质粒过程中,由于sgRNA存在活性差异,为了保证CRISPRi的有效性,以提供可靠的基因表达量下调筛选平台,设计了同时表达两个sgRNA的质粒. CRISPRi系统的同源重组操作流程如图2所示.
含有CRISPRi系统的菌构建成功后,通过50 mL摇瓶发酵表征后其结果如图5所示.lyc011是对照组,lyc011-crtE1-crtE2为实验组,即通过CRISPRi系统抑制crtE基因表达.由图5可知,当抑制crtE基因表达后番茄红素产量相较于对照组有了明显的减少.这是因为质粒dCas表达的核酸内切酶dCas9与质粒pTargetF表达的双N20特异性sgRNA结合,这种双sgRNA质粒可以转录出两条含有不同N20的RNA,它们的保守区域与核酸酶dCas9蛋白结合,而非保守区域可以分别与crtE基因目标序列特异性结合,介导dCas9蛋白阻挡目标基因crtE的转录,从而起到抑制或下调该基因的表达,降低了番茄红素合成途径中的通量,进而减少了产物产量.从验证实验可以看出CRISPRi系统确实可以达到抑制基因表达的效果.通过验证CRISPRi系统有效性,让后续实验构建含双sgRNA的pTargrtF质粒有了理论保障.
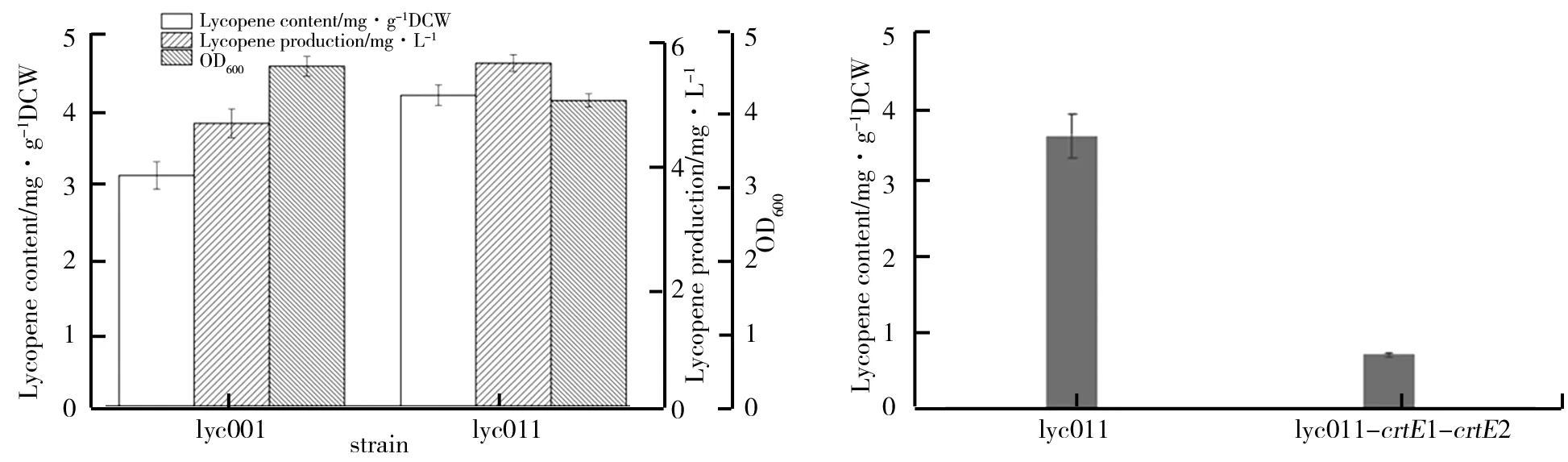
图4 lyc001与lyc011番茄红素产量对比 图5 验证双sgRNA抑制crtE基因表达效果
2.3 筛选影响番茄红素产量的磷酸水解酶基因
通过24深孔板培养57个含CRISPRi系统的菌株生产番茄红素的能力,表征筛选影响番茄红素产量的磷酸水解酶基因.每株菌进行两轮发酵表征,每轮3个生物学平行实验,筛选出菌体生长正常的、去除菌体生长差异较大的菌,取6次培养测定的番茄红素产量平均值.筛选结果显示有15株菌的番茄红素产量相比于对照菌lyc011-rep-NC有提升,分别为lyc011-rep-yjjG,lyc011-rep-aphA,lyc011-rep-nagD,lyc011-rep-yqaB,lyc011-rep-yidA,lyc011-rep-pphA,lyc011-rep-bacA,lyc011-rep-glpQ,lyc011-rep-pgpB,lyc011-rep-spoT,lyc011-rep-cpdB,lyc011-rep-nudJ,lyc011-rep-dgt,lyc011-rep-yahA,lyc011-rep-phoQ.这15株菌孔板培养番茄红素产量平均提高14.3%,其中菌lyc011-rep-cpdB提升最高,番茄红素产量达到4.78 mg/g DCW,相比对照菌lyc011-rep-NC产量提高了26.8%,结果如图6所示.说明抑制磷酸水解酶基因yjjG,aphA,nagD,yqaB,yidA,pphA,bacA,glpQ,pgpB,spoT,cpdB,nudJ,dgt,yahA,phoQ的表达确实可以对番茄红素产量产生正向作用.同时也增加了通过抑制磷酸水解酶基因表达来增加途径中的碳流推断的可能性.
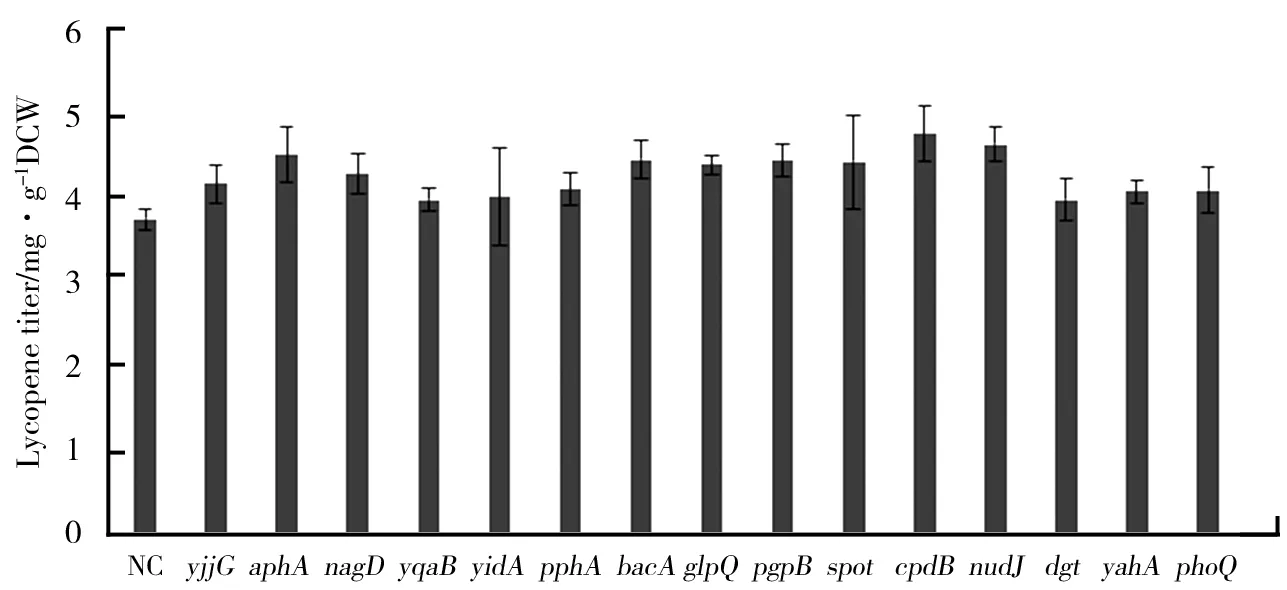
图6 对番茄红素产量具有正向作用的基因表征结果
3 结论
研究选择E.coliDH1作为宿主菌来生产番茄红素,利用番茄红素生物合成作为概念框架来探究酶的底物非特异性对生物体代谢系统的影响.在大肠杆菌MEP途径中具有许多磷酸化的中间代谢产物,而具有底物广谱性的磷酸水解酶可能对这些中间产物具有催化活性.因此,猜测在大肠杆菌染色体上存在一些编码磷酸水解酶的基因,而这些磷酸水解酶能够非特异性地催化MEP途径中的磷酸化合物水解,从而降低途径的碳流,减少目标产物合成.故基本策略为通过对基因组上可能存在的这类磷酸水解酶基因的抑制表达来验证磷酸水解酶基因对番茄红素合成途径中碳流重排的假设.研究是对一系列目标基因进行编辑来优化番茄红素产量.通过增加番茄红素合成关键基因crtEIB拷贝数,对已有生产番茄红素能力的lyc001大肠杆菌工程菌进行改造,以提高番茄红素产量,同时减少后续CRISPRi系统干扰抑制的实验误差.将获得的一株其番茄红素产量较lyc001 初始菌提高了34 %的新菌株命名为lyc011.在lyc011基础上通过研究抑制大肠杆菌MEP途径中具有底物广谱性的磷酸水解酶基因表达来考察番茄红素产量情况.结合实验的需求,选择CRISPRi基因编辑系统来抑制通过生物信息学得到的57个磷酸水解酶基因表达.最终,筛选出15个影响番茄红素产量的磷酸水解酶基因.表征结果表明,抑制yjjG,aphA,nagD,yqaB,yidA,pphA,bacA,glpQ,pgpB,spoT,cpdB,nudJ,dgt,yahA以及phoQ15个磷酸水解酶基因表达,番茄红素产量有了显著提高,分别提高了约11%,20.2%,14.2%,6.1%,7%,9.5%,18.7%,17.2%,18.5%,18%,26.8%,23.6%,6%,8.6%,9.1%.其中菌抑制基因cpdB表达番茄红素产量提升最多,达到4.78 mg/g DCW.在筛选到的这些基因中,pgpB和aphA已被公认会增加磷酸水解酶对FPP的活性,抑制这两个基因表达会减少法尼醇的积累,使途径中碳流流向番茄红素合成途径,从而增加其产量.而使产量增加最多的cpdB则是新发现的与番茄红素合成相关的基因.抑制这些磷酸水解酶基因不仅可以提高番茄红素产量,还可能会提高途径中其他萜类化合物产量如β-类胡萝卜素,这也给研究其他萜类化合物带来一些理论参考.通过抑制这些磷酸水解酶基因来改变途径中碳流流向目标产物合成途径只是研究中的一个猜想,可能会有其他作用待进一步研究.实验结果有助于更深入地理解酶的底物非特异性对于生物体代谢系统的影响,同时阐明通过类似策略解除目标途径和内源代谢的相互作用,在今后代谢工程研究中具有潜在应用价值.
这项工作突出了在用于识别特定表型与相关基因过程中CRISPRi作为一种高通量筛选方法的优势,在下调表达几十甚至上百个突变体时,只需一周左右时间准备即可进行后续的基因筛选,大大减少了时间及人力成本.
