哮喘模型小鼠肺组织 TGF-β1、MMP-9、TIMP-1与气道重塑相关性研究
2018-11-26王忠敏汤卫红王惠庭管敏昌
王忠敏 汤卫红 王惠庭 管敏昌
哮喘是一种以气道高反应性为特征的慢性气道非特异性炎症性疾病[1]。气道炎症反复发生导致基底膜、平滑肌增厚、杯状细胞和纤维组织增生等,即异常气道重塑[2]。参与哮喘气道重塑的细胞因子网络中,转化生长因子-β1(TGF-β1)是研究最深入、最重要的细胞因子[3],相关研究主要包括TGF-β1/Smad信号转导通路、Sonic Hedgehog信号通路等[4-5]。哮喘动物模型研究[6]显示,c-Jun氨基末端激酶(JNK)信号通路下游的信号分子可能与哮喘相关。本课题研究哮喘激发前、激发后第2、4、8周哮喘模型小鼠肺组织 TGF-β1、基质金属蛋白酶 9(MMP-9)、基质金属蛋白酶抑制剂-1(TIMP-1)水平与气道形态学参数的相关性,希望通过对TGF-β1/JNK信号转导通路导致的气道重塑机制进行深入研究,为哮喘的预防和治疗找到新的切入点。
1 材料与方法
1.1 主要试剂及仪器 50%卵蛋白(OVA)(批号20140523,美国Sigma公司);MMP-9试剂盒(批号20140125,美国Santa Cruz公司);TIMP-1 ELISA 试剂盒(批号 20140328,上海晶美公司);TGF-β1试剂盒(批号20140321,美国R&D公司)。美国BIO-TEK酶标仪(型号:synergyh1)购自山东龙美生物医学科技有限公司。BI-2000医学图像分析系统(型号:CT2-BI-200)购自成都泰盟科技有限公司。
1.2 实验动物及分组 清洁级健康雄性C57BL/6J小鼠 40 只,4~7 周龄,体质量(17.56±1.89)g,购自中国军事科学院实验动物中心,实验动物合格证号∶SCXK(京)20140008。所有动物均符合实验动物伦理学规范要求。动物饲养条件和环境:全部小鼠可自由饮水和进食,动物饲养室保持温度20℃~23℃,湿度35%~55%,昼夜循环为 12h/12h(8∶00am~8∶00pm),动物笼具及饮食器具每周进行清洗和定期消毒。40只小鼠随机分为激发前组、第2周组、第4周组和第8周组,每组10只。
1.3 动物模型复制 所有C57BL/6J小鼠均予50%卵蛋白1mL[含OVA 0.5mg和Al(OH)3(氢氧化铝)50mg]腹腔内注射5天,第2、4、8周组分别予2.5%卵蛋白生理盐水溶液超声雾化激发哮喘,每周3次,每次30min,连续2、4、8周。小鼠表现为烦躁不安、搔痒、喘鸣、腹肌抽搐等症状,继而俯伏不动,出现呼吸急促,呼吸困难,部分可闻及响亮的呼气相喘鸣音,重者可出现呼吸不规则,反复激发后小鼠毛色失去光泽,精神不振和反应迟钝,表示造模成功[7]。
1.4 肺组织标本制备[8]激发前和激发后第2、4、8周记录各组小鼠呼吸频率。第2、4、8周组小鼠均造模成功,分别于超声雾化抗原激发开始第2、4、8周提取肺组织标本。标本制备:采用1%戊巴比妥钠腹腔麻醉(40mg/kg),开胸,取新鲜左肺组织提取mRNA和总蛋白,备Real time RT-PCR和Western blot检测;剩余右肺支气管肺组织应用4%多聚甲醛行支气管灌注固定,石蜡包埋,切片4μm,HE染色光镜常规观察、测量细支气管管径和管壁厚度。
1.5 蛋白质纯化和免疫印迹(Western blot)检测[9]采用 Western blot检测 TGF-β、1MMP-9、TIMP-1 分子的蛋白质水平,应用一步法提取总蛋白,Bradford法测定蛋白浓度,统一蛋白浓度后,分装-80℃保存。取50μg总蛋白上样进行SDS-PAGE电泳,通过电转移法将蛋白质从聚丙烯酰胺凝胶转移至硝酸纤维素膜上,封闭、结合一抗、二抗,最后以ECL显影。用NIH Scion Image软件半定量分析蛋白质表达量。每组均重复2次。RT-PCR引物序列:TGF-β1上游引物:5’-CGGCAGCTGTACATTGACTT-3’;下游引物:5’-TCAGCTGCACTTGCAGGAGC-3’;MMP-9 引物序列:上游5'-TTGACAGCGACAAGAAGTGG-3';下游 5'-GGCACAGTAGTGGCCGTAG-3';TIMP-1 引物序列:上游:5'-TTCCACAGGTCCCACAAC-3',下游:5'-CGTCCACAAGCAATGAGT-3'。
1.6 气道形态学变化测量[10]HE染色后,光镜观察(观察倍数10×40):取5个完整的支气管横断面,且气管最小径/最大径≥0.5,应用图像分析软件测定支气管基底膜周径(μm)、上皮黏膜层面积(μm2)、平滑肌面积(μm2)、气管内壁面积(μm2),并用支气管基底膜周径标准化,分别以上皮黏膜层面积/支气管基底膜周径、平滑肌面积/支气管基底膜周径、气管内壁面积/支气管基底膜周径衡量气道重塑的程度。
1.7 统计学方法 应用SPSS22.0统计软件进行分析,计量资料以均数±标准差(±s) 表示,多组间比较采用单因素方差分析(One-Way ANOVA),均数两两比较采用LSD法;两变量相关分析采用直线相关法,以P<0.05为差异有统计学意义。
2 结果
2.1 不同激发时间小鼠肺组织TGF-β1及MMP-9、TIMP-1比较 不同激发时间小鼠肺组织TGF-β1及MMP-9、TIMP-1差异有统计学意义,激发第8周组显著高于激发前组和激发后第2、4周组(P均<0.01),见表1。
2.2 不同激发时间小鼠肺组织气道形态学参数比较
不同激发时间小鼠肺组织上皮黏膜层面积/支气管基底膜周径、平滑肌面积/支气管基底膜周径、气管内壁面积/支气管基底膜周径差异有统计学意义,激发第8周显著高于激发前组和激发后第2、4周组(P均<0.01),见表 2。
2.3 不同激发时间小鼠肺组织TGF-β1与MMP-9、TIMP-1与气道形态学参数相关性 气道形态学参数(上皮黏膜层面积/支气管基底膜周径、平滑肌面积/支气管基底膜周径、气管内壁面积/支气管基底膜周径)与肺组织TGF-β1与MMP-9、TIMP-1水平呈正相关(r=0.95、0.94、0.93;r=0.97、0.96、0.99;r=0.94、0.92、0.96,P<0.01)。
3 讨论
气道炎症和气道重塑是目前哮喘公认的两个主要特征[10]。反复接触变应原刺激诱发支气管哮喘急性发作及炎性因子的分泌及气道重塑[11]。气道重塑是哮喘慢性化、持续化、严重化的病理基础[12-13]。气道重塑主要涉及到构成气道壁的细胞结构、成分及功能的改变,进而导致气道结构的不完全可逆性改变,为哮喘的临床治疗带来困难[14]。
表1 不同激发时间小鼠肺组织TGF-β1及MMP-9、TIMP-1比较(±s)
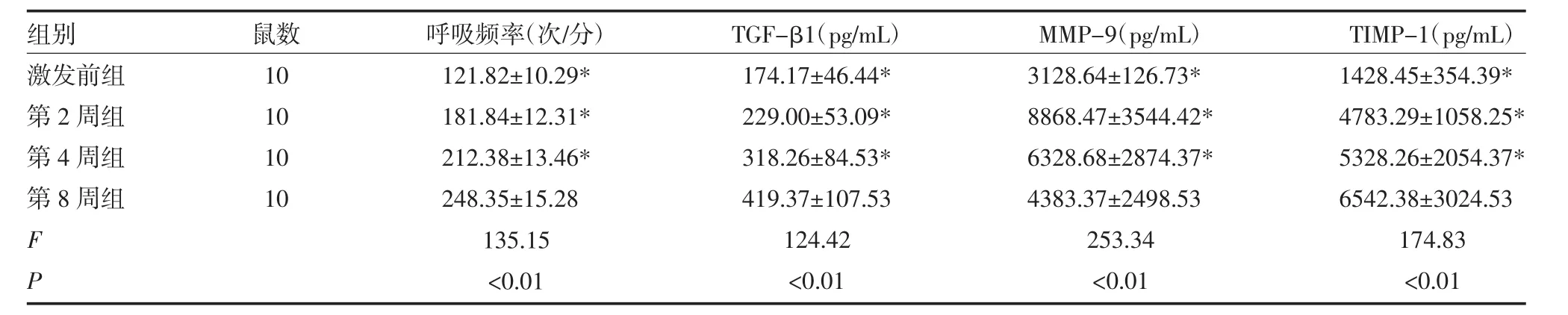
表1 不同激发时间小鼠肺组织TGF-β1及MMP-9、TIMP-1比较(±s)
注:与第8周比较,*P<0.01;TGF-β1:转化生长因子-β;MMP-9:基质金属蛋白酶-9;TIMP-1:基质金属蛋白酶抑制剂-1
组别激发前组第2周组第4周组第8周组鼠数10 10 10 10 F P呼吸频率(次/分)121.82±10.29*181.84±12.31*212.38±13.46*248.35±15.28 135.15<0.01 TGF-β1(pg/mL)174.17±46.44*229.00±53.09*318.26±84.53*419.37±107.53 124.42<0.01 MMP-9(pg/mL)3128.64±126.73*8868.47±3544.42*6328.68±2874.37*4383.37±2498.53 253.34<0.01 TIMP-1(pg/mL)1428.45±354.39*4783.29±1058.25*5328.26±2054.37*6542.38±3024.53 174.83<0.01
表2 不同激发时间小鼠肺组织气道形态学参数比较(×10-3μm,±s)

表2 不同激发时间小鼠肺组织气道形态学参数比较(×10-3μm,±s)
注:与第 8 周比较,*P<0.01
组别激发前组第2周组第4周组第8周组鼠数10 10 10 10上皮黏膜层面积/支气管基底膜周径10.10±2.77*24.90±3.35*37.00±4.88*F P 45.00±5.88 6.25<0.01平滑肌面积/支气管基底膜周径7.30±1.89*17.00±2.58*31.60±4.20*48.60±5.20 4.31<0.01气管内壁面积/支气管基底膜周径15.10±2.81*28.20±5.18*37.10±8.82*53.10±11.82 11.09<0.01
气道重塑具体发生机制尚不明确。传统观点认为,TGF-β1是一种能够导致气道重塑的重要介质,通过调节炎症细胞的表达及细胞因子的分泌,从而促进血管生成、胶原合成、基质沉积平滑肌细胞迁移及增生等多种途径参与哮喘的发病进程[15-16]。TGF-β1的表达水平增高还参与上皮下的纤维化和病理性的组织重构[17]。研究[18-19]证实,TGF-β1在哮喘患者气道上皮及黏膜下明显增多,且其表达与气道基底膜厚度、成纤维细胞数目和或哮喘发作的严重程度呈正相关。
MMPs是哮喘气道重塑的重要致病因素,其中MMP-2和MMP-9与哮喘的关系最为重要[20]。哮喘伴随着细胞外基质的降解和胶原的沉积,胶原的内环境稳定决定于MMPs及其抑制物——TIMPs的平衡。周华斐等[8]发现,哮喘组大鼠中性粒细胞基质金属蛋白酶9和血清基质金属蛋白酶抑制剂-1的表达均高于正常对照组(P<0.01);张维溪等[19]进一步发现,哮喘组大鼠支气管壁厚度、平滑肌厚度均显著高于对照组。本研究发现,随着激发时间延长,肺组织TGF-β1显著增高,MMP-9水显著减少,而TIMPs显著增高(P<0.01);气道形态学参数与哮喘小鼠肺组织 TGF-β1、MMP-9和 TIMPs水平呈正相关(P<0.01)。提示哮喘气道重塑与肺组织MMP-9和TIMPs表达水平可能存在正相关。
综上所述,小鼠气道重塑的存在可能是由于肺组织TGF-β1、MMP-9和TIMP-1的过度表达引起,但是哮喘气道重塑是一个多介质、多因子参与的复杂的病理生理过程,其具体机制还有待于进一步深入研究。
