二氧化硅介孔微球的制备、孔结构表征及其载药性能研究*
2018-11-15
(泰山医学院,山东 泰安 271016)
组合化学和高通量筛选技术的发展为制药行业提供了大量的先导化合物,但其中有很多化合物因溶解度低和溶解速度慢而难以应用。将药物纳米化可以提高其扩散面积从而提高溶出速度;将药物用高分子材料(如聚乙烯吡咯烷酮和聚乙二醇等)制备固体分散体也可以提高其溶解度和溶出速度,但存在物理稳定性差等问题。除此之外,介孔材料的纳米孔内也可以负载药物,药物结晶受到刚性纳米孔的限制而不能生长,不仅可以使药物纳米化,而且也可借助介孔材料的巨大比表面积而实现药物的快速释放[1],其中,介孔二氧化硅,如MCM41和SBA-15等,因物理化学性质稳定,无明显的毒性且成本较低等原因而被广泛研究[2-3]
用于负载药物的介孔材料应该具有较大的孔容,以便提高载药量;最好还应该具有合适的孔径,例如负载大分子药物时就需要更大孔径的介孔材料。但目前常见的介孔二氧化硅的平均孔径一般不大于6 nm[4]。采用硅烷水解法并用高分子胶束作为致孔剂来制备介孔硅胶可以增大孔径;也有研究报导以水玻璃作为基本原料,以表面活性剂胶束作为模版来制备孔径较大的介孔硅胶[5],但总体来说,大规模制备具有较大孔径的介孔硅胶微球仍然有很多困难。
本研究拟用水玻璃作为基本原料,以乳化-固化的方法制备介孔二氧化硅微球,拟通过在水玻璃中加入水溶性物质来改变所得微球的孔径,从而获得具有较大孔径和孔容的介孔二氧化硅微球,并以难溶性药物布洛芬作为模型药物,研究这些介孔微球的药物释放性质。
1 仪器与试剂
1.1仪器
高速剪切乳化仪(DIAX900Heidoplph仪器);高效液相色谱仪(UV230Ⅱ,大连依利特分析仪器有限公司);溶出仪(ZRS-8G,天津市天大天发科技有限公司);表面特性分析仪(Micromeritics 3Flex,Micromeritics公司);扫描电子显微镜(Hitachi-S4800, 日立公司)。
1.2药品与试剂
布洛芬(98%,武汉百科药物开发有限公司);水玻璃(3.3模,临沂市兰山区绿森化工有限公司);碳酸氢铵(AR,天津市瑞金特化学品有限公司);吐温-80,司盘-80(CP,天津市大茂化学试剂厂);聚乙二醇(CP,天津科密欧化学试剂开发中心);海藻酸钠(CP,天津市大茂化学试剂厂);十二烷基硫酸钠(AR,天津迪博化工股份有限公司);甲醇(色谱纯,天津市康科德科技有限公司);石油醚(AR,天津市康科德科技有限公司);无水乙醇,磷酸(AR,天津市永大化学试剂有限公司。
2 实验方法
2.1二氧化硅微球的制备
取水玻璃和致孔剂溶液共10 g搅拌均匀后加入5%司盘石油醚溶液20 ml,振摇并用高速剪切乳化仪10000 rpm乳化3 min,得到油包水(w/o)型乳液。将乳液一次性倒入150 ml浓度为15.8%(w/w)的碳酸氢铵溶液中,磁力搅拌固化1 h。之后4000 r/min离心3 min取沉淀。乙醇、水交替洗涤两遍,60 ℃干燥12 h即得二氧化硅微球。
2.2二氧化硅微球的孔径调控
本试验拟通过改变致孔剂溶液的种类和加入比例,来改变介孔微球的孔结构。为此,本实验选取十二烷基硫酸钠(SDS),聚乙二醇(PEG),蔗糖以及海藻酸钠溶液作为致孔剂,分别与水玻璃以一定质量比混合,再按照3.1所示方法来制备微球,考察致孔剂种类对微球多孔性的影响。
2.3介孔微球的表征
介孔微球首先在光学显微镜下观察形貌。微球的多孔性用表面特性分析仪通过测定样品的氮气吸附特性来表征。测试前,样品在60℃下脱气15 min除去吸附水。比表面积根据Brunauer-Emmett-Teller (BET)方法测定;孔径分布用BJH方法来确定;孔容通过测定0.99的相对压力条件下的氮气吸附量来确定。微球的表面形貌细节通过扫描电子显微镜(SEM)进行表征。
2.4介孔微球的载药方法
称取布洛芬(IBP)0.412 g加入无水乙醇至2.5 g,摇匀使其溶解。在上述布洛芬溶液中加入0.6 g干燥的介孔微球,超声并振摇5 min使布洛芬溶液充分浸渍入微球的孔内,4000 rpm离心2 min,弃去多余的布洛芬溶液,将底层白色固体置于蒸发皿中,通风处放置12 h,挥干乙醇,即得到载药微球。
2.5载药微球的表征
2.5.1布洛芬浓度测定方法 布洛芬浓度采用高效液相色谱法测定, 选用C18键合硅胶填充柱(依利特SinoChrom ODS-BP,200×4.6 mm),以磷酸溶液(1 g磷酸稀释至350 g超纯水) -甲醇(3∶7)为流动相,流速1.0 ml/min,进样量20 μl,检测波长220 nm。
用无水乙醇配制浓度为1.52 μg/ml、 7.624 μg/ml、15.2 μg/ml、38.12 μg/ml、381.2 μg/ml的布洛芬标准溶液,测定其峰面积,以峰面积(x)为横坐标,浓度(y,μg/ml)为纵坐标,回归得到布洛芬标准曲线:y= 0.00003237x-0.4448 (r2 = 0.9998,n=3).
2.5.2微球载药量的测定 称取200 mg载药微球,加入500 ml乙醇,室温搅拌4 h,取样5 ml,用0.22 μm微孔滤膜滤过,取续滤液按照3.5.1方法测定布洛芬浓度。载药量%=(微球中布洛芬的质量/载药微球的总重)×100 %。
2.5.3溶出速度测定 溶出速度的测定参照药典方法。在溶出杯中加入500 ml 1.0 %的吐温溶液,待温度稳定至37 ℃后,精密称取180 mg载药微球加入溶出杯中,搅拌浆转速设为100 rpm。分别在5 min、15 min、30 min、45 min、60 min、90 min、120 min、180 min、240 min取样5 ml,用0.22 μm微孔滤膜滤过,取续滤液2 ml,按3.5.1方法测定布洛芬浓度,计算布洛芬累积释放率,绘制溶出曲线。同时,另取35 mg 布洛芬原料药同法测定。
3 结果与讨论
3.1二氧化硅微球的制备与表征
二氧化硅微球的生成机理为:水玻璃溶液首先以乳滴的状态分散于石油醚中形成w/o型乳液,当水玻璃液滴从石油醚中进入碳酸氢铵溶液以后,便固化成二氧化硅微球。但当水玻璃被过分稀释(水玻璃与致孔剂溶液的比例<4∶6时)或致孔剂溶液的浓度过大时,水玻璃将不能在盐溶液中快速固化,造成微球的球形度不好。另外,当选用水玻璃作为基本原料时,致孔剂也不应选用具有明显酸碱性的物质,否则会引起水玻璃的胶凝而无法混匀。因此,本试验将水玻璃与致孔剂溶液的质量比固定为4∶6,在保证球形度良好的前提下,尽可能提高致孔剂的浓度,测试了不同种类的致孔剂对微球孔结构的影响,实验结果见表1。

表1 不同致孔剂所得微球的比表面积、平均孔径和孔容 (水玻璃与致孔剂溶液按4∶6质量比混合)
由表1可见,加入致孔剂后,所得微球的表面积均有所增大,而平均孔径和孔容也发生了变化。各种致孔剂所得的微球比表面积均在600~700 m2/g,可见致孔剂种类对比表面积影响不大。但是,微球的平均孔径和孔容剂却随致孔剂种类的不同而变化显著。其中,以50%蔗糖为致孔剂时,制得微球平均孔径为16.1 nm,孔容为1.68 ml/g,分别是不加致孔剂时的3.3倍和2.3倍;在其扫描电镜图上(图1),多孔结构清晰可见,球形也十分圆整。孔径的增大有利于负载分子量更大的药物,而孔容的增大则有助于提高载药量。因此,本实验最终选取孔径和孔容较大的7号处方所制备的微球作为基质进行药物负载实验。

图1 以蔗糖作为致孔剂制备的介孔二氧化硅微球 的表面形貌
3.2微球载药量及溶出速度
按照3.4方法将布洛芬载入7号处方所制微球中,假设微球的全部孔容(1.68 ml/g)都被布洛芬溶液浸渍,则1 g微球中理论上可载入约0.23 g布洛芬,据此推算布洛芬理论载药量应为18.7%。按照3.5.2方法实际测定微球载药量为(19.5±1.1)%(n=3),这与理论结果基本吻合。实际上,若浸渍时所用的布洛芬溶液浓度增加,微球的载药量也会随之线性增加,直至所有的纳米孔被布洛芬晶体填满为止。
在溶出曲线中可以看出(图2),布洛芬载药微球5 min即可实现89%的药物释放,而原料药达到这一累计释放度则需要150 min。溶出速度加快的原因主要是由于微球的纳米孔减小了药物微粒的粒径,增加了药物的表面积。
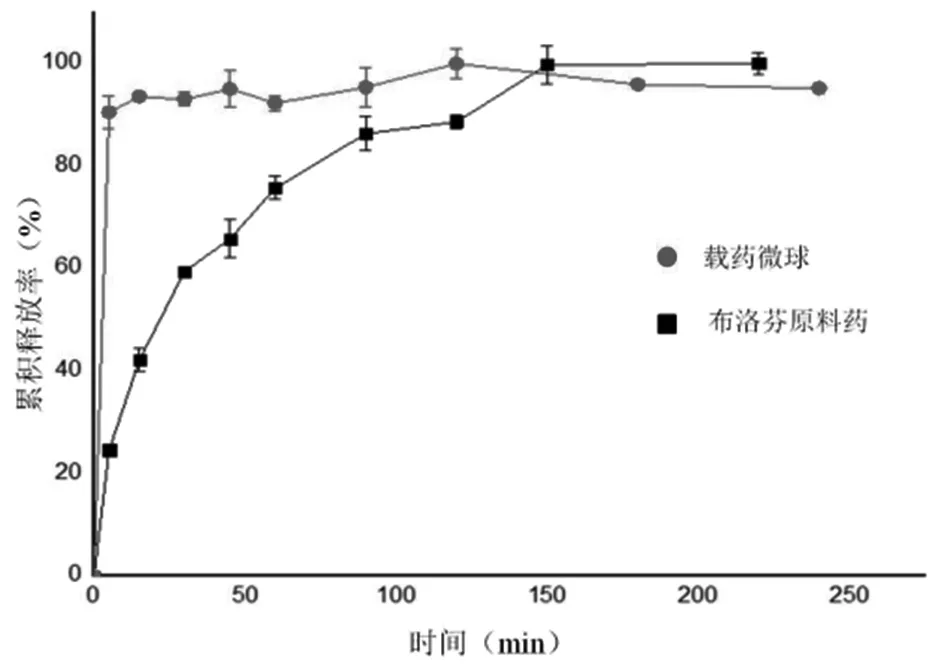
图2 原料药与载药微球中布洛芬的溶出曲线
本研究用乳化-固化的方法制备了二氧化硅磁性微球,并通过在原料水玻璃中加入不同致孔剂来改变介孔微球的孔径和孔容,其中以50%蔗糖溶液为致孔剂所制得的介孔微球平均孔径为16.1 nm,孔容为1.68 ml/g,适合作为药物载体。用浸渍法将布洛芬载入微球后,可显著提高其药物溶出速度。该微球制备方法简单,成本较低,在口服和皮肤给药制剂中,可用于提高难溶性药物的溶出速度并最终提高其生物利用度。
