致孔剂用量对苯乙烯悬浮聚合微球粒径和密度的影响*
2015-06-09来进贤孙彦琳何艳萍肖小琴
来进贤,孙彦琳**,何艳萍,王 红,肖小琴,赵 晔
(1.昆明理工大学 化学工程学院,云南 昆明 650500;2.昆明理工大学 理学院,云南 昆明 650500)
聚合物微球的制备方法主要有乳液聚合(包括种子聚合、细乳液聚合、微乳聚合、无皂乳液聚合、膜乳液聚合等)、悬浮聚合、分散聚合、沉淀聚合、微流体聚合、模板合成、自组装合成等[1-4],制备中空或多孔聚合物微球的方法可以大致分成2类,一是先制备核壳结构微球,再移除核得到聚合物中空或多孔型微球;二是通过原位聚合实现聚合物对致孔剂例如气体、水或烃的包覆,将含有致孔剂的微球通过一定的条件开孔,如萃取、透析、酸腐蚀、喷雾干燥、真空干燥等,得到中空或多孔型微球[5-11],研究重点多以粒径的单分散性、比表面积、微孔结构、渗透性、微观形貌等性能为主,而微球的密度性能很少被关注。
悬浮聚合法制备聚合物微球时,聚合物微球的粒径主要受剪切力和胶体保护剂用量2个因素的影响,课题组用悬浮聚合法制备包含有致孔剂聚合物微球,并运用课题专利技术进行开孔和封闭,进一步制备低密度无渗透性中空聚合物微球,研究发现,聚合物微球的粒径不仅与剪切力和胶体保护剂用量有关,还与致孔剂用量有关,同时聚合物微球的密度性能也与致孔剂含量有关。作者主要讨论在转速和胶体保护剂用量一定的情况下,致孔剂用量对聚合物粒径和密度的影响。
1 实验部分
1.1 试剂与仪器
苯乙烯(St):化学纯,国药集团化学试剂有限公司;偶氮二异丁腈(AIBN):化学纯,上海试四赫维化工有限公司;二乙烯苯(DVB):分析纯,上海晶纯生化科技股份有限公司;正庚烷:分析纯,汕头市西陇化工厂;聚乙烯醇(PVA):1788型,上海晶纯生化科技股份有限公司;蒸馏水:自制。
1L玻璃反应釜:上海申顺生物科技有限公司;2L恒温水浴锅:上海予华仪器设备有限公司;徕卡 DM4000 BLED显微镜:徕卡仪器德国有限公司;电子天平:FA-2004,上海瞬宇恒科学仪器有限公司;标准试验筛:符合国家标准GB/T 6003.1—2012,浙江华丰五金仪器有限公司。
1.2 聚合工艺
将聚乙烯醇配成一定浓度的水相溶液,用分析天平称取用碱液洗出的St单体和致孔剂,称取引发剂加入到St单体中至完全溶解。将配好的油相、水相以及致孔剂一同加入反应釜中,边搅拌边通入氮气,30 min后升温至72 ℃,反应8 h,冷却降至常温,用D65 mm布氏漏斗过滤,再用水和乙醇洗涤,放置烘箱40 ℃干燥24 h。具体实验配方见表1。

表1 实验配方
1.3 测试和表征
1.3.1 粒径分布以及平均粒径
实验制备的聚苯乙烯微球粒径分布为几百微米到几千微米,超出仪器分析范围,故使用分样筛做粒径统计分布。称取一定量样品,总质量为m,按照粒径依次由大到小的顺序(1,2,3……i-1,i……)用孔径为2、1.6、1.25、0.9、0.6和0.45 mm的分样筛过滤,称取被截留在每个分样筛上微球质量mi即为筛余量,筛余量占微球总质量的百分比为筛余量质量分数,记为xi,xi=mi/m,用筛余量质量分数统计粒径分布。
第i号筛网上平均粒径di是该分样筛(Di)和上层分样筛(Di-1)孔径算术平均粒径,即di= (Di-1+Di)/ 2,聚合物微球的平均粒径d为:
1.3.2 理论密度计算
理论计算假设:单体均未挥发,且全部反应,致孔剂被全部包覆在每个微球内,得到含致孔剂微球理论密度。

式中:m(St)为St质量;m(致孔剂)为正庚烷质量;m(交联剂)为二乙烯苯质量;ρ(ps)为聚苯乙烯密度;ρ(致孔剂)为正庚烷密度;ρ(交联剂)为二乙烯苯密度。
1.3.3 实际密度的测量
称量滴定管质量m0;将一定质量干燥的聚合物微球放入滴定管中,称量管+球质量记为ms;在滴定管中加入浸液,浸没微球上表面,记下刻度,称量管+球+液质量记为msl;取出滴定管中的微球和浸液,将同种浸液加入此滴定管至相同刻度,称量管+液质量记为ml。得到含致孔剂微球实测密度。

1.3.4 Leica电子显微镜对粒径的表征
采用德国徕卡电子显微镜表征粒径,选取不同粒径的微球在相同的放大倍数下测量其粒径;选取包含致孔剂和不包含致孔剂的微球在显微镜下对比分析。
1.3.5 微球的漂浮率测试
将干燥的质量为m的聚合物微球放在蒸馏水中浸泡72 h,滤出上层的微球,干燥称量质量为m1,漂浮率为上层微球质量m1占总微球的质量m的质量分数。微球的漂浮率也能在一定程度上反映聚合物微球的密度和致孔剂包裹情况,见下式。
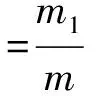
2 结果与讨论
悬浮聚合是利用剪切力将油相分散成小液滴。聚合反应在每一个小液滴内进行。一般情况下,悬浮聚合反应中形成的初始液滴主要由转速和胶体保护剂用量所决定,此外油水比对初始液滴也有一定的影响。实验研究致孔剂对聚合物粒径和密度的影响,致孔剂的作用就是使聚合物微球内部发生相分离,相分离的过程中致孔剂同时存在向微球内部迁移和向微球外部迁移2种情况。相分离的难易程度不但与致孔剂的种类有关,还与致孔剂的含量有关,正庚烷是St单体的良性溶剂,是聚苯乙烯聚合物的非良性溶剂,其用量对聚合过程产生以下影响。一是影响相分离时间,正庚烷越多,对苯乙烯-聚苯乙烯相溶性越好,相分离时间持续越长,导致致孔剂的挥发和致孔剂的迁移时间也就越长,聚合物对致孔剂的包裹不利;二是影响聚苯乙烯壳层,正庚烷越多,增加了对微球壳层的溶胀度,溶胀使得微球壳层变薄、变软,在后期聚合固化过程中容易形变和破损[9],也不利于致孔剂的有效包裹;三是正庚烷既是油相溶剂,同时又作为致孔剂,在其它条件不变的情况下,致孔剂含量越高,形成的初始液滴也越大。实际上,最终微球的粒径只与液滴内St的含量和有效包裹的致孔剂含量有关。
2.1 V(致孔剂)∶V(St)对粒径分布的影响
对聚合物微球做粒径统计分布,统计筛余量质量分数超过70%的粒径分布区间,结果见表2。

表2 筛余量质量百分数超过70%粒径分布
由表2可见,V(致孔剂)∶V(St)=0.40~1.0时,随着致孔剂含量的增加,粒径分布反而减小。主要原因是一方面致孔剂含量越多,每个初始液滴中致孔剂含量越多,St含量越少,然而致孔剂在聚合过程中大部分被损失,这是因为致孔剂越多,对苯乙烯-聚苯乙烯体系溶解性增加,相分离变得更加困难,同时相分离时间越长伴随着致孔剂的挥发损失也就越多。相分离过程中致孔剂向微球外部迁移的速度大于向内部迁移的速度,也造成初始液滴减小,挥发时间越久和迁移时间越久都导致有效包裹的致孔剂含量越低,最终只有有效包裹在初始液滴内部的致孔剂和St聚合成微球。致孔剂用量虽然很多,但是有效包裹却很少,最终成球粒径也很小;另一方面,随着致孔剂用量的增加,致孔剂对聚合物微球表面壳层的溶胀度增加,在后期固化过程中容易形变和破损,破损导致粒径减小。当V(致孔剂)∶V(St)=1.0时,致孔剂对微球的溶胀度增加,微球壳层变薄、变脆,出现了破损和形变。
V(致孔剂)∶V(St)=0.20时粒径分布小于V(致孔剂)∶V(St)=0.40时的粒径分布,这是由于V(致孔剂)∶V(St)=0.40的液滴较大,虽然在后期发生相分离和挥发损失了一部分致孔剂,但是最终成球粒径仍然大于V(致孔剂)∶V(St)=0.20的微球粒径。
致孔剂含量为0和V(致孔剂)∶V(St)=0.60时微球粒径分布相近,这是因为V(致孔剂)∶V(St)=0.60时初始液滴较大,但是致孔剂在成球过程中大部分损失,最终虽然粒径分布相近,但是2种微球在外观形态和密度上均有差异。
包含了致孔剂的聚合物微球的部分产物在显微镜下放大25倍拍摄的图片见图1和图2,从图中可以看出,包含了致孔剂的微球呈乳白色,透光性差。对比了包含致孔剂的微球与不含致孔剂的微球,见图3,不包含致孔剂微球外观透明,在显微镜下有光圈,这是因为微球对光线发生了聚焦作用。乳白色微球密度低、透光性差,因为包含了致孔剂在内的聚苯乙烯微球是非均相材质的微球;透光性好的聚苯乙烯微球没有包含致孔剂,是均相材质的微球。实验制备的聚合物粒径分布大约在200~2 200 μm。


图1 粒径小于1 000 μm的微球在显微镜下的照片


图2 粒径大于1 000 μm的微球在显微镜下的照片


图3 包含致孔剂微球和不包含致孔剂微球在显微镜下的照片
2.2 V(致孔剂)∶V(St)对微球密度的影响
不同V(致孔剂)∶V(St)对微球密度的影响见图4。理论密度是单体和致孔剂无其它损耗,致孔剂被全部、均匀的包裹在聚苯乙烯微球内的微球平均密度;实际密度是实验实际测量得到的密度。

V(致孔剂)∶V(St)图4 不同V(致孔剂)∶V(St)对微球密度的影响
结合实测密度和粒径分布,在包裹了致孔剂的微球中,V(致孔剂)∶V(St)=1.0制备的微球实测密度最大为0.982 0 g/cm3,粒径分布表明粒径很小。其原因是致孔剂含量过高导致大部分球体破损,包裹的致孔剂因为球体破损而损失,这是密度变大的主要原因。另一方面致孔剂含量越多,相分离时间更长,并伴随致孔剂挥发的损失也更多,导致实际包裹量大幅度降低。当V(致孔剂)∶V(St)=0.80时制备的微球实测密度最低,仅为0.899 8 g/cm3。
当V(致孔剂)∶V(St)=0.60时制备的微球密度高于V(致孔剂)∶V(St)=0.40制备的微球,这是因为致孔剂初期含量虽然较多,但是随着含量的增加,致孔剂所引起的相分离迁移损失和挥发损失也就越多,最终有效包裹在微球里的致孔剂反而会降低。
当V(致孔剂)∶V(St)=0.20制备微球实际密度低于理论密度,其原因是,理论密度是微球的平均密度。致孔剂含量低,相分离容易进行,但并不能保证致孔剂的均匀分散,将出现2种极端情况:一种是微球不包裹致孔剂;另一种是微球包裹了较多致孔剂。因此致孔剂含量越少,制备的微球密度差异性可能越大。所以部分微球实际密度低于平均密度,是因为致孔剂不能均匀分布。
2.3 V(致孔剂)∶V(St)对微球粒径和密度的影响
V(致孔剂)∶V(St)对微球平均粒径和密度的影响见图5。

V(致孔剂)∶V(St)图5 V(致孔剂)∶V(St)对聚合物微球平均球粒径和密度的影响
在双坐标图中,从密度图中可以看出V(致孔剂)∶V(St)=0时和V(致孔剂)∶V(St)=0.40时,微球平均粒径相近而密度却相差很大,这是由于一种微球包含致孔剂,另一种微球不包含致孔剂,致孔剂导致了密度的差异性;V(致孔剂)∶V(St)=0.20和V(致孔剂)∶V(St)=0.60的微球粒径相近、而密度不同,这是因为V(致孔剂)∶V(St)=0.60时初始液滴较大,St含量多,致孔剂含量也多,致孔剂的损失也很多,最终微球粒径相近,虽然V(致孔剂)∶V(St)=0.60的微球内包裹了较多致孔剂,但是St含量较多也会导致密度增加;V(致孔剂)∶V(St)=0.80时,初始液滴虽然更大,理论上每个液滴内St比例减小,致孔剂的比例增大。但是在成球阶段大部分的致孔剂损失,最终成球粒径变小,密度也小;当V(致孔剂)∶V(St)=1.0时,大部分微球破损,有效包裹的致孔剂最少,球体破损致孔剂挥发只残留了聚苯乙烯壳层,使得密度最大。
2.4 不同V(致孔剂)∶V(St)下微球的漂浮实验
不同V(致孔剂)∶V(St)所制备微球的漂浮率见图6。

V(致孔剂)∶V(St)图6 不同致孔剂用量所制备微球的漂浮率
由图6可知,V(致孔剂)∶V(St)=1.0制备的微球漂浮率为8.41%,漂浮率最低,说明密度最大,对致孔剂的包裹最差,和实测密度可以得到一致的结论。V(致孔剂)∶V(St)=0.80时制备的微球漂浮率最高,也和实测密度结论一致,V(致孔剂)∶V(St)=0.60和0.40时制备的微球在漂浮率曲线和实测密度曲线有差异。这可能是因为2种表征密度的参照不一样,漂浮率以蒸馏水密度1 g/cm3为标准,密度曲线表现了选取样品中微球的平均密度。另一方面,测密度时取样存在一定的差异性,漂浮率实验是对大量的微球做漂浮实验,更加具有代表性。V(致孔剂)∶V(St)=0.20制备的微球实测密度为0.928 7 g/cm3,仅大于V(致孔剂)∶V(St)=0.80制备的微球,V(致孔剂)∶V(St)=0.20制备的微球漂浮率低,说明微球整体密度高;实测密度低,说明微球部分密度也低。这是因为致孔剂包裹不均匀所致,微球密度有差异,但是致孔剂含量较低,微球整体密度仍然大,漂浮率也可以说明这一点。而V(致孔剂)∶V(St)=0.80制备的微球实测密度低,漂浮率高,这说明致孔剂包裹的均匀。
从漂浮率曲线看出V(致孔剂)∶V(St)= 0.40、0.60、0.80时制备的微球漂浮率均超过65%,基本可以制备低密度微球。其中V(致孔剂)∶V(St)=0.80制备的微球漂浮率超过95%。
3 结 论
采用悬浮聚合法制备了低密度聚合物微球,分别从粒径分布,微观形态,密度以及漂浮实验4个方面对低密度微球和致孔剂含量关系进行研究,结果如下。
致孔剂用量影响聚合物微球的粒径和密度,在实验条件范围内,致孔剂用量过多,导致微球破损、形变,粒径和密度偏小;致孔剂用量过少,致孔剂不能均匀分散,也无法制备低密度聚苯乙烯微球。V(致孔剂)∶V(St)=0.40~0.80时,微球漂浮率超过65%,可以制备低密度聚苯乙烯微球。当V(致孔剂)∶V(St)=0.40时,制备的微球粒径最大,平均粒径>1.6 mm;当V(致孔剂)∶V(St)=0.80时,微球密度最低,为0.899 8 g/cm3,漂浮率最高,为96.29%。
[ 参 考 文 献 ]
[1] Gokmen M T,Du Prez F E.Porous polymer particles-a comprehensive guide to synthesis,characterization,functionalization and applications[J].Progress in Polymer Science,2012,37(3):365-405.
[2] Fu G D,Li G L,Neoh K G,et al.Hollow polymeric nanostructures-synthesis,morphology and function[J].Progress in Polymer Science,2011,36(1):127-167.
[3] 马光辉,苏志国.高分子微球材料[M].北京:化学工业出版社,2005:5-7.
[4] He X D,Ge X W,Wang M Z,et al.The preparation of composite microsphere with hollow core/porous shell structure by self-assembling of latex particles at emulsion droplet interface[J].Journal of Colloid and Interface Science,2006,299(2):791-796.
[5] Makuta T,Tamakawa Y,Endo J.Hollow microspheres fabricated from instant adhesive[J].Materials Letters,2011,65(23):3415-3417.
[6] Sawalha H,Fan Y,Schro⊇n K,et al.Preparation of hollow polylactide microcapsules through premix membrane emulsification-effects of nonsolvent properties[J].Journal of Membrane Science,2008,325(2):665-671.
[7] Takai C,Hotta T,Shiozaki S.Key techniques to control porous microsphere morphology in S/O/W emulsion system[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2011,373:152-157.
[8] Yoo H S.Preparation of biodegradable polymeric hollow microspheres using O/O/W emulsion stabilized by Labrafil.[J].Colloids & Surfaces B Biointerfaces,2006,52(1):47-51.
[9] Liu Q,Huang C,Luo S,et al.Production of micron-sized hollow microspheres by suspension polymerization of St-DEGDA (diethylene glycol diacrylate) with petroleum ether (90-120 °C)[J].Polymer,2007,48(6):1567-1572.
[10] Heiskanen H,Denifl P,Pitkänen P,et al.Effect of concentration and temperature on the properties of the microspheres prepared using an emulsion-solvent extraction process[J].Advanced Powder Technology,2012,23(6):779-786.
[11] Hao D,Gong F,Hu G,et al.The relationship between heterogeneous structures and phase separation in synthesis of uniform PolyDVB microspheres[J].Polymer,2009,50(14):3188-3195.
