炔雌醇环丙孕酮联合吡格列酮治疗PCOS伴2型糖尿病不孕患者的临床效果
2018-09-23刘文枝雷龙涛
张 静 刘文枝 雷龙涛
郑州大学附属郑州中心医院(450007)
多囊卵巢综合征(PCOS)是女性生殖内分泌代谢功能紊乱所致的排卵障碍性妇科疾病,育龄女性为高发[1]。以长期无排卵或稀发排卵、胰岛素抵抗(IR)、高胰岛素血症(HI)、高雄激素血症(HA)、月经紊乱等为主要特征,部分患者还可继发糖尿病、高脂血症等,重则将影响排卵功能而诱发不孕[2]。当合并2型糖尿病(T2DM)时,内分泌代谢紊乱及IR较为明显,而IR作为代谢综合征的核心,成为临床治疗该病的关键[3]。炔雌醇环丙孕酮是临床治疗PCOS的常用药物,能够提高患者的排卵率和妊娠率,但也可导致IR加重而进一步影响脂代谢。临床应用二甲双胍辅助治疗以改善或纠正IR,但效果有限。本研究对PCOS不孕伴T2DM患者采用环丙孕酮联合吡格列酮治疗,获得显著疗效。
1 资料与方法
1.1 一般资料
选取2016年3月—2017年6月在本院就诊的PCOS不孕伴T2DM患者88例作为研究对象。本次研究经医院伦理委员会审核批准,受试者均自愿知情并签署知情同意书。患者按随机数字表法分为观察组与对照组。
1.2 纳入与排除标准
纳入标准:①PCOS诊断符合2003年鹿特丹诊断标准[4],经临床症状、体征及妇科超声检查确诊;②T2DM诊断符合《中国2型糖尿病防治指南(2013年版)》[5]中相关诊断标准,经口服葡萄糖耐量试验(OGTT)确诊;③排除配偶及其他影响因素,夫妻双方未避孕1年以上未成功受孕诊断为不孕症;④年龄20~35岁。排除标准:①其他因素诱发HI者;②合并子宫内膜异位症、子宫畸形、输卵管积水、子宫内膜炎、宫腔粘连等其他妇科疾病者;③合并库欣综合征、甲状腺功能障碍、肝肾功能障碍、影响性激素水平的肿瘤等;④近期接受激素治疗者;⑤初潮时间在近3年内者。
1.3 治疗方法
两组对象在月经周期第3d开始予以炔雌醇环丙孕酮片(每片含2 mg醋酸环丙孕酮和0.035 mg炔雌醇)口服,1片/d,连续服用21d后停药。在撤退性出血第5d开始,对照组予以二甲双胍口服,500 mg/次,3次/d;观察组予以吡格列酮口服,15 mg/次,2次/d。两组连续服用21d后停药,并于下次撤退性出血第5d开始进入第二疗程,治疗3个疗程。第4个周期经期停药撤退性出血时或月经第5d开始予以促排卵,即予以克罗米芬(50~150)mg/d口服,连续服用5d;第10d行B超检查评价卵泡大小,如优势卵泡直径≥18 mm或2个及以上卵泡直径≥16 mm时,则加用人绒毛膜促性腺激素(h CG)肌注,(5000~10000)IU/d,隔日指导患者同房。
1.4 观察指标
治疗前及治疗3个周期后进行临床检查。①一般体格检查:晨起测量患者的身高、体重、腰围与臀围,计算体重指数(BMI,kg/m2);计算腰臀比(WHR)。②代谢指标:晨取空腹静脉血5 ml离心取血清标本置于-20℃冰箱中保存待测。采用日立7600全自动生化分析仪测定糖脂代谢指标,包括高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、甘油三酯(TG)、空腹血糖(FPG)、餐后2h血糖(2h PG)、糖化血红蛋白(Hb Alc);采用电化学发光法测定空腹胰岛素(FINS);采用稳态模型评估法计算胰岛素抵抗指数(HOMA-IR)=(FBG×FINS)/22.5,计算胰岛β细胞功能指数(HOMA-β)=20×FINS/(FPG-3.5)。③激素测定:于月经周期3~7d晨取空腹静脉血5 ml,采用电化学发光法测定血清性激素指标,包括雌二醇(E2)、黄体生成素(L H)、促卵泡激素(FSH)、性激素结合球蛋白(SHBG)、睾酮(T)、雄烯二酮(A2),计算L H/FSH比值,计算游离雄激素指数(FAI)=T(n mol/L)×100/SHBG(n mol/L)。④超声检查:月经第3~5d采用美国GE彩色多普勒超声诊断仪经阴道超声检查卵泡数目、最大卵巢包膜厚度、最大卵泡直径,并以椭圆球体积公式近似计算卵巢体积(ml)=0.5×长(mm)×宽 mm)×厚(mm)。⑤随访:治疗后定期门诊复查和电话随访6个月,统计患者建立正常月经周期率、排卵率、自然妊娠率和卵巢过度刺激综合征(OHSS)发生率。
1.5 统计学分析
采用SPSS19.0统计学软件进行数据分析,计量资料以¯x±s表示,比较经t检验;计数资料以百分率(%)表示,比较经χ2检验。p<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般情况
观察组44例,年龄(30.3±2.1岁)(22~35岁),PCOS病程(4.1±1.1年)(2~10年),不孕时间(3.4±0.7年)(2~7年);对照组44例,年龄(29.9±1.9岁)(21~35岁),PCOS病程(4.0±1.01年)(1~10年),不孕时间(3.2±0.7年)(1~8年)。两组年龄、PCOS病程及不孕年限等比较无差异(P>0.05)。
2.2 两组治疗前后代谢指标比较
两组治疗前糖脂代谢指标比较无差异(P>0.05);治疗后,两组HDL-C、HOMA-β水平均显著提高,BMI、WHR、LDL-C、TC、TG、FBG、2h PG、FINS、Hb Alc、HOMA-IR水平均显著降低(均p<0.05),观察组除FBG外其余各项指标均优于对照组(p<0.05)。见表1。
表1 两组治疗前后代谢指标比较
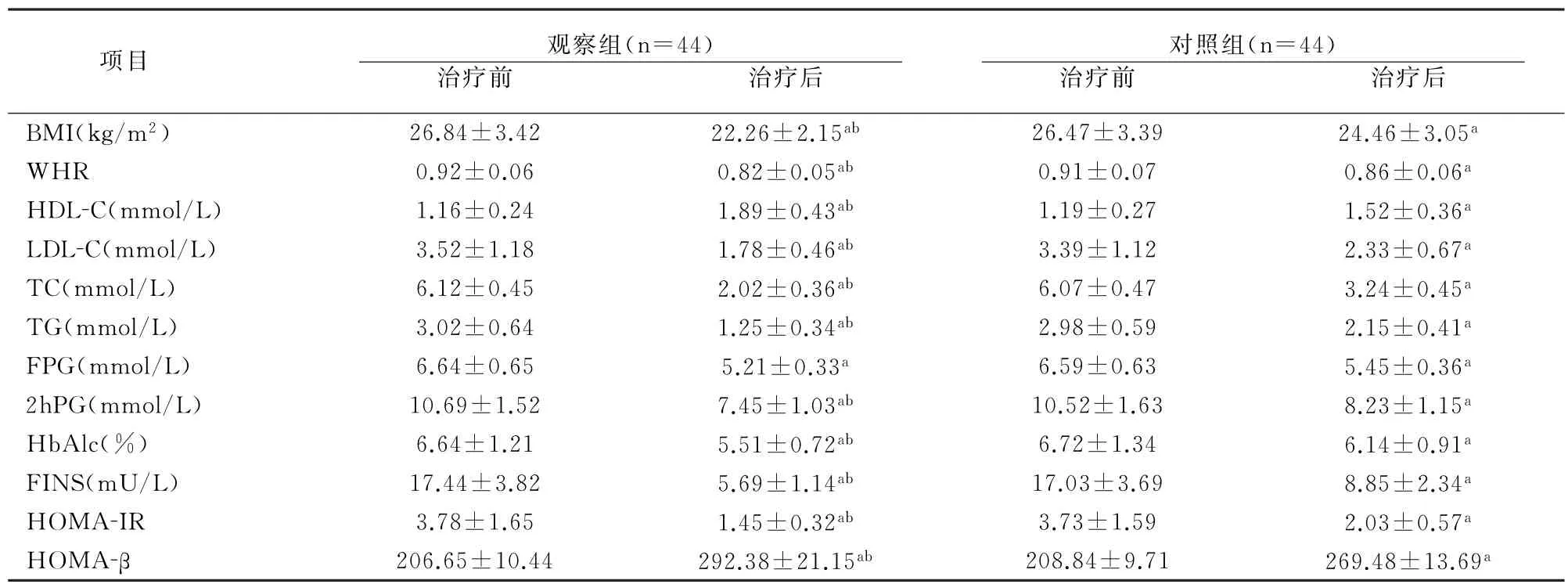
表1 两组治疗前后代谢指标比较
a与本组治疗前比较 b与对照组同期比较p<0.05
项目 观察组(n=44)治疗前 治疗后对照组(n=44)治疗前 治疗后BMI(kg/m2) 26.84±3.42 22.26±2.15 ab 26.47±3.39 24.46±3.05 a WHR 0.92±0.06 0.82±0.05 ab 0.91±0.07 0.86±0.06 a HDL-C(mmol/L) 1.16±0.24 1.89±0.43 ab 1.19±0.27 1.52±0.36 a LDL-C(mmol/L) 3.52±1.18 1.78±0.46 ab 3.39±1.12 2.33±0.67a TC(mmol/L) 6.12±0.45 2.02±0.36 ab 6.07±0.47 3.24±0.45a TG(mmol/L) 3.02±0.64 1.25±0.34 ab 2.98±0.59 2.15±0.41 a FPG(mmol/L) 6.64±0.65 5.21±0.33 a 6.59±0.63 5.45±0.36 a 2h PG(mmol/L) 10.69±1.52 7.45±1.03 ab 10.52±1.63 8.23±1.15a Hb Alc(%) 6.64±1.21 5.51±0.72 ab 6.72±1.34 6.14±0.91 a FINS(mU/L) 17.44±3.82 5.69±1.14 ab 17.03±3.69 8.85±2.34 a HOMA-IR 3.78±1.65 1.45±0.32 ab 3.73±1.59 2.03±0.57 a HOMA-β 206.65±10.44 292.38±21.15 ab 208.84±9.71 269.48±13.69 a
2.3 两组治疗前后激素指标比较
两组治疗前血清性激素水平比较无差异(P>0.05);治疗后,两组SHBG均显著升高,其余指标均降低(p<0.05),且观察组效果优于对照组(p<0.05)。见表2。
表2 两组治疗前后性激素指标比较
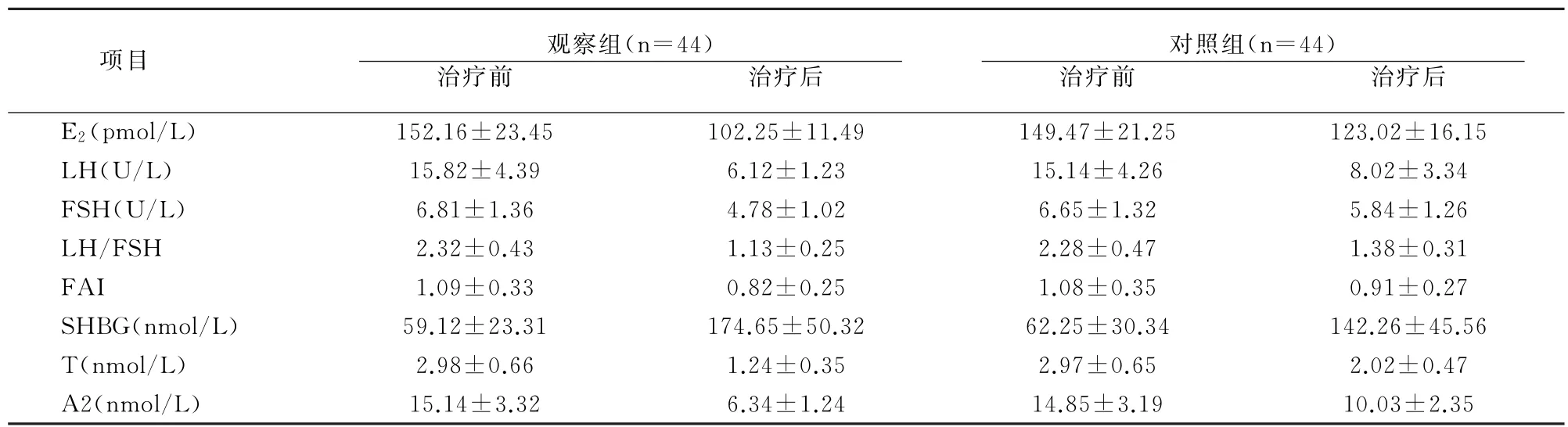
表2 两组治疗前后性激素指标比较
a与本组治疗前比较 b与对照组同期比较p<0.05
项目 观察组(n=44)治疗前 治疗后对照组(n=44)治疗前 治疗后E2(p mol/L) 152.16±23.45 102.25±11.49 149.47±21.25 123.02±16.15 L H(U/L) 15.82±4.39 6.12±1.23 15.14±4.26 8.02±3.34 FSH(U/L) 6.81±1.36 4.78±1.02 6.65±1.32 5.84±1.26 L H/FSH 2.32±0.43 1.13±0.25 2.28±0.47 1.38±0.31 FAI 1.09±0.33 0.82±0.25 1.08±0.35 0.91±0.27 SHBG(n mol/L) 59.12±23.31 174.65±50.32 62.25±30.34 142.26±45.56 T(n mol/L) 2.98±0.66 1.24±0.35 2.97±0.65 2.02±0.47 A2(n mol/L) 15.14±3.32 6.34±1.24 14.85±3.19 10.03±2.35
2.4 两组治疗前后卵泡质量比较
治疗前两组卵泡和卵巢情况比较未见差异(P>0.05);治疗后,两组卵泡最大直径均显著升高,其余指标显著降低(p<0.05),且观察组改善情况优于对照组(p<0.05)。见表3。
表3 两组治疗前后卵泡质量比较

表3 两组治疗前后卵泡质量比较
a与本组治疗前比较 b与对照组同期比较p<0.05
项目 观察组(n=44)治疗前 治疗后对照组(n=44)治疗前 治疗后卵 泡 数 目 (个 ) 16.23±4.31 7.02±2.24 ab 16.25±4.56 8.23±2.45a卵泡最大直径(mm) 5.12±1.14 8.26±2.43 ab 5.19±1.25 7.15±1.72 a卵巢包膜厚度(mm) 2.23±0.45 1.86±0.31 ab 2.24±0.46 1.92±0.55 a卵 巢 体 积 (mL) 13.45±3.36 6.85±1.27 ab 13.13±3.24 9.19±2.24a
2.5 两组治疗效果比较
两组OHSS发生率无明显差异(P>0.05);但经随访,观察组的月经周期正常率、正常排卵率及自然妊娠率均高于对照组(p<0.05)。见表4。

表4 两组治疗效果比较[例(%)]
3 讨论
PCOS不孕的发病原因及机制目前尚未完全阐明,目前公认IR、HI和HA是其基本病理生理特征,三者之间可相互影响和相互作用,直接或间接影响PCOS患者的内分泌代谢,最终影响卵泡发育而引起无或稀发排卵、不孕等[6]。尤其是PCOS合并T2DM时,IR和HI较为明显,而长期IR及HI可经胰岛素受体而直接对卵泡膜细胞产生作用,影响患者多胚胎着床与妊娠[7]。口服复方避孕药物(COC)是当前临床治疗PCOS的主要手段,其中以炔雌醇环丙孕酮应用较为广泛。该药可与双氢睾酮(DHT)竞争性结合受体,有效抑制5α-还原酶的活性,并可抑制下丘脑分泌促性腺激素释放激素(Gn RH),从而抑制LH等卵巢源性雄性激素的分泌。同时,其雌激素成分炔雌醇能够结合靶细胞的雄激素受体而阻断外周靶器官的雄激素作用,促进肝细胞合成SHBG,进一步降低血液循环中游离T含量,最终降低雄激素的生物敏感性[8]。但临床实践表明,炔雌醇环丙孕酮对内分泌代谢紊乱的改善作用不明显,甚至可能加重IR而进一步影响糖代谢平衡,尤其是对于合并T2DM的PCOS患者而言疗效一般[9]。因此,纠正IR及HA成为PCOS不孕治疗的重要方向。鉴于单用COC无法改善患者的IR,近年来国内外诸多学者推荐使用胰岛素增敏剂辅助治疗PCOS,认为其可改善IR及HA,调节内分泌紊乱,促进卵巢功能恢复,但结论并不完全一致。
循环游离脂肪酸(FFA)持续升高是导致IR的关键,可导致组织对葡萄糖的利用率降低,并可降低周围组织对胰岛素的敏感性[10]。二甲双胍是临床治疗糖尿病的常用药物之一,辅助治疗PCOS能够起到糖脂代谢调节作用,缓解或中和口服COC对IR的负面效应[11]。吡格列酮是一种胰岛素增敏剂,能提高胰岛素敏感性并改善胰岛β细胞功能,降低IR及血糖水平[12]。同时可提高葡萄糖组织利用率,促进血糖水平降低。此外还可改善胰岛素敏感性及IR,减轻HI,继而纠正HA,恢复有排卵月经周期[13]。另有研究表明,吡格列酮还可直接调节卵巢对甾体激素的合成和分泌作用,有效抑制雄激素的合成与释放,纠正患者的多重病理生理改变[14]。
本研究结果显示,治疗后两组患者BMI和WHR均显著降低,且观察组低于对照组,认为炔雌醇环丙孕酮与吡格列酮联用更有利于降低体重;两组的HDL-C均显著升高,LDL-C、TC、TG、FBG、2h PG、FINS、Hb Alc均显著降低,且观察组各项指标改善幅度明显优于对照组。证实吡格列酮更有利于调节PCOS患者的糖脂代谢紊乱。此外,观察组的HOMA-β水平均显著高于对照组,而HOMA-IR水平均显著低于对照组,认为吡格列酮能够改善患者的胰岛β细胞功能,改善IR,这也是PCOS治疗的核心。同时,两组患者的血清性激素水平均显著降低,且观察组更优,提示吡格列酮可能更有利于调节患者的性激素紊乱。由于血循环中仅1%~2%的游离睾酮能够发挥其生物学效应,故评估FAI能够更为准确地反应循环中睾酮的生物活性[15]。本研究进一步测评了FAI值,结果显示两组治疗后FAI水平均显著降低,且观察组低于对照组,同时SHBG水平较对照组提高。进一步证实了吡格列酮联合炔雌醇环丙孕酮能够减轻PCOS患者的HA。可能是由于其对IR及糖脂代谢紊乱的改善作用更佳有关。
卵巢局部IR与PCOS患者的生殖功能障碍密切相关[16]。并可进而引起持续性稀发排卵或无排卵,诱发不孕症[17]。陆新虹等[18]研究表明,IR及HA与PCOS患者的卵巢体积呈正相关性,与卵泡大小呈负相关性,IR与HA将影响PCOS患者的卵巢形态,进而影响生育功能。本研究中,两组治疗后卵泡最大直径均明显升高,卵巢包膜厚度、卵巢体积及卵泡数目均显著降低,而观察组优于对照组。认为炔雌醇环丙孕酮联合吡格列酮能够更好地改善患者的卵泡质量,改善生育功能。随访结果显示,观察组的正常排卵率及自然妊娠率均高于对照组,推测炔雌醇环丙孕酮与吡格列酮联合治疗PCOS不孕伴T2DM能够提高妊娠率。
综上所述,炔雌醇环丙孕酮联合吡格列酮治疗PCOS不孕伴T2DM疗效显著,能够改善患者的糖脂代谢紊乱及性激素异常,改善IR及卵泡质量,提高妊娠率,值得临床借鉴应用。但由于本研究样本较小,且病例选择存在一定的偏倚,加之随访时间尚短,未进一步随访观察妊娠结局,其远期影响还有待进一步研究完善。
