宫腔镜在反复胚胎种植失败患者中的临床应用价值
2018-09-23于晓兰
李 昕 于晓兰 徐 阳 尚 鶄 王 宁 薛 晴
北京大学第一医院妇产科(100034)
体外受精—胚胎移植术(IVF-ET)是治疗不孕症的重要手段,其成功率约30%~40%[1]。在IVFET治疗中≥2个周期的优质胚胎种植失败称为反复种植失败(RIF),发生率约为10%[2],是影响IVF-ET成功率的主要因素。既往研究发现25%~50%RIF患者存在宫腔形态异常或子宫内膜病理性改变[3],影响胚胎着床,故RIF患者再次胚胎种植前进行宫腔镜检查可能成为提高妊娠率的重要手段[4-6]。本研究探讨RIF患者宫腔病变类型及宫腔镜检查对再次移植胚胎妊娠结局的影响。
1 资料及方法
1.1 一般资料
本研究纳入2014年1月—2017年12月在北京大学第一医院生殖中心行IVF-ET种植失败连续≥2次(包块新鲜周期与冻融周期)并接受宫腔镜检查术的患者。所有患者每次IVF-ET周期中均种植至少1枚优质胚胎(根据Peter卵裂期胚胎评分系统)。排除标准:年龄≥40岁;体重指数(BMI)≥28 kg/m2;子宫腺肌病、黏膜下子宫肌瘤;输卵管积水;易栓症、抗磷脂综合征;既往反复流产史。
1.2 宫腔镜检查方法及治疗措施
所有患者均接受丙泊酚静脉麻醉,采用日本奥林巴斯纤维宫腔镜(型号HYF-XP)及摄像系统,于月经干净后3~7d行宫腔镜检查。探查宫腔形态,内膜颜色、厚度,双侧输卵管开口及宫颈管。如发现子宫内膜赘生物行赘生物摘除术;宫腔粘连患者行粘连分离。宫腔畸形(纵隔子宫)患者行子宫纵隔切除术;慢性子宫内膜炎患者术后口服头孢替安联合甲硝唑治疗2周;子宫内膜不典型性增生患者术后口服醋酸甲羟孕酮片治疗6个月,停药后再次接受宫腔镜检查留取子宫内膜病理。对于宫腔正常患者轻柔搔刮宫腔2周。所有宫腔组织均行病理检查,术后常规应用抗生素预防感染。
1.3 胚胎移植方案
所有入组患者均在宫腔镜检查明确诊断并接受相应治疗后尽快接受冻融胚胎或新鲜胚胎移植,再次接受胚胎移植时至少有1个优质胚胎。
1.4 诊断标准
子宫内膜息肉、子宫内膜增生、宫腔粘连、慢性子宫内膜炎、子宫纵隔等宫腔镜诊断标准参考《妇科内镜学》[7]及术后病理。观察所有患者再次胚胎移植术后胚胎种植率及临床妊娠率。胚胎种植率=总孕囊数/移植总胚胎数;临床妊娠率=临床妊娠数/总移植数。移植后28d阴道超声探及胎囊及原始胎心搏动诊断为临床妊娠。
1.5 统计学方法
2 结果
2.1 临床特点比较
本研究共纳入118例患者,所有患者均接受宫腔镜检查。宫腔正常者57例(A组),宫腔异常者61例(B组),检出率为51.7%;宫腔异常患者中子宫内膜息肉40例(B1组),其它异常共21例(B2组),其中宫腔粘连13例,宫腔形态异常3例(鞍形子宫1例,纵隔子宫2例),子宫内膜不典型增生2例,慢性子宫内膜炎3例,所有患者均未发生子宫穿孔、感染、水中毒等并发症。3组患者年龄、不孕年限、原发不孕比例、窦卵泡数、基础激素水平、不孕原因差异均无统计学意义(表1)。

表1 3组临床特征比较
2.2 再次胚胎移植临床结局比较
所有入组患者均在病理诊断明确且接受相应治疗后接受胚胎移植,其中子宫内膜非典型性增生患者再次接受胚胎移植前复查子宫内膜病理结果正常。所有患者均移植D3的胚胎。3组患者再次胚胎移植时,新鲜胚胎移植和冻融胚胎移植周期比例、移植胚胎数目、移植优质胚胎数量、内膜厚度及内膜准备方案和促排卵方案差异均无统计学意义。A组异位妊娠3例,临床妊娠25例,其中双胎妊娠4例,单胎妊娠19例,早孕期胎停育2例。B组异位妊娠1例,临床妊娠22例,其中双胎4例,单胎15例,三胎1例,早孕期胎停育2例;C组临床妊娠3例,其中双胎1例,单胎2例。A组种植率、临床妊娠率与B1组比较,差异无统计学意义(χ2=1.02,P=0.312;χ2=1.17,P=0.280),但A组及B1组的胚胎种植率和临床妊娠率明显高于B2组,差异有统计学意义(χ2=7.43,P=0.024;χ2=9.45,P=0.009)(表2)。B2组宫腔粘连患者13例,术后妊娠2例;子宫内膜增生2例,术后妊娠1例;宫腔形态异常3例和慢性子宫内膜炎3例均未妊娠。
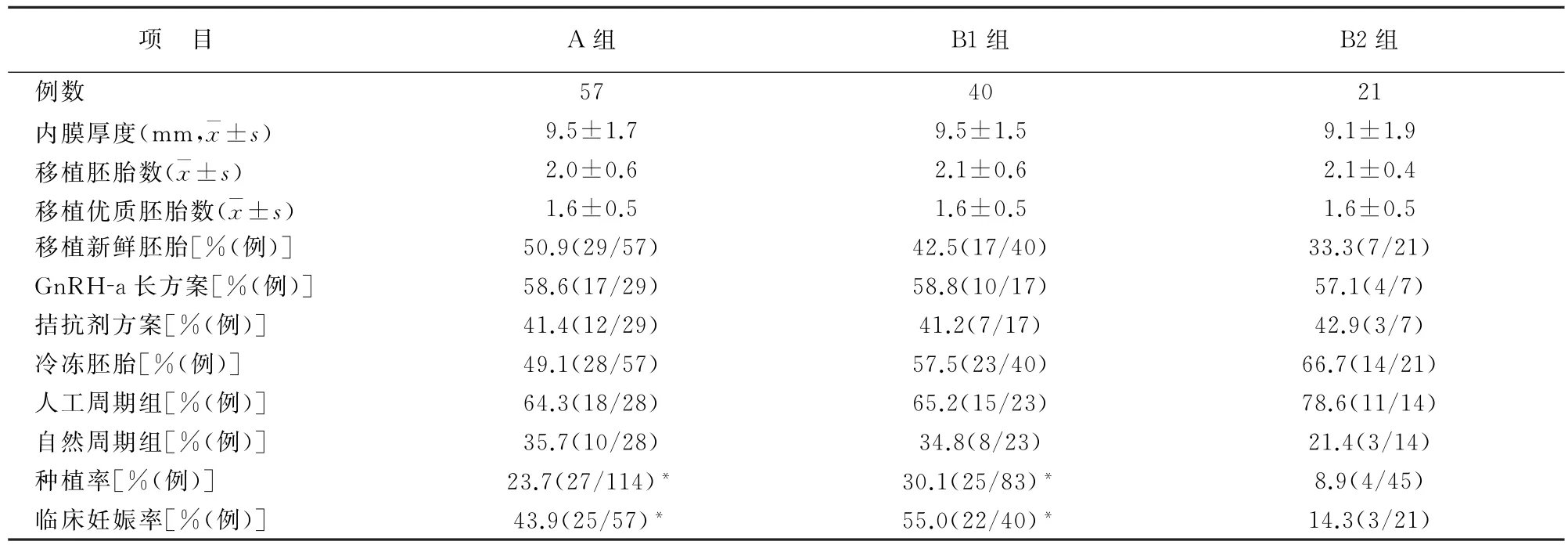
表2 3组再次胚胎移植情况及临床结局
3 讨论
目前RIF诊断标准未统一。Yoshioka等[8]认为排除卵巢早衰(FSH≤15 U/L)且经历≥4次的胚胎移植而未妊娠者诊断为RIF;Tan等[9]认为RIF指经历2~6个IVF-ET周期,移植10个以上高质量胚胎仍未妊娠;Hosseini等[10]提出经历≥2次移植周期失败,且每周期至少移植1枚优质胚胎,称为反复种植失败。根据本院生殖中心患者的年龄状况,目前采用Hosseini等学者提出的诊断标准,认为连续≥2次胚胎移植失败,且每次至少移植1枚优质胚胎仍未获得着床即诊断为RIF。
RIF病因复杂,胚胎质量及发育潜能欠佳、子宫内膜容受性差、母体的免疫、心理因素异常及移植操作不当等均有可能引起RIF的发生[11]。研究发现,RIF患者多存在宫腔形态及子宫内膜异常改变,如子宫内膜息肉、子宫内膜异常增生、子宫内膜粘附因子及细胞因子改变等,均可降低子宫内膜容受性,影响胚胎着床[12]。然而,常规的阴道超声及子宫输卵管造影无法准确判断宫腔情况,既往数据显示79.3%阴道超声及子宫输卵管造影阴性的RIF患者,经宫腔镜手术后发现宫腔形态及子宫内膜存在异常病变[13]。宫腔镜是评价子宫内膜最准确的方法,能够在胚胎移植前较为准确的评估RIF患者宫腔情况[14-15]。同时还可术中对宫腔异常进行处理,术后并发症少[16-17]。2015年Gao等[13]一项前瞻性队列研究发现,接受宫腔镜检查的RIF患者发现宫腔异常为37.1%,术后妊娠率为41.9%。胡肖玲等[18]对胚胎种植失败患者再次种植前行宫腔镜检查,发现宫腔、子宫内膜异常的发生率为84.4%,处理宫腔病变后再次接受冻融胚胎移植的临床妊娠率(43.8%)显著高于未进行宫腔镜检查而直接进行冻融胚胎移植患者(29.4%)。本资料显示RIF患者接受宫腔镜检查后,宫腔异常的检出率为51.7%,再次移植胚胎后临床妊娠率为42.4%。多项研究也证明宫腔镜检查可以提高RIF患者再次胚胎移植的妊娠率,建议将宫腔镜应作为RIF患者常规检查[6,10]。
2018年,Cao等[19]针对RIF患者分析发现,异常病变发生率最高为子宫内膜息肉。本研究中,共有61例患者存在宫腔异常,其中子宫内膜息肉占异常发现的65.6%。子宫内膜息肉对胚胎植入造成不利影响,而宫腔镜下内膜息肉切除术可促进RIF患者再次IVF-ET时的胚胎着床[20]。我们发现宫腔镜治疗后子宫内膜息肉患者,再次接受胚胎移植临床妊娠率达55%,证实子宫内膜息肉患者经手术治疗后妊娠率显著提高。
宫腔镜检查能全面评估宫腔形态、子宫内膜分布及损伤程度,是诊断宫腔粘连的首选方法[21]。宫腔镜宫腔粘连分离术是治疗宫腔粘连的标准术式,可以分离、切除瘢痕组织,恢复宫腔解剖结构,有效保护残留子宫内膜从而有利于胚胎着床。朱一萍等[20]报道RIF患者宫腔粘连分离术后临床妊娠率为18.2%,本研究中宫腔粘连患者13例,术后妊娠2例,临床妊娠率15.4%,与既往报道相似。
对于子宫内膜息肉以外的其它宫腔病变,宫腔镜手术也可以机械性清除不规则增生、去除局部病灶、恢复宫腔形态从而提高子宫内膜容受性[22]。本研究中宫腔粘连13例,宫腔形态异常3例,子宫内膜增生2例,慢性子宫内膜炎3例,均接受宫腔镜手术治疗,但术后仅有3例获得临床妊娠,说明除子宫内膜息肉外的其它宫腔异常病变,尽管接受相应临床处理但再次移植胚胎临床结局仍不理想。由于本研究样本例数有限,仍需待大样本研究证实。
综上所述,RIF与宫腔病变高度相关;RIF患者最常见的病理类型为子宫内膜息肉,较宫腔其它病变,宫腔镜手术能够提高伴有子宫内膜息肉的RIF患者临床妊娠率。
