吡格列酮保护糖尿病大鼠肾缺血再灌注损伤的实验研究
2020-04-20邹丛胡红林涂云明陈同长王炜超
邹丛 胡红林 涂云明 陈同长 王炜超
1南昌大学第四附属医院内分泌科(南昌330003);2南昌大学第二附属医院泌尿外科(南昌330006)
肾脏疾病可以因多种因素引起,如缺血再灌注损伤(ischemia-reperfusion injury,IRI)、糖尿病[1]。然而,肾IRI是急性肾损伤(acute kidney injury,AKI)的主要病因之一,也是糖尿病的常见并发症[2]。糖尿病是肾功能正常患者手术后AKI的独立预测因素,而且,临床研究显示高血糖与AKI 高发生率明显相关[3]。术中高血糖可以导致过量产生细胞凋亡和氧化应激,尤其可以在肾脏中产生,进而引起肾损伤[4]。因此,需要进一步的实验研究来预防或保护这种肾疾病的发生。肾IRI的各种治疗方法中减轻肾细胞凋亡被认为是保护肾损伤的重要环节[5-6]。笔者以前的研究表明,治疗2型糖尿病的过氧化物酶体增殖物激活受体-γ(PPAR-γ)激活剂吡格列酮可以通过抗凋亡和抗氧化应激保护非糖尿病小鼠肾IRI[7-8]。TAWFIK[9]报道吡格列酮可以通过调节氧化应激和炎症而减轻糖尿病大鼠急性IRI 诱导的肾损伤。本研究旨在探讨吡格列酮通过抗凋亡作用保护糖尿病大鼠肾IRI。
1 材料与方法
1.1 实验动物雄性SD 大鼠(6~8 周龄,200~250 g,SPF级)购自南昌大学医学院动物实验科学部。本实验所有操作均遵循南昌大学动物实验伦理委员会操作流程。
1.2 实验试剂吡格列酮购自江苏恒瑞制药公司,STZ 购自美国Sigma 公司,兔抗鼠bcl-2、bax、caspase-3、caspase-8和β-actin 抗体购自美国Abcam公司,TUNEL 检测试剂盒购自武汉博士德生物科技公司。
1.3 2型糖尿病大鼠建立2型糖尿病大鼠模型通过腹腔注射单剂量STZ(50 mg/kg)建立,注射STZ 一周后,大鼠禁食8 h,从尾静脉采血检测血糖,空腹血糖>250 mg/dL 考虑建模成功[10],则进行下一步实验。
1.4 实验设计采用随机对照设计原则,将大鼠随机分成如下6组:(1)IRI组(n= 8):正常SD 大鼠行肾IRI 手术;(2)DM+IRI组(n= 8):糖尿病大鼠行肾IRI;(3)吡格列酮+IRI(n= 8):正常SD 大鼠术前一周接受鼻饲吡格列酮(每日10 mg/kg),然后再经历肾IRI;(4)吡格列酮+DM+IRI(n= 8):糖尿病SD 大鼠术前一周接受鼻饲吡格列酮(每日10 mg/kg),然后再经历肾IRI;(5)假手术组(n=8):正常SD 大鼠假手术;(6)DM+假手术组(n=8):糖尿病大鼠假手术。
1.5 大鼠肾IRI模型建立 大鼠手术前禁食8~12 h,采用2%水合氯醛(2 mL/100 g)腹腔注射麻醉,具体手术过程如下:腹部正中行1.5~2 cm 切口,逐层分离进入腹腔,将肠道推向一侧,暴露肾蒂,用无损伤血管夹夹闭双侧肾蒂45 min,然后移除血管夹恢复肾脏血流,关闭切口。术中应用生理盐水使动物保持充分水化,术后动物给与充足饲料和水。假手术组动物双侧肾蒂不夹闭,其余操作相同。
1.6 肾功能检测术后24 h 从大鼠内眦静脉丛取血标本0.5 mL,并4 500 r/min 离心10 min,提取血清检测肌酐和尿素氮水平。
1.7 肾脏组织病理学评估各组大鼠术后24 h 处死并取出肾脏,肾脏沿长轴切开,固定于10%福尔马林溶液中,石蜡包埋。切成4 μm组织玻片,行常规苏木精-伊红(HE)染色。在光学显微镜下观察肾小管坏死情况。每张玻片随机选取皮髓交界处20个视野,按RABB 等[11]方法进行半定量评分,评估肾小管坏死程度,评分越高代表损伤越严重。
1.8 TUNEL检测 脱氧核糖核苷酸末端转移酶介导的末端标记法(TUNEL 法)检测DNA 链破裂情况。将制作后的玻片在二甲苯中去除石蜡,经梯度乙醇溶液再水化后,按TUNEL 试剂盒说明书操作染色,随机选取皮髓交界处20个视野(200×),定量观察TUNEL 阳性细胞数。
1.9 WesternBlot检测 各组大鼠术后24 h 处理并取出肾脏,肾脏在冰块上制作成细胞匀浆并离心。采用考马斯亮兰法(Bradford 法)检测蛋白浓度。应用常规Western Blot 法检测各组大鼠肾组织中caspase-3、caspase-8、bcl-2和bax 蛋白的表达,并将最终条带进行定量分析。内参照为β-actin。1.10 统计学方法 所有资料应用GraphPad Prism 5.0 进行统计分析,数据以表示,组间比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 吡格列酮降低血清肌酐和尿素氮与假手术组相比,肾IRI组大鼠血清肌酐和尿素氮明显升高(P<0.01),然而,应用吡格列酮明显抑制了其升高,与IRI组和DM+IRI组相比,吡格列酮+IRI组和吡格列酮+DM+IRI组血清肌酐和尿素氮均明显降低(P<0.05)。然而,吡格列酮+IRI组和吡格列酮+DM+IRI组之间血清肌酐和尿素氮差异无统计学意义(P>0.05,图1)。
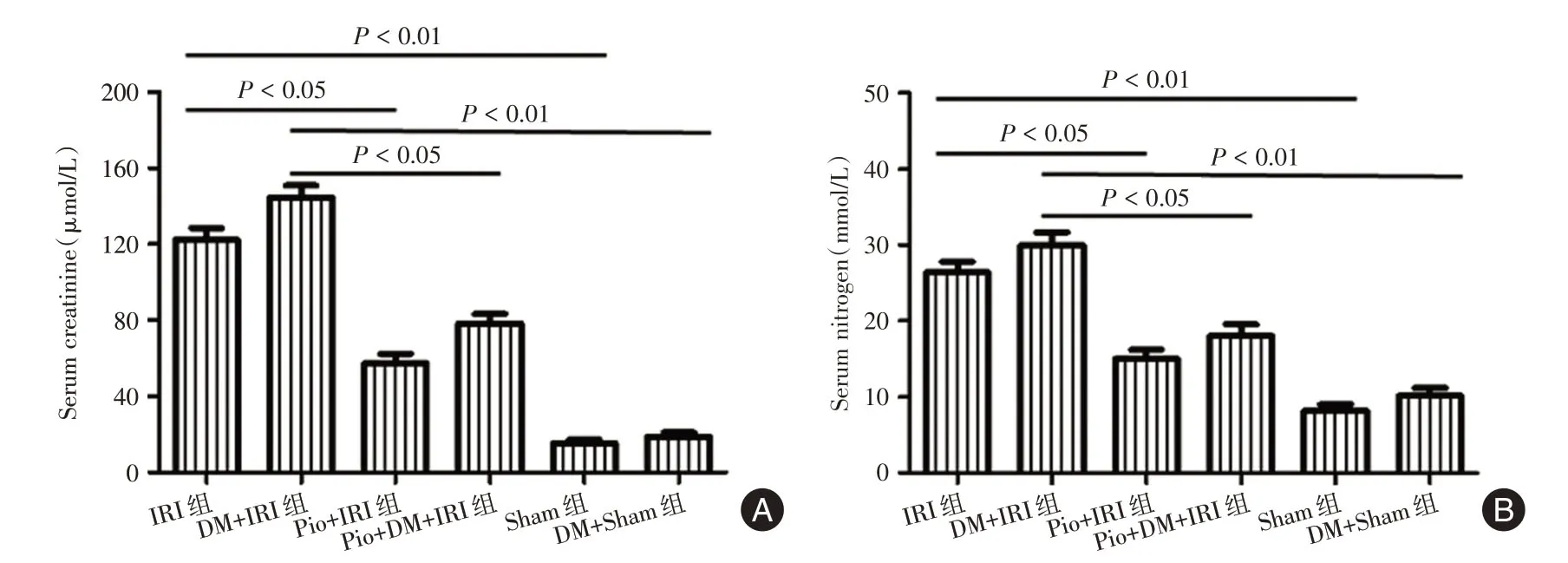
图1 吡格列酮保护肾IRI 后肾功能Fig.1 Pioglitazone protected renal function after renal IRI
2.2 吡格列酮降低肾细胞凋亡与假手术组相比,IRI组和DM+IRI组肾细胞凋亡率明显升高(P<0.01),而IRI组和DM+IRI组之间肾细胞凋亡率差异无统计学意义(P>0.05)。与IRI组和DM+IRI组相比,吡格列酮+IRI组和吡格列酮+DM+IRI组肾细胞凋亡率明显降低(P<0.05)。结果表明:吡格列酮在正常大鼠和糖尿病大鼠均能抑制肾细胞的凋亡(图2)。
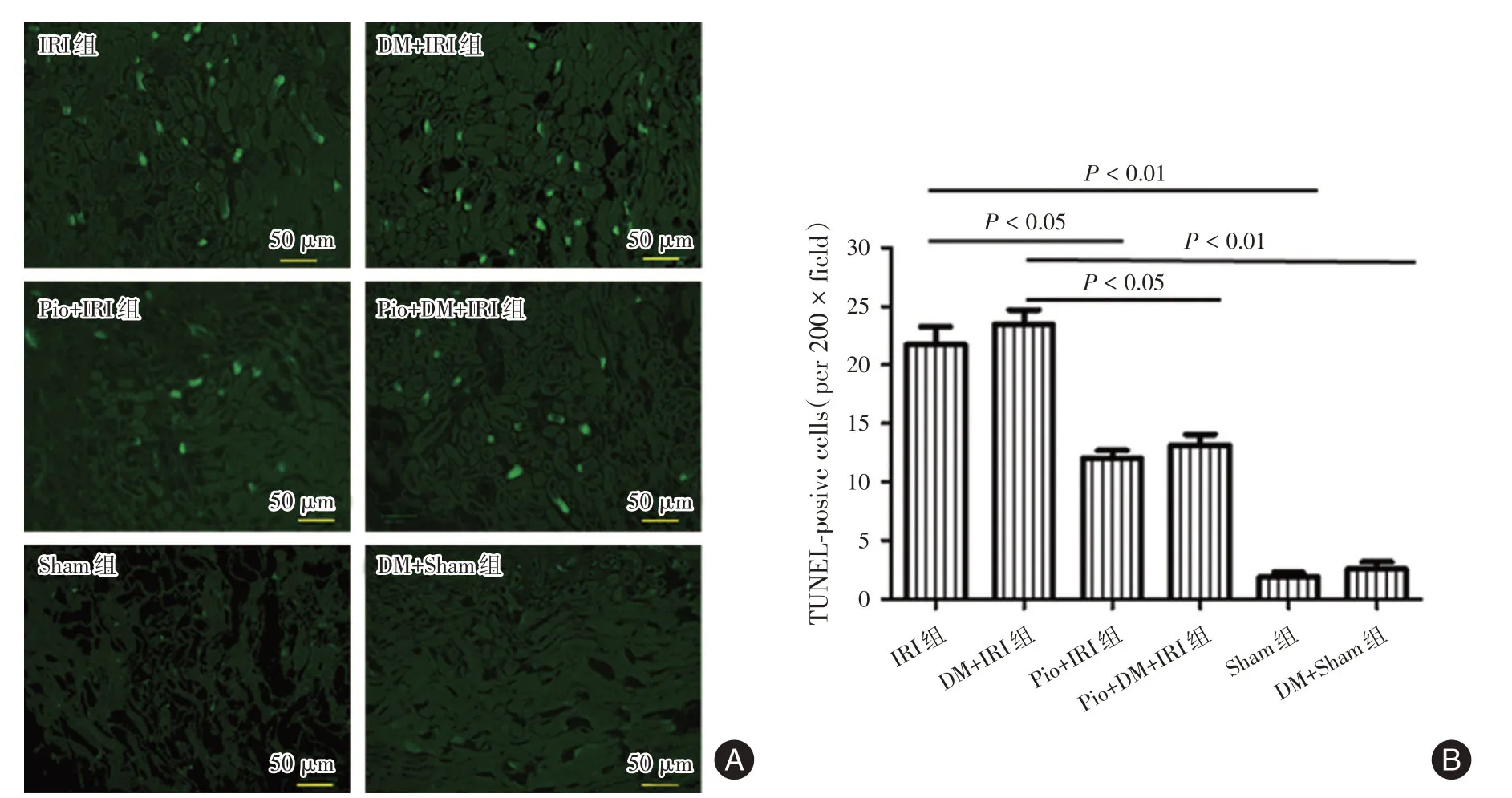
图2 吡格列酮降低肾IRI后肾细胞凋亡Fig.2 Pioglitazone reduced renal cell apoptosis after renal IRI
2.3 吡格列酮降低肾小管损伤假手术组肾脏显示正常的肾组织学形态(图3),而IRI组和DM+IRI组肾脏显示不同程度的缺血性肾损伤,包括广泛的肾小管结构变性、膨胀、水肿、空泡形成以及坏死(图3A)。与假手术组相比,IRI组和DM+IRI组肾小管损伤病理评分明显升高(P<0.01),而IRI组和DM+IRI组之间差异无统计学意义(P>0.05)。与IRI组和DM+IRI组相比,吡格列酮+IRI组和吡格列酮+DM+IRI组肾小管损伤病理评分明显降低(P<0.05,图3B)。
2.4 吡格列酮升高肾组织中bcl-2蛋白表达和降低bax 蛋白的表达与假手术组相比,IRI组和DM+IRI组肾组织中bcl-2 蛋白表达明显降低,bax蛋白表达明显升高(P<0.01)。然而吡格列酮+IRI组和吡格列酮+DM+IRI组肾组织中bcl-2 蛋白表达明显升高(P<0.01),bax 蛋白表达明显降低(P<0.01,图4)。
2.5 吡格列酮降低肾组织中caspase-3和caspase-8蛋白剪切片段的表达Caspase-3和caspase-8是caspase 依赖性细胞凋亡的关键蛋白酶。为了探讨吡格列酮在肾IRI 中的作用,本研究检测了肾IRI后肾组织中caspase-3和caspase-8 蛋白的表达情况,结果显示:所有组肾脏中,pro-caspase-3和procaspase-8蛋白的表达差异无统计学意义(P>0.05)。然而,与假手术组相比,IRI组和DM+IRI组肾组织中caspase-3 蛋白剪切片段P17和caspase-8 蛋白剪切片段P18 表达明显升高(P<0.01),但是应用吡格列酮治疗可以明显抑制其升高(P<0.01,图5)。
3 讨论
笔者以前的研究表明,治疗2型糖尿病的PPAR-γ激活剂吡格列酮可以通过抑制肾细胞凋亡和改善抗氧化活性而保护正常小鼠的肾IRI[7-8]。在本研究中,进一步阐明吡格列酮通过抑制细胞凋亡减轻糖尿病大鼠肾IRI,发现吡格列酮可以改善糖尿病大鼠肾IRI 后肾组织病理学和生化等指标。
肾IRI是临床肾移植、肾部分切除术和其他肾脏外科手术时常见的病理过程,也是糖尿病常见的并发症。大量的文献研究了肾IRI的相关机制,包括细胞凋亡、氧自由基损伤、内皮损伤、钙超载和细胞能量代谢紊乱等,其中,细胞凋亡被认为是主要的因素之一[12-13]。
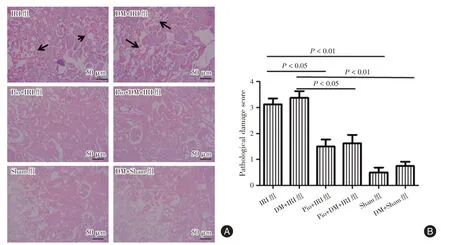
图3 肾IRI 后24 h 各组大鼠肾脏组织形态学评估Fig.3 Renal histomorphology was evaluated in rats 24 hours after renal IRI

图4 肾IRI 后24 h 各组大鼠肾组织bcl-2和bax 蛋白的表达Fig.4 Expression of bcl-2 and bax proteins in renal tissue of rats 24 hours after renal IRI
吡格列酮通过抗炎和抗纤维化效应在肾小球肾炎、肾小球硬化症和糖尿病肾病中发挥治疗作用[14-15],吡格列酮可以在很低的水平激活PPAR-γ,导致PPAR-γ 与相应受体结合,同时招募协同因子,最后调控协同因子的转录。研究[16]表明,吡格列酮通过抑制胰岛素抵抗或氧化应激改善糖尿病肾病。也有研究显示吡格列酮通过抑制细胞凋亡和抗炎抗氧化作用保护IRI[17-19]。本研究通过双侧肾动脉阻断45 min 建立肾IRI 糖尿病大鼠模型,吡格列酮治疗组动物的血清肌酐和尿素氮明显降低,表明吡格列酮可以改善糖尿病大鼠肾IRI 后的肾功能。

图5 肾IRI 后24 h 各组大鼠肾组织caspase-3和caspase-8 蛋白的表达Fig.5 Expression of caspase-3 and caspase-8 proteins in renal tissue of rats 24 hours after renal IRI
本研究中,探讨肾IRI 过程中肾细胞的凋亡,发现吡格列酮抑制糖尿病大鼠肾IRI 肾小管细胞凋亡与笔者以前在正常小鼠中研究结果一致[7]。后又应用TUNEL 技术检测了吡格列酮在糖尿病大鼠肾IRI 后肾细胞凋亡的影响,表明吡格列酮可以明显降低肾细胞凋亡率。而且,吡格列酮的细胞保护作用也涉及bcl-2和caspase 家族基因的表达,吡格列酮诱导bcl-2的表达,并与bax 蛋白相互作用而拮抗它们的死亡促进活性,吡格列酮在糖尿病大鼠肾组织中抑制caspase-3和caspase-8 剪切片段表达。
2型糖尿病可以导致器官功能障碍和增加器官对损伤的敏感性[20]。研究发现糖尿病合并肾缺血比单独糖尿病更容易加重肾功能障碍,更加明显的肾小球损害[20-21]。这些结果强调了MELIN 等[22]提出的猜测即糖尿病联合肾缺血在糖尿病肾病的形成中起了重要的作用。在本研究首次证实吡格列酮可以通过抑制肾细胞的凋亡而保护糖尿病大鼠肾缺血损伤,为今后糖尿病肾IRI的防治提供了理论依据和治疗靶标。
吡格列酮作为PPAR-γ激动剂,可以调控着与脂质代谢、葡萄糖稳态和炎症相关的多种基因[23],因此,吡格列酮对糖尿病肾IRI的保护作用的具体机制,不仅仅局限于抑制肾细胞的凋亡,其过程可能涉及一些其他的复杂机制,在今后的研究中,将进一步的探索与证实。而且,本文只进行了体内动物实验的研究,有待于在体外实验中进一步的研究。
