富硒香菇多糖发酵工艺的 优化及其抗氧化活性
2018-09-22曾璇竹雷于国胡国元
曾璇竹,雷于国,胡国元,*,郭 嘉
(1.武汉工程大学环境生态与生物工程学院,湖北武汉 430205; 2.湖北裕国菇业股份有限公司,湖北随州 441300; 3.绿色化工过程教育部重点实验室,湖北武汉 430205)
硒(Selenium,Se)是人体必需的一种微量矿质元素,对维持机体的抗氧化活性及抵抗能力至关重要,具有防癌抗癌、延缓衰老等生理功能[1-2]。香菇(Lentinulaedodes)具有一定的富硒能力,由香菇富集的有机硒具有较好的稳定性,不仅方便贮存、运输,还能够更好地与食品中的其它成分配合,避免其中某些营养成分的流失,从而更容易被人体吸收利用[3]。富集硒后的香菇多糖是一种有机硒化合物,其生物药理活性普遍高于多糖和硒,还能提供其它的有益营养元素和活性物质[4]。

本实验采取液体深层发酵培养的方式,通过加入Na2SeO3溶液,研究培养基pH、硒灭菌方式、硒添加时间、硒添加量和发酵时间对富硒香菇多糖的影响,初步确定富硒香菇胞内及胞外多糖的最优发酵条件,并了解硒添加对香菇多糖DPPH自由基清除活性的影响,为富硒香菇发酵研究及深加工提供一定的参考和依据。
1 材料与方法
1.1 材料与仪器
秋栽7号 香菇菌种,湖北裕国菇业股份有限公司;玉米粉(食品级) 市售;葡萄糖、磷酸二氢钾、磷酸氢二钾、亚甲蓝、亚硒酸钠 均为分析纯,国药集团化学试剂有限公司;酵母粉 安琪酵母股份有限公司;蛋白胨、酵母浸膏、琼脂 北京双旋微生物培养基制品厂;七水硫酸镁、无水硫酸镁 分析纯,西陇化工股份有限公司;2,2-联苯基-1-苦基肼基(DPPH) 上海化成工业发展有限公司;完全培养基(g/L) 葡萄糖20、酵母浸膏2、蛋白胨2、磷酸二氢钾0.46、磷酸氢二钾1、七水硫酸镁0.05、琼脂20、pH自然;液体种子培养基(g/L) 葡萄糖10、酵母粉20、玉米粉过0.15孔径筛(100目)15、磷酸二氢钾3、无水硫酸镁1.5;发酵培养基 同液体种子培养基。
GNP-9080型隔水式恒温培养箱 上海精密试验设备有限公司;LDZX-50KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;CJ-2D洁净工作台 天津杰斯特设备有限公司;DK-S24电热恒温水浴锅 上海精宏实验设备有限公司;MQT-60恒温摇床 上海旻泉仪器有限公司;PHS-3C酸度计 上海理达仪器厂;SHZ-A循环式真空泵 巩义予华仪器有限公司;BL-220H型电子天平 日本SHIMADZU公司;GZX-9030MBE数显鼓风干燥箱 上海博讯实业有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;TG16-WS型离心机 长沙湘智离心机仪器有限公司。
1.2 实验方法
1.2.1 菌种活化和驯化 将秋栽7号菌块接入新鲜的完全培养基平板上活化,25 ℃恒温培养7 d后,将活化好的菌种接种到硒浓度为1 mg/L的完全培养基平板上进行驯化,25 ℃恒温培养7 d,让菌种适应低浓度的硒[7-9]。
1.2.2 液体种子的制备 在250 mL三角瓶中,加入100 mL 的液体种子培养基和1 g/L的Na2SeO3溶液,使硒在液体培养基中的浓度为1 mg/L,每瓶打孔接种4个驯化好的菌饼(直径约为0.672 cm)[10],静置24 h以后,25 ℃摇床培养7 d,转速为150 r/min。
1.2.3 硒源灭菌方式的确定 配置以下三种硒源灭菌方式不同的发酵培养基,装液量为100 mL/250 mL。方式一:将亚硒酸钠溶液添加至培养基后再一起高压灭菌;方式二:亚硒酸钠溶液与培养基分别高压灭菌后再添加;方式三:亚硒酸钠溶液过滤除菌后再添加至已高压灭菌的培养基中;在无菌条件下将培养了7 d的液体种子接入发酵培养基中,接种量为10%,25 ℃、150 r/min下摇床培养10 d,测定生物量及胞内多糖提取量。
1.2.4 硒源添加浓度的确定 采用过滤除菌的方式对硒源进行灭菌,配制发酵培养基使硒的浓度分别达到0、4、6、8、10、12和14 mg/L,无菌条件下接入液体种子,接种量为10%,25 ℃、150 r/min下摇床培养10 d,测定生物量及胞内多糖提取量[11]。
1.2.5 硒源添加时间的确定 采用过滤除菌的方式对硒源进行灭菌,分别在发酵的第0、2、4、6、7和8 d加入8 mg/L亚硒酸钠溶液[12],无菌条件下接入液体种子,接种量为10%,25 ℃、150 r/min下摇床培养10 d,测定生物量及胞内多糖提取量。
1.2.6 初始pH的确定 采用过滤除菌方式对硒源进行灭菌,将培养基的pH调至为3、4、5、自然(5.67)、6、7,无菌条件下接入液体种子,接种量为10%,第7 d时加入8 mg/L的亚硒酸钠溶液,25 ℃、150 r/min下摇床培养10 d,测定生物量及胞内多糖提取量。
1.2.7 发酵时间的确定 采用过滤除菌方式对硒源进行灭菌,将培养基的pH调至4,无菌条件下接入液体种子,接种量为10%,第7 d时加入8 mg/L的亚硒酸钠溶液,分别在发酵的第9、10、11、12和13 d结束发酵,25 ℃、150 r/min下摇床培养,测定生物量及胞内多糖提取量[13]。
1.2.8 Box-Behnken试验设计 根据单因素实验结果,固定硒源灭菌方式为过滤除菌,发酵时间为11 d,采用Box-Behnken试验设计方法,以硒源添加浓度、硒源添加时间和培养基pH为相应变量,分别以X1、X2和X3表示,并以-1、0、1分别代表变量的水平,以富硒香菇多糖提取量为响应值,通过响应曲面分析进行制备条件的优化,从而得到最优发酵条件[14]。

表1 Box-Behnken设计试验因素与水平Table 1 Factors and levels of Box-Behnken design
1.2.9 生物量的测定 发酵培养得到的香菇菌丝体与发酵液分离后,用蒸馏水反复冲洗,直至水洗液经亚甲蓝鉴定后[15],无硒为止,60~80 ℃烘干至恒重,称重即为香菇菌丝体生物量,并磨粉备用。
1.2.10 香菇多糖的提取量测定 称取一定量1.2.9中获得的菌丝体粉末,加入蒸馏水摇匀,料液比为1∶20(g/mL),静止30 min,置于90 ℃恒温水浴锅浸提2 h。用布氏漏斗抽滤,获得滤液。将滤液用旋转蒸发仪均浓缩,浓缩比为1∶20(g/mL)。浓缩后加入无水乙醇至终浓度为60%,醇沉15 h后,4000 r/min下离心15 min,去上清液,烘干至恒重后称重,即为香菇胞内多糖提取量。发酵液抽滤除去菌丝体,浓缩发酵液至原体积1/4,加入无水乙醇,乙醇浓度为75%,醇沉15 h后,4000 r/min离心15 min,去上清液,烘干至恒重后称重,即为香菇胞外多糖提取量[16-18]。
1.2.11 香菇多糖的纯化及抗氧化活性的测定 经优化后的最佳发酵条件下获得富硒香菇胞内及胞外多糖,脱蛋白[19-20]后,同1.2.10的方法醇沉烘干并磨粉。并按一定梯度(200~1000 μg/mL)溶解粉末后待测,以相同条件下未加硒源发酵培养得到的香菇胞内及胞外多糖及VC做对比[21-22],实验分为样品组、对照组和空白组,加入样品和0.2 mmol/L DPPH自由基溶液后,用涡旋振荡器充分混匀,避光反应30 min,517 nm处测定吸光值。
DPPH清除率(%)=[1-(A样品-A对照)/A空白]×100
式中,A样品为样品(2 mL)+DPPH溶液(2 mL)的吸光度;A对照为样品(2 mL)+无水乙醇(2 mL)的吸光度;A空白为DPPH溶液(2 mL)+无水乙醇(2 mL)的吸光度[23-25]。
1.3 数据统计分析
上述实验均设置3组平行,用Excel 2007软件对数据进行平均数和标准偏差的统计分析,结果以平均值±标准偏差表示。响应面实验设计和数据分析采用Design-Expert V8.0.6.1软件,采用Tukey-Kramer post-hoc test对实验结果进行显著性分析。
2 结果与分析
2.1 硒源灭菌方式对富硒香菇液体发酵的影响
如图1可知,方式一的生物量最高为1.2149 g/100 mL,三种方式下所得到的生物量较相近。方式三的胞内多糖提取量最高为32.4 mg/100 mL,方式三的胞内多糖提取量明显高于方式一。三种硒源灭菌方式下得到的菌丝体形态有明显差异,方式一得到的菌丝球呈粉红色,这是由于生物的红硒化现象,细胞将毒性较大的亚硒酸钠还原成无毒的硒元素,红色硒元素是一种人体不能吸收利用的硒形态[26],所以在实践生产中应尽可能减少红硒现象发生,为此选用相对安全且胞内多糖提取量高的方式三(过滤除菌方式)对硒源进行灭菌。

图1 硒源灭菌方式对富硒香菇发酵的影响Fig.1 Effects of sterilization conditions of Se on Se-enriched L. edodes
2.2 培养基硒浓度对富硒香菇发酵的影响
由图2可知,随着硒浓度的增高,胞内多糖的提取量波动比较明显,加硒浓度为6 mg/L时,菌丝体中胞内多糖提取量达到峰值,为33.8 mg/100 mL。加硒浓度为8 mg/L时,菌丝体生物量最高达1.1032 g/100 mL。由图2可知,加硒浓度在6~8 mg/L时,其生物量和胞内多糖提取量均高于未加硒时的值,说明加硒不仅能促进生物量的增加,也能促进胞内多糖的生成。通过比较,初步确定培养基中加入8 mg/L的Na2SeO3溶液为富硒香菇发酵的最佳硒添加量。
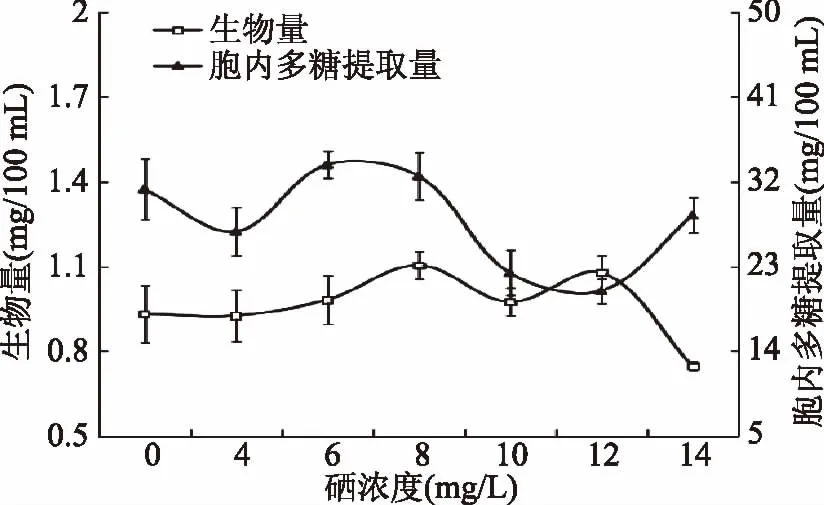
图2 硒浓度对富硒香菇发酵的影响Fig.2 Effects of Se concentration on Se-enriched L. edodes
2.3 加硒时间对富硒香菇液体发酵的影响
由图3可得,生物量的值相对比较稳定,第7 d时达到1.0812 g/100 mL。从菌丝中提取的胞内多糖提取量来看,第7 d前添加,胞内多糖提取量走势比较平缓,在第7 d添加时,提取出的胞内多糖提取量最高为57.6 mg/100 mL,且远远高于其他组。在第8 d添加时,胞内多糖提取量下降至26.9 mg/100 mL,说明在菌丝体生长过程中添加亚硒酸钠溶液,对富硒香菇多糖的影响较大,第7 d添加为富硒香菇发酵中硒源的最佳补添时间,可促进菌丝体内胞内多糖的积累。

图3 硒添加时间对富硒香菇发酵的影响Fig.3 Effects of Se replenishing time on Se-enriched L. edodes
2.4 培养基pH对富硒香菇发酵的影响
培养基自然pH为5.67±0.012。由图4可知,在pH=4时,生物量达到最大值1.4848 g/100 mL,相对于空白组(pH=5.67)高出1.5倍,胞内多糖提取量也达到最高值39.8 mg/100 mL。由此可见,培养基pH对富硒香菇发酵的影响较大,富硒香菇能更好地适应酸性环境。当pH大于4且逐渐升高时,生物量及胞内多糖的提取量均呈下降趋势,pH=7时,不管是生物量还是胞内多糖提取量均受到非常明显的抑制作用,几乎是停止了生长。因此可将培养基pH调至4,此时的生物量及胞内多糖的提取量都达到最大。

图4 培养基pH对富硒香菇发酵的影响Fig.4 Effects of medium pH on Se-enriched L. edodes
2.5 发酵时间对富硒香菇液体发酵的影响
由图5可得,富硒香菇发酵从第9~11 d的生物量一直处于迅速增长的趋势,到第11 d时,生物量达到峰值,为1.0037 g/100 mL,第11~13 d中,生物量增长平缓。胞内多糖提取量也在发酵第11 d时达到最大值,为29 mg/100 mL,第11 d后,胞内多糖提取量开始降低,降低幅度相对较快。因此确定富硒香菇发酵的最佳时间为11 d。

图5 发酵时间对富硒香菇发酵的影响Fig.5 Effects of fermentation time on Se-enriched L. edodes
2.6 响应曲面法优化富硒香菇发酵工艺
根据Box-Behnken响应面设计原理,在单因素实验的基础上,以香菇胞内及胞外多糖提取量为响应值,响应面实验设计及结果见表2。

表2 响应面分析实验方案与结果Table 2 Box-Behnken experimental design and results for response surface analysis

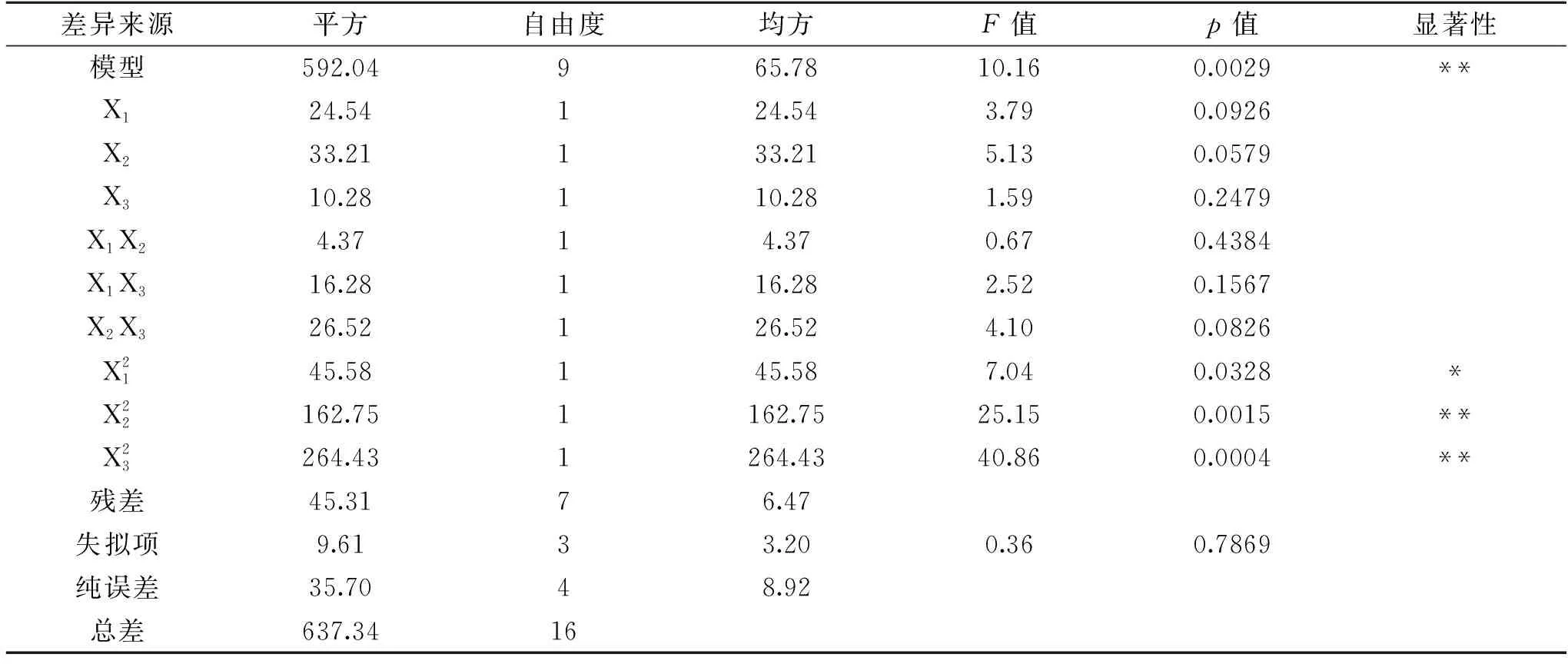
表3 富硒香菇胞内多糖的响应面分析试验方差分析结果Table 3 Analysis of variance for the developed regression model of intracellular polysaccharide of Se-enriched L. edodes

图6 各两因素交互作用对富硒 香菇胞内多糖影响的响应面图Fig.6 Response surface plots showing the interactive effects of various fermentation conditions on the intracellular polysaccharide of Se-enriched L. edodes

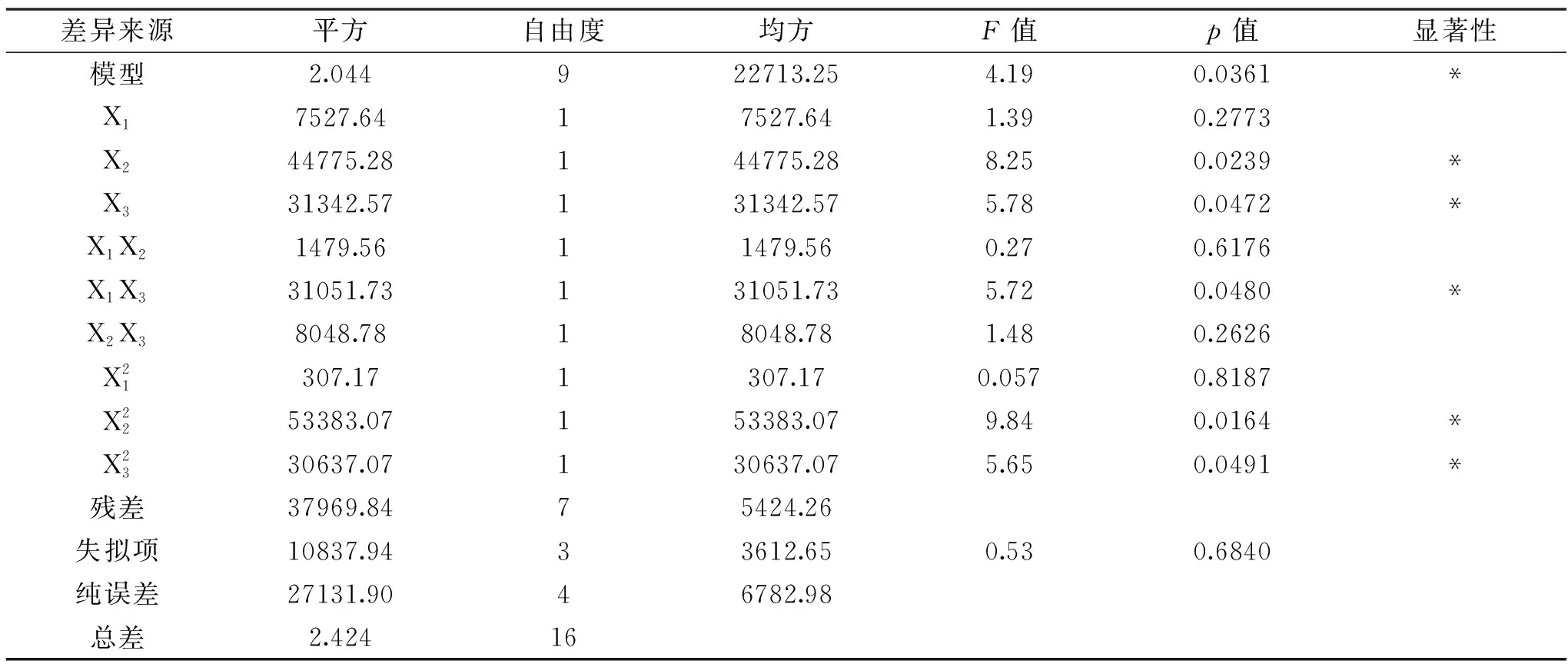
表4 富硒香菇胞外多糖的响应面分析试验方差分析结果Table 4 Analysis of variance for the developed regression model of extracellular polysaccharide of Se-enriched L. edodes

图7 各两因素交互作用对富硒香菇 胞外多糖影响的响应面图Fig.7 Response surface plots showing the interactive effects of various fermentation conditions on the extracellular polysaccharide of Se-enriched L. edodes
相比之下,B图响应面曲线的坡度最大,说明X1加硒浓度和X3培养基pH两者的交互作用对胞外多糖提取量有明显影响。X2加硒浓度在6~7 mg/L,X3培养基pH在4~4.5的范围内存在极值,说明两者之间存在较好的交互作用。通过对胞外多糖的发酵条件进行优化,得出的最佳发酵条件为:采用过滤除菌方式对硒源灭菌,培养基pH调至4.01,发酵至第7.98 d(191.5 h),向发酵液中添加6.68 mg/L Na2SeO3,发酵11 d,此时胞外多糖提取量预测响应值为895.68 mg/100 mL。为检验RSM的可靠性,进行验证实验,得实际值853.96 mg/100 mL。验证值与理论值间的相对误差为4.65%。富硒香菇胞内及胞外多糖提取量在一定范围内随加硒浓度、加硒时间和培养基pH的增加而提高,当其水平越过一定值后,富硒香菇胞内及胞外多糖提取量随之将降低[28]。
2.7 香菇多糖DPPH自由基清除能力比较
将四种脱蛋白后的香菇多糖进行不同倍数的稀释,其DPPH自由基清除率如图8所示。随着溶液浓度的上升,DPPH自由基清除率也上升,可见香菇多糖对DPPH自由基有一定清除效果,四种香菇多糖对清除率的作用影响由大到小的顺序为富硒香菇胞内多糖>香菇胞内多糖>富硒香菇胞外多糖>香菇胞外多糖,实验结果表明,香菇胞内多糖的清除能力明显优于香菇胞外多糖的清除能力,硒的添加能提高了香菇胞内及胞外多糖对DPPH自由基的清除效率。富集硒的过程不仅提高了香菇多糖提取量,同时也提高了其抗DPPH的清除能力[29-30]。

图8 香菇多糖的DPPH自由基清除能力Fig.8 DPPH scavenging rate with diferent concentrations of L. edodes polysaccharide
3 结论
为优化富硒香菇多糖的发酵条件,进行了单因素和响应面的实验分析,得出最佳发酵条件,当培养基pH调至4.16,发酵至第162 h时向发酵液中添加7.97 mg/L过滤除菌的Na2SeO3溶液,发酵11 d,富硒香菇胞内多糖提取量可达到71.54 mg/100 mL;当培养基pH调至4.01,发酵至第191.5 h时向培养基中添加6.68 mg/L过滤除菌的Na2SeO3溶液,发酵11 d,富硒香菇胞外多糖提取量可达到853.96 mg/100 mL。结果显示,富硒可以促进菌丝合成,有助于菌丝的生长及多糖的累积。香菇多糖对DPPH自由基有一定清除效果,香菇胞内多糖的清除能力明显优于香菇胞外多糖的清除能力,硒的添加能提高了香菇胞内及胞外多糖对DPPH自由基的清除效率富集硒的过程不仅提高香菇多糖提取量,同时也提高了其抗氧化活性作用。本试验在香菇液体发酵生成多糖的过程中,加入无机硒,使硒元素与香菇多糖有机结合,并优化其发酵条件,得到的富硒香菇多糖既能够保持多糖的基本构型和生物活性,又避免了无机硒对人体的毒性和副作用,富硒香菇多糖作为一种安全、有效、健康的硒营养源,开发前景十分可观。
