矢车菊素-3-葡萄糖苷与 四种乳蛋白相互作用的研究
2018-09-22刘国荣王成涛朱金锦
王 鑫,赵 磊,郝 帅,刘国荣,王成涛,朱金锦
(北京工商大学,食品营养与人类健康北京高精尖创新中心, 北京市食品添加剂工程技术研究中心,北京 100048)
花色苷是一类天然水溶性多酚类物质,是花青素与各种糖以糖苷键结合而成的类黄酮化合物,主要存在于果蔬植物和谷类中[1-2]。近几年,花色苷由于其潜在的营养和医疗价值而备受关注。有研究表明,花色苷具有抗炎、抗菌、降低血压、提高视力和预防肝损伤等多种生理功能,对高血脂、肥胖等疾病也有一定的预防功能[3-7]。同时花色苷也是一种天然且安全的食用色素,在食品加工中得到了广泛应用。研究表明,花色苷与食品中的蛋白质存在相互作用,HE等[8]发现蛋白质对花色苷具有保护作用,因此研究花色苷和蛋白质的相互作用具有重要意义。赵焕焦等[9]采用多光谱法研究黑米花色苷与酪蛋白之间的相互作用,发现黑米花色苷与酪蛋白可以发生结合并引起其构象上的变化,推测出花色苷类成分在乳品中可以通过与酪蛋白相互作用,从而保护其抗氧化基团在食品加工、储运和消化吸收过程中免遭破坏。Tang等[10]研究表明,矢车菊色素-3-葡萄糖苷(C3G)和牛血清白蛋白之间存在复合作用,其中氢键是主要结合力。当溶液pH大于蛋白质等电点时,多肽或蛋白质与花色苷间还存在静电相互作用[11]。然而,目前的报道多为花色苷提取物与蛋白相互作用的研究,而对某种特定花色苷与蛋白相互作用的研究比较缺乏。市面上许多乳制品中均含有花色苷,如金时代蓝莓酸牛奶、蒙牛黑谷粒早餐牛奶、澳洲美可卓蓝莓护眼牛奶咀嚼片、巧焙蔓越莓牛轧糖等。C3G是自然界中最为常见的花色苷,含量最高[12],因此,选取C3G,研究其与4种常见乳蛋白的相互作用机制具有重要意义。
本实验运用荧光光谱、紫外光谱、红外光谱和圆二色谱,研究C3G与α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白之间的猝灭机理、结合常数、结合位点数、结合力类型、结合距离等重要信息,并研究C3G对四种乳蛋白二级结构的影响,探究C3G与乳蛋白的相互作用机制,进而进一步探究乳蛋白对C3G的保护作用,为花色苷在乳制品中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
矢车菊素-3-葡萄糖苷(≥98%) 四川省维克奇生物科技有限公司;α-酪蛋白、β-酪蛋白 Sigma公司;乳清蛋白、β-乳球蛋白 上海源叶生物科技有限公司;其他试剂 均为国产分析纯。
F-4500型荧光分光光度计 日本日立公司;UV-2450型紫外分光光度计 日本岛津公司;MOS-500型圆二色谱仪 法国Bio-Logic公司;Avater 370型傅里叶变换红外光谱仪 美国Nicolet公司;YLE-1000型恒温水浴锅 北京市精科华瑞仪器有限公司;NK200-1B型氮吹仪 杭州米欧仪器有限公司。
1.2 实验方法
1.2.1 荧光光谱的测定 用磷酸盐缓冲液(PBS,pH7.4,0.01 mol/L)分别配制20 μmol/L的α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白溶液,设定为对照组。用磷酸盐缓冲液(PBS,pH7.4,0.01 mol/L)分别配制20 μmol/L的α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白溶液,随后向其中加入C3G,使得溶液中C3G的终浓度分别为0、5、10、20、30、40、50 μmol/L。在25、45、65 ℃下加热15 min,设置激发波长为280 nm,于300~400 nm波长下测定对照组与反应液的荧光发射光谱,并计算荧光猝灭率:
猝灭率(%)=1-(50 μmol/L C3G的蛋白最大发射波长荧光值/纯蛋白质最大发射波长荧光值)×100
式(1)
1.2.2 紫外光谱的测定 用0.01 mol/L PBS(pH7.4)配制10 μmol/L C3G溶液,室温下以PBS溶液为空白对照,扫描300~400 nm内的紫外吸收光谱。采用OriginPro 8.5软件将C3G的紫外光谱分别与10 μmol/Lα-酪蛋白、β-酪蛋白、乳清蛋白、β-乳球蛋白的荧光光谱重叠在一起绘制图谱。
1.2.3 傅里叶红外光谱的测定 用0.01 mol/L PBS(pH7.4)分别配制C3G与α-酪蛋白、β-酪蛋白、乳清蛋白、β-乳球蛋白摩尔浓度比为1∶1的混合溶液,浓度均为10 μmol/L,室温下反应15 min,再将其制成干燥粉末。KBr烘干6 h以上,所有样品分别与100~200 mg干燥的KBr粉末混合压片制得透明薄片进行全波段(4000~500 cm-1)扫描,扫描次数为32次,分辨率为4 cm-1。
1.2.4 圆二色谱的测定 用0.01 mol/L PBS(pH7.4)分别配制C3G与α-酪蛋白、β-酪蛋白、乳清蛋白、β-乳球蛋白摩尔浓度比为1∶1的混合溶液。以PBS溶液为空白对照,在190~250 nm的远紫外区对待测样品溶液进行扫描,响应时间为0.2 nm,狭缝宽度为2 nm,采集时间1 s/点,CD测试范围300~1000。采用OriginPro 8.5作图,并联合Dicroprot软件中K2D方法和Uniprot蛋白质数据库,计算出蛋白质二级结构的组成与百分比。
1.3 数据统计分析
实验均重复做三组,采用SPSS 13.0软件进行独立样本T检验,用Tukey多重比较确定各均数间的显著性差异,显著水平为α=0.05。所有图谱均采用OriginPro 8.5软件绘制。
2 结果与分析
2.1 C3G对乳蛋白的荧光光谱的影响
2.1.1 不同乳蛋白的荧光光谱测定 由图1可知,在280 nm的激发波长,300~400 nm的发射波长范围下C3G使α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的荧光强度降低产生荧光猝灭作用,而且随着C3G摩尔浓度增加,四种乳蛋白的荧光猝灭程度逐渐增大。当C3G浓度为50 μmol/L时,对10 μmol/L的α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的荧光猝灭率,分别达到84%、74%、77%和75%,四种乳蛋白相互比较,发现C3G对α-酪蛋白的荧光猝灭作用显著(p<0.05)。在蛋白质荧光强度降低的同时,其最大发射波长(λmax)也发生了变化。未加入C3G时,α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的λmax分别为335、340、328和332 nm。四种乳蛋白λmax的数值都随着C3G浓度的增大而增加,λmax发生红移。研究表明,当激发波长为280 nm时,色氨酸和酪氨酸共同提供蛋白质的荧光光谱[13],因此,荧光图谱红移现象说明C3G影响了α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白中酪氨酸和色氨酸残基的微环境,亲水性增强,疏水性减弱[14]。
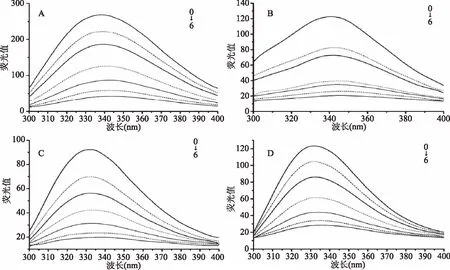
图1 矢车菊素-3-葡萄糖苷对α-酪蛋白(A)、β-酪蛋白(B)、乳清蛋白(C)、β-乳球蛋白(D)的荧光光谱的影响Fig.1 Effect of cyanidin 3-O-glucoside on intrinsic fluorescence of α-casein(A), β-casein(B),whey protein(C)and β-lactoglobulin(D)注:0:C(蛋白质)=10 μmol/L;1~6:C(C3G)=5、10、20、30、40、50 μmol/L。
2.1.2 C3G对乳蛋白荧光猝灭机理的判定 依据 Stern-Volmer(S-V)方程可初步进行判定猝灭类型[15]:
F0/F=1+KSV[Q]=1+Kqτ[Q]
式(2)
式中:F0为未加入C3G的荧光强度;F为加入C3G的荧光强度;[Q]为C3G的摩尔浓度(mol/L);Kq为猝灭速率常数(L/(mol·s));Ksv为Stern-Volmer(S-V)猝灭常数(L/mol);τ为生物大分子的荧光寿命(一般认为平均寿命约为10-8s)。
各类荧光猝灭剂对生物大分子的最大猝灭常数约为2×1010L/(mol·s)[16]。根据公式(1),以F0/F对[Q]进行线性拟合(图2),进而得出不同温度条件下C3G与乳蛋白相互作用的Ksv和Kq,结果见表1。
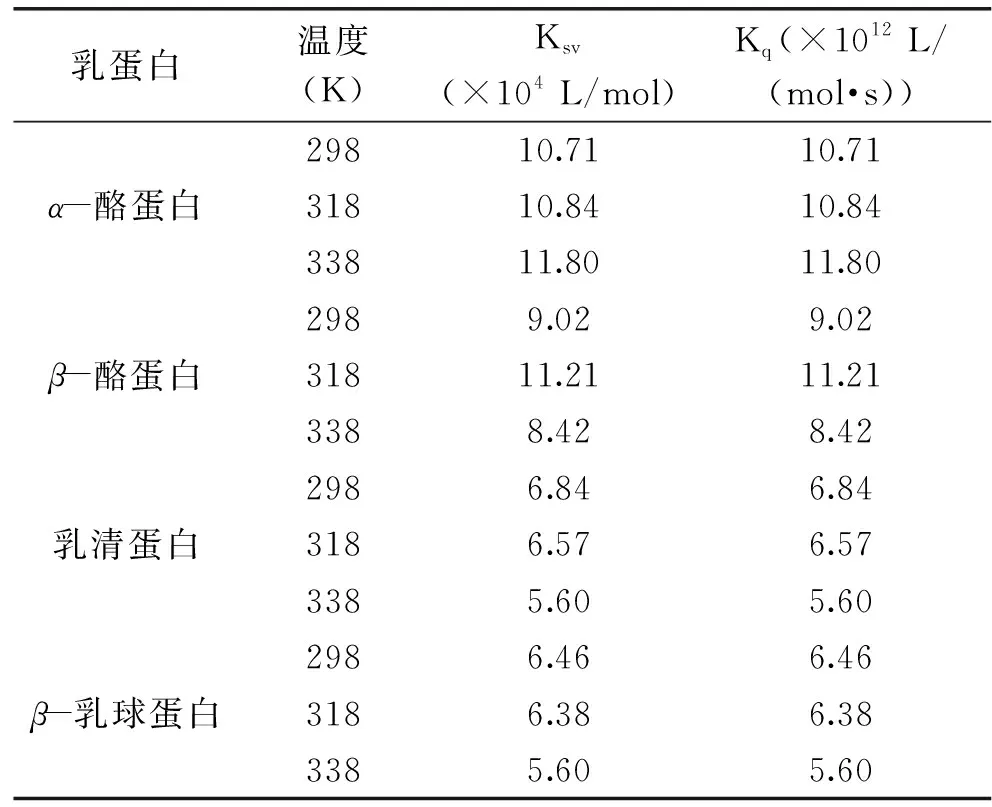
表1 不同温度下四种乳蛋白与C3G的 Stern-Volmer的相关参数Table 1 Stern-Volmer correlation parameters of four milk proteins quenching caused by C3G at three different temperatures
图2是C3G与α-酪蛋白、β-酪蛋白、乳清蛋白、β-乳球蛋白相互作用的S-V猝灭曲线,从图可以看到猝灭曲线与猝灭剂浓度的关系基本上符合动力学猝灭方程。荧光猝灭是荧光物质分子(即荧光体)与溶剂或溶质分子之间所发生的,导致荧光强度下降的物理或化学作用,基于物质间的相互作用分为静态猝灭和动态猝灭[17]。

图2 不同温度下矢车菊素-3-葡萄糖苷与α-酪蛋白(A)、β-酪蛋白(B)、 乳清蛋白(C)、β-乳球蛋白(D)相互作用的Stern-Volmer曲线Fig.2 Stern-Volmer curves of cyanidin 3-O-glucoside interacting with α-casein(A), β-casein(B),whey protein(C)and β-lactoglobulin(D)at different temperatures
若猝灭常数大于2×1010L/(mol·s)时,属于静态猝灭;若猝灭常数小于2×1010L/(mol·s)时,属于动态猝灭[18]。根据表1,乳清蛋白和β-乳球蛋白的Ksv随温度的上升而下降,即静态猝灭常数下降,这说明C3G对乳清蛋白和β-乳球蛋白的荧光猝灭机制属于静态猝灭。对于生物大分子,各类猝灭剂由扩散碰撞产生的最大猝灭常数2×1010L/(mol·s),乳清蛋白和β-乳球蛋白的Kq远大于2×1010L/(mol·s),进一步说明C3G对这两种乳蛋白的猝灭机理是分子之间结合形成化合物所引起的静态猝灭,而不是由分子扩散和碰撞所引起的动态猝灭。α-酪蛋白的Ksv虽然随温度的升高而升高,但其Kq数量级为1012,不符合动态猝灭机理;同理,β-酪蛋白的Ksv和Kq也不符合动态猝灭机理。综上初步判定,C3G对这四种乳蛋白的猝灭机制是基于形成不发光稳定复合物的静态猝灭,而不是由动态碰撞引起。
2.1.3 结合常数和结合位点的计算 在静态猝灭过程中,可对公式(1)双对数处理曲线方程,进而计算结合常数Ks、结合位点数n:
lg[(F0-F)/F]=lgKS+nlg[Q]
式(3)
式中:F0,F,[Q]同2.1.2,Ks为C3G与蛋白质结合常数(L/mol),n为C3G与蛋白质结合位点数。根据公式(2)以lg[(F0-F)/F]对lg[Q]做直线,斜率为n,截距为lgKS。
从图3看出,α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的曲线成良好的线性关系,说明C3G与这四种乳蛋白的相互作用为静态结合。KS代表结合常数,KS值越大说明C3G与乳蛋白之间有较强的结合力。由表2可知,四种乳蛋白中α-酪蛋白的KS最大,其次是β-乳球蛋白,又根据荧光猝灭率结果得知C3G对α-酪蛋白的猝灭最明显,从而推断C3G与α-酪蛋白的静态结合能力最强[19]。这四种乳蛋白的结合位点数n约等于1,由此可知C3G与这四种乳蛋白之间形成了摩尔比约1∶1的静态复合物。且由表2结果发现随着温度的升高,KS的变化与n的变化一致,表明结合力越大,C3G结合到乳蛋白的结合位点越准确。
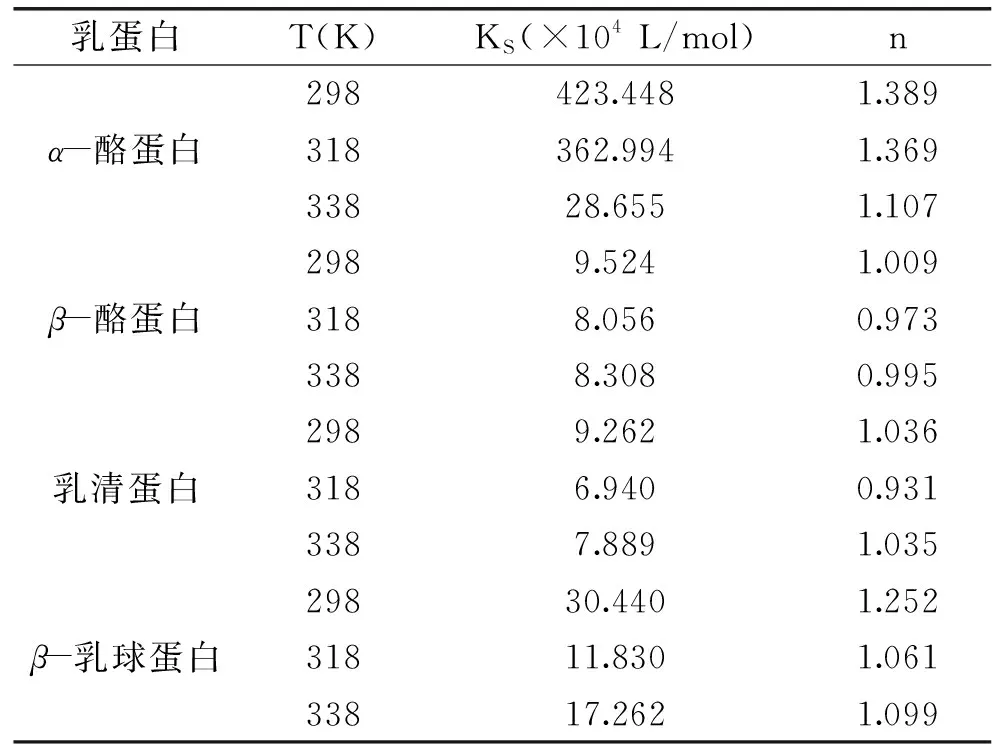
表2 不同温度下矢车菊素-3-葡萄糖苷与 四种乳蛋白的结合常数KS和结合位点数nTable 2 Binding constants and and binding sites of four milk proteins and cyanidin 3-O-glucoside at different temperatures
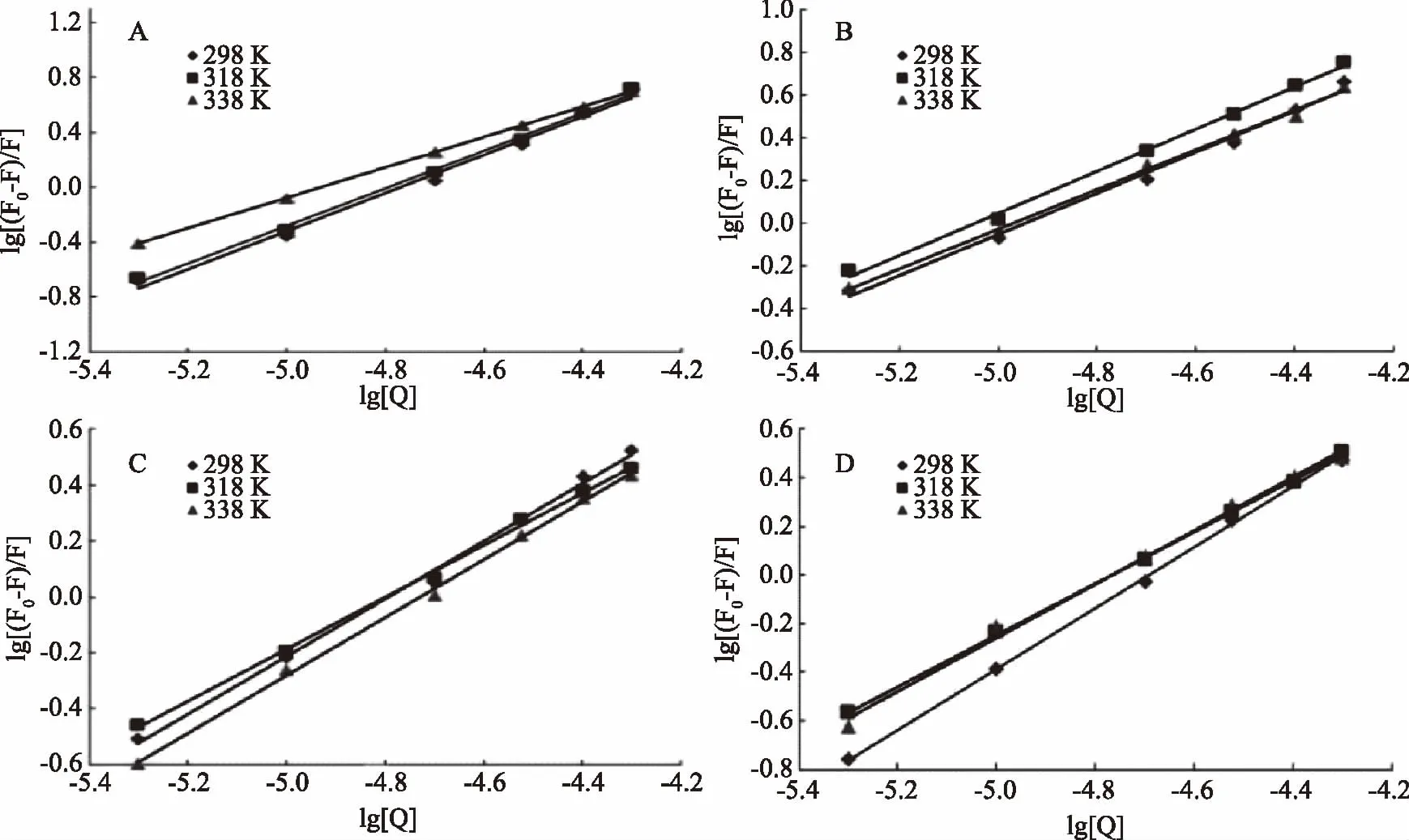
图3 不同温度下α-酪蛋白(A)、β-酪蛋白(B)、乳清蛋白(C)、β-乳球蛋白(D)的lg[(F0-F)/F]与lg[Q]的关系图Fig.3 Plots of lg[(F0-F)/F]and lg[Q]of α-casein(A),β-casein(B), whey protein(C)and β-lactoglobulin(D)at different temperature
2.1.4 热力学参数与相互作用力类型 C3G与α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白之间的相互作用符合热力学公式:
式(4)
ΔG=-RTlnKS
式(5)
ΔG=ΔH-TΔS
式(6)
式中:T为温度(K);KS为该温度下C3G与蛋白质的结合常数(L/mol);R为气体常数(8.314 J/(mol·K));ΔG为生成自由能变(kJ/mol);ΔS为熵变(J/(mol·K));ΔH为焓变(kJ/mol);当温度变化不大时,反应的ΔH、ΔS可看作常数。
小分子生物活性物质和生物大分子之间的作用力主要有氢键、范德华力、疏水作用和静电作用:当ΔH<0、ΔS<0,主要作用力为范德华力和氢键;当ΔH>0、ΔS>0,主要作用力为疏水作用;当ΔH<0、ΔS>0,主要作用力为静电作用[20],因此可以根据熵变(ΔS)和焓变(ΔH)判定两者的作用方式[21]。从表3可以看出,C3G与所有乳蛋白结合的ΔG<0,说明C3G与乳蛋白之间的结合反应是自发进行的。其中,C3G与α-酪蛋白结合的ΔH<0,ΔS<0,说明C3G与α-酪蛋白的分子间作用力为氢键与范德华力;C3G分别与β-酪蛋白、乳清蛋白和β-乳球蛋白结合后的ΔH和ΔS均符合ΔH<0,ΔS>0,这说明这三种乳蛋白与C3G之间主要靠静电引力结合。C3G与乳清蛋白结合的ΔH<0,表明两者之间的相互作用为放热反应,降温应有利于反应的进行,则其KS值应随着温度升高而减小。α-酪蛋白的ΔH<0,其KS符合这种规律(表2)。但β-酪蛋白、乳清蛋白和β-乳球蛋白的KS不符合这种规律,可能是C3G在pH7.4环境中不稳定,且加热到65 ℃引起部分C3G降解或结构变化,导致与β-酪蛋白、乳清蛋白、β-乳球蛋白结合更容易,因而65 ℃的结合能力比45 ℃下要高。

表3 矢车菊素-3-葡萄糖苷与乳蛋白复合物的热力学参数Table 3 Thermo dynamic parameters of C3G-milk protein complex
2.1.5 C3G与不同乳蛋白的结合距离 以上实验结果表明C3G与四种乳蛋白都形成了静态猝灭的复合物,计算两者之间的结合距离可以进一步判断出C3G与乳蛋白结合作用大小。根据Föster’s的非辐射能量转移理论,C3G与α-酪蛋白、β-酪蛋白、乳清蛋白、β-乳球蛋白的结合距离r0和能量转移效率E之间有如下关系[22]:
式(7)
式(8)
式(9)
式中:F0,F同2.1.2;F(λ)为在波长λ时能量供体的荧光强度;ε(λ)为在波长λ时受体的摩尔吸光系数(L/mol);J为供体荧光发射光谱与受体吸收光谱的重叠积分((cm3·L)/mol);R0是转移效率为在50%时的Föster临界距离(nm);φ为供体的荧光量子产率,此实验取0.15;K2为偶极空间取向因子,取2/3;N为水和有机物折射指数,取其平均值1.336。
以表2中C3G与四种乳蛋白结合位点数约为1这一根据,分别测定10 μmol/L乳蛋白的荧光光谱和10 μmol/L C3G的紫外光谱,如图4所示。当供体的荧光发射光谱与受体的吸收光谱发生重叠时,且二者之间的最大距离小于7 nm时存在非辐射能量转移[23]。表4中α-酪蛋白、β-酪蛋白、乳清蛋白、β-乳球蛋白与C3G结合距离r分别为2.17、2.66、2.18、2.19 nm,根据上述理论四种乳蛋白都符合非辐射能量转移条件,也进一步验证了C3G与四种乳蛋白的相互作用都是静态猝灭。通过比较这四种乳蛋白与C3G结合距离大小,发现α-酪蛋白与C3G的结合距离最小,进一步证明四种乳蛋白中α-酪蛋白与C3G的结合强度最大。
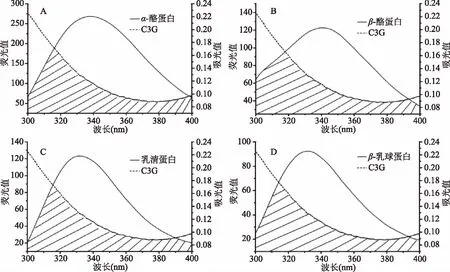
图4 α-酪蛋白(A)、β-酪蛋白(B)、乳清蛋白(C)、β-乳球蛋白(D)的 荧光发射光谱与矢车菊素-3-葡萄糖苷的吸收光谱之间的重叠图Fig.4 The fluorescence emission spectra of α-casein(A),β-casein(B),whey protein(C), β-lactoglobulin(D)and the UV absorption spectra of cyanidin 3-O-glucoside

表4 矢车菊素-3-葡萄糖苷 与四种乳蛋白的结合距离Table 4 Binding distance between cyanidin 3-O-glucoside and four kinds of milk proteins
2.2 C3G对乳蛋白红外光谱的影响
α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的红外谱图如图5所示。C3G的加入引起α-酪蛋白的酰胺I带从1650.40 cm-1移到1654.48 cm-1,而酰胺II带从1527.81 cm-1移到1523.72 cm-1;β-酪蛋白的酰胺I带从1642.22 cm-1移到1650.40 cm-1,而酰胺II带从1523.72 cm-1移到1515.55 cm-1;乳清蛋白的酰胺I带从1654.48 cm-1移到1650.40 cm-1,而酰胺II带从1523.72 cm-1移到1519.64 cm-1;β-乳球蛋白的酰胺I带从1646.31 cm-1移到1642.22 cm-1,而酰胺II带从1523.81 cm-1移到1523.72 cm-1。红外光谱的变化说明C3G对四种乳蛋白的二级结构产生了影响。α-酪蛋白和β-酪蛋白加入C3G后的酰胺I带增强,初步判定C3G使这两种乳蛋白的α-螺旋增加;乳清蛋白和β-乳球蛋白加入C3G后的酰胺I带减弱,表明其α-螺旋在加入C3G后降低了。
α-螺旋二级结构的改变可以通过3300~3400 cm-1酰胺A带(N-H伸缩振动)的改变来进行辅证[24]。图5明显看到波数3300~3400 cm-1附近有一明显宽峰,其代表蛋白质的酰胺A带,由N-H伸缩振动引起。C3G的加入引起α-酪蛋白的酰胺A带波数从3423.84 cm-1右移至3338.02 cm-1,β-酪蛋白从3419.75 cm-1移至3317.59 cm-1,乳清蛋白从3301.25 cm-1移至3293.08 cm-1,β-乳球蛋白从3293.08 cm-1移至3288.99 cm-1。酰胺A带的移动变化说明加入C3G后,这四种乳蛋白二级结构中氢键化形式与程度改变了。

图5 矢车菊素-3-葡萄糖苷与α-酪蛋白(A)、β-酪蛋白(B)、乳清蛋白(C)、β-乳球蛋白(D)相互作用红外光谱图Fig.5 FTIR spectra of cyanidin 3-O-glucoside and α-casein(A), β-casein(B),whey protein(C),β-lactoglobulin(D)and their complexes
2.3 C3G对乳蛋白圆二色谱的影响
如图6所示,对比α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的圆二色谱图,β-乳球蛋白在最大负峰的负椭圆率大于其他三种蛋白质,说明其α-螺旋含量最高,而α-酪蛋白和β-酪蛋白的图形最相近,且都在215 nm附近有一个小肩缝,表示无规则卷曲[25]。α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的负吸收峰分别位于203、199、207和214 nm,C3G使四种乳蛋白CD谱图的负峰都向右红移,且负峰的强度也有所变化,再次验证了C3G的加入对乳蛋白二级结构产生了影响。从表5可直观看到加入C3G后,α-酪蛋白的α-螺旋由7%升至8%,β-折叠和转角从48%降至44%,无规则卷曲含量上升;β-酪蛋白的α-螺旋由5%到6%,β-折叠和转角含量由38%升至41%,但无规则卷曲含量下降;乳清蛋白的α-螺旋、β-折叠和转角、无规则卷曲均无明显变化;β-乳球蛋白的α-螺旋从25%降到21%,β-折叠和转角由25%升高至30%,与其他三种乳蛋白相比,C3G对β-乳球蛋白的α-螺旋、β-折叠和转角的影响最大。研究表明,植物多酚化合物与球状蛋白有着强烈的相互作用,并可能导致蛋白质展开[26]。C3G对β-乳球蛋白的主要二级结构产生了明显的影响,其α-螺旋含量的降低预示着α-螺旋中氢键的断裂使蛋白质结构松散,可能转化为β-转角或无规则卷曲。综上所述,圆二色谱的结果证明了C3G与这四种乳蛋白的相互作用导致蛋白质的二级结构的变化,其中对α-螺旋结构的影响与红外光谱结果一致。

图6 矢车菊素-3-葡萄糖苷与α-酪蛋白(A)、β-酪蛋白(B)、乳清蛋白(C)、β-乳球蛋白(D)体系的圆二色谱图Fig 6 CD spectra of cyanidin 3-O-glucoside and α-casein(A),β-casein(B),whey protein(C),β-lactoglobulin(D)system

表5 四种乳蛋白及其与C3G复合物的二级结构含量Table 5 Secondary structure analysis from the free protein and their complexes
通过荧光光谱法发现C3G与α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白均可形成不发光的稳定复合物产生静态猝灭现象,且随着C3G浓度的增加这四种蛋白质荧光猝灭越明显。由热力学参数判定C3G与β-酪蛋白、乳清蛋白、β-乳球蛋白分子间作用力为静电引力,与α-酪蛋白分子间作用力为氢键与范德华力,结合力最强。通过红外光谱法和圆二色谱法的测定得出C3G对α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白的二级结构产生了影响,对β-乳球蛋白的二级结构影响最大。且加入C3G后α-酪蛋白和β-酪蛋白的α-螺旋含量增加,而乳清蛋白和β-乳球蛋白的降低。
3 结论
C3G与α-酪蛋白、β-酪蛋白、乳清蛋白和β-乳球蛋白之间有较强的相互作用,与α-酪蛋白分子间作用力为氢键与范德华力,与β-酪蛋白、乳清蛋白和β-乳球蛋白间作用力主要是静电引力,并与α-酪蛋白结合最紧密。红外光谱和圆二色谱均表明C3G与四种乳蛋白相互作用引起乳蛋白构象发生改变。本文阐述了C3G与四种乳蛋白之间的相互作用机制,为其生物学特性的深入研究和工业化生产技术开发提供一定依据。此外,C3G与四种乳蛋白相互作用的影响因素以及相互作用机制的了解还不够全面,四种乳蛋白对C3G的保护作用仍需进一步深入研究。最终将其广泛应用于食品工业、医药、化妆品等领域,合理利用两者之间的相互作用,确保在不破坏食品品质的基础上,充分发挥C3G的功能特性。
