颅内孤立性纤维瘤/血管外皮瘤的影像学分析
2018-09-21李子园
李子园 管 民
河南省人民医院 1)放射科 2)介入科,河南 郑州 450003
颅内孤立性纤维瘤(solitary fibrous tumor,SFT)及血管外皮瘤(hemangiopericytoma,HPC)均为脑膜间叶细胞起源的肿瘤。近年来研究发现[1],SFT及HPC患者均有12号染色体长臂(12q13)处基因的断裂倒置,且肿瘤细胞核皆表达 STAT6,因此,2016年WHO中枢神经系统肿瘤分类中将 SFT及 HPC合并为同一类型肿瘤,即 SFT/HPC[2]。SFT/ HPC罕见,易复发,转移风险大,且术中出血凶猛,甚至因术中大出血而危及生命,因此术前正确诊断极其重要[3-5]。本文探讨SFT/HPC的影像学特点,以提高对此病的认知。
1 资料与方法
1.1临床资料分析2015-07—2017-07在河南省人民医院经手术切除病理证明的10例SFT/HPC患者的临床、影像及病理结果:男7例,女3例,年龄35~70岁,中位年龄52岁,7例表现为头痛、头晕、头胀的症状,l例因卒中入院发现,3例出现单侧肢体无力征象,5例存在颅内高压征象。所有患者行MR平扫及增强检查,4例行CT平扫及增强检查。所有患者行外科手术切除,术中发现所有病变来源于硬脑膜,7例包膜较完整,3例侵犯邻近颅骨及脑实质。
1.2影像学检查CT检查采用Philips Ingenuity 64层螺旋CT机。CT平扫管电压120 kV,管电流250 mA。CT增强扫描经肘静脉注入碘海醇(320 mgI/mL),注射剂量1.5 mL/ kg,注射速度2.5 mL/s,动脉期扫描。MRI检查采用GE discovery 750或siemens verio 3.0T MRI扫描仪,行轴位T1WI、T2WI、FLAIR及矢状位T1WI扫描。参数:T1WI TR 500~600 ms,TE 15~17 ms;T2WI TR 3 000 ms,TE 129 ms;层厚3.0 mm,层间距0.5 mm;矩阵 512×512;视野180 mm×180 mm。MRI增强扫描行轴位、矢状位T1WI扫描,经肘静脉注射对比剂钆喷酸葡胺(Gd-DTPA),剂量为0.1 mmol/kg,采用1期动脉期扫描。
1.3病理检查术后标本均由甲醛固定,HE染色,经光镜、免疫组织化学染色明确诊断,同时行CD99、CD34、波形蛋白(Vim)、线粒体内膜蛋白、上皮膜抗原、S-100抗体染色。
2 结果
2.1病灶的大小、形态、分布病灶大小2.5~5.6(4.5±1.0)cm。所有患者为单发病灶。其中幕上9例,包括额部4例,颞部、顶部、枕部、颞顶枕部、鞍旁各1例;跨越幕上幕下1例。所有病灶边缘清楚,9例病灶呈类圆形或不规则形,1例呈“8”字形绕小脑幕生长。7例有明确分叶,3例呈浅分叶。所有病灶均紧贴硬脑膜生长。
2.2 CT表现4例CT平扫均呈稍高密度为主,其中l例出现出血囊变,2例病灶内有稍低密度影。1例可见包膜,包膜边缘可见点状钙化。1例有周围颅骨骨质破坏。增强扫描后病灶呈均匀或不均匀明显强化。
2.3 MRI表现见图1~2。10例病灶有邻近脑组织推压,即“白质移位征”,6例病灶有假包膜形成(图1A)。MRI平扫,与脑实质相比,T1WI上5例表现为等信号,2例表现为稍低信号,3例表现为混杂信号;T2WI上6例表现为等信号,4例表现为混杂信号,其中2例可见短T2信号(图2A),4例出现囊变,1例病灶有出血(图2);4例可见迂曲流空血管影(图2C);DWI表现为低信号(图1C),增强扫描呈均匀或不均匀明显强化(图1D、图2C);短T2信号区可见明显强化(图2C)。3例病灶周围无水肿(图1),7例有轻-中度瘤周水肿(图2)。与硬脑膜呈窄基底相连7例(图1D)、呈宽基底相连3例,5例伴脑膜尾征,4例有周围骨质破坏。
2.4病理结果大体病理:病变组织多为灰褐色或灰白色。病理镜下可见肿瘤细胞弥漫性生长,多呈梭形,细胞核中无核内假包涵体,可见核异型性(图1E)。瘤内血管数量多,呈裂隙状或鹿角状,内附有扁平内皮,肿瘤细胞包绕推压小血管,部分区域出现坏死。免疫组化:8例为弥漫性 CD34(+),7例为Vim(+),3例为CD99(+),5例为线粒体内膜蛋白(+),上皮膜抗原(-),S-100(-)。其中7例未见明显核分裂象,考虑良性,3例核分裂象活跃,诊断为恶性。
3 讨论
3.1流行病学及临床SFT及HPC曾以两种不同的肿瘤形式被命名。2007版中枢神经系统肿瘤分类认为SFT及HPC是两种不同类型的肿瘤[6-7]。近年来研究发现,颅内SFT及HPC是由相同位点的基因突变而产生的,肿瘤细胞核皆表达STAT6,可通过免疫组化检测出[1,8]。两者虽非完全相同,但也存在交叉之处。因此,2016版新版WHO中枢神经系统肿瘤分类中,将SFT与HPC合并为SFT/HPC,用以描述此种类型肿瘤[2]。
WANG等[9]报道,22例颅内SFT患者中,男性患者占59.09%,中位年龄47.6岁。MELONE等[10]关于颅内HPC回顾性分析结果显示,43例患者中女性占60.50%,中位年龄46.9岁,与本研究结果有一定差异,可能与以上研究为SFT或HPC的分别研究以及本组病例数较少有关。 SFT/HPC的临床表现与其发生部位有关。本组患者7例以头痛、头晕、头胀症状就诊,原因是肿瘤并非起源于脑实质,增大的肿瘤推压临近脑实质,从而导致颅内高压,因此精神症状并不典型。目前SFT/HPC以手术切除为主要治疗方法,必要时同时进行化疗、放疗,有文献报道放射治疗可以使无法完整切除的肿瘤明显缩小[3-5],并减少复发和转移的出现。
3.2影像表现与病理表现SFT/HPC好发于大脑镰旁、小脑幕或矢状窦等部位,脑室内及蝶鞍旁少见[11-14],与脑膜瘤相似,这可能是由于肿瘤起源于脑膜间叶细胞的原因。本组病例与既往研究[11-14]相似。SFT/HPC肿块多为分叶状、不规则形,这是肿瘤血流丰富,生长速率较快,位于边缘的肿瘤细胞生长速率不同造成的,显示了肿瘤浸润性生长的特性[11]。
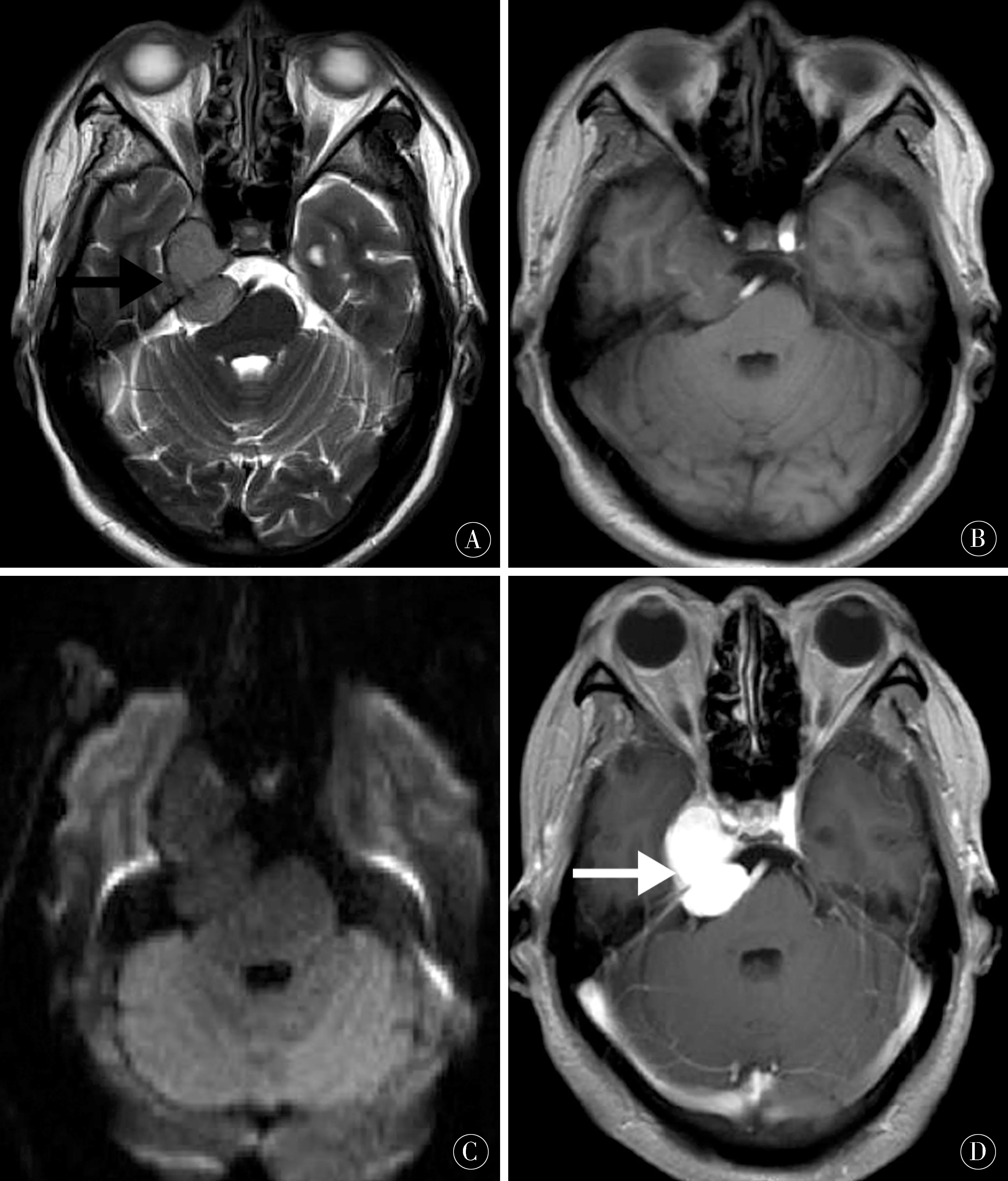
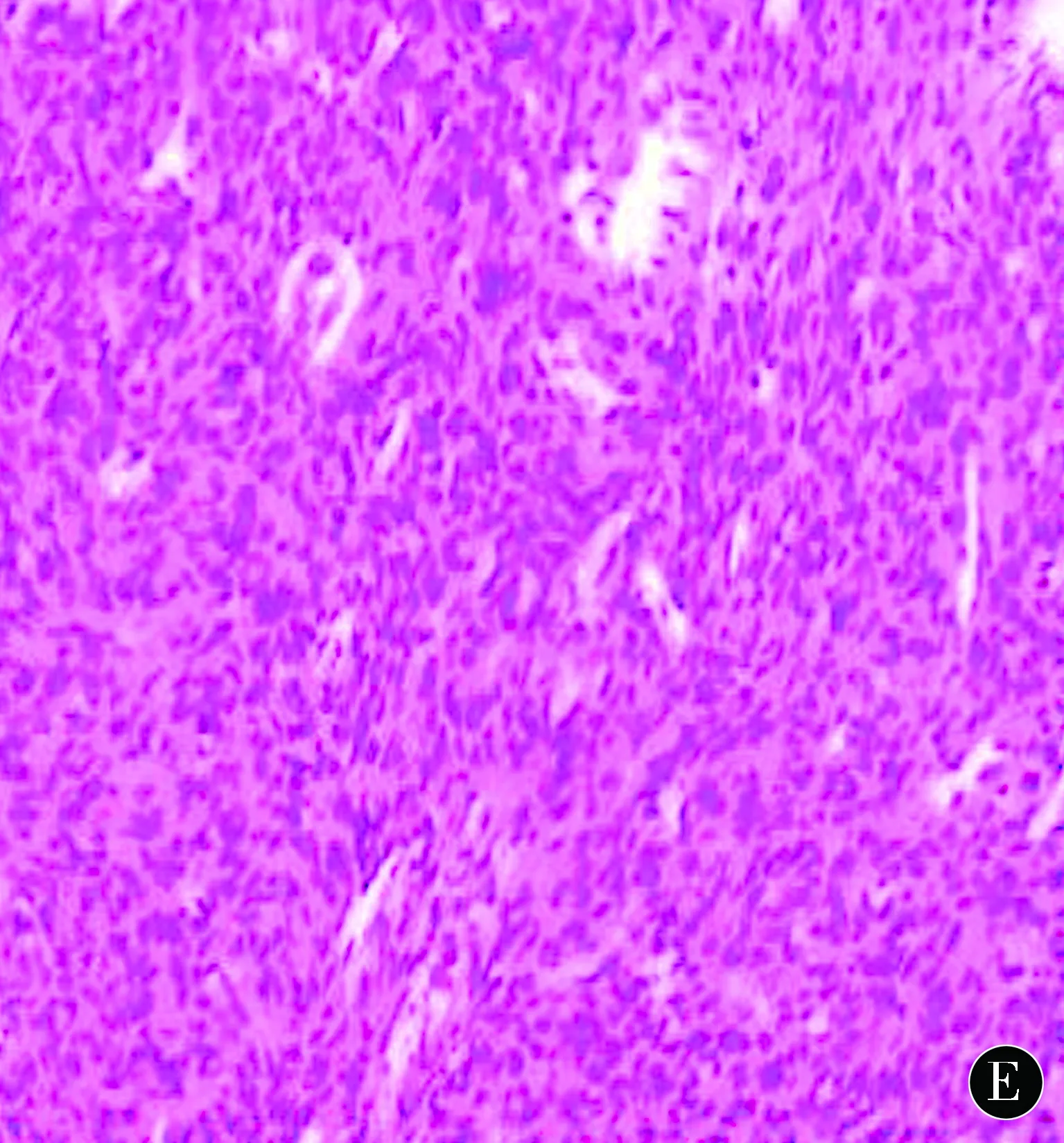
图1 SFT/HPCⅡ级 A:MRI示病灶表现为稍等T2信号,瘤周假包膜形成(黑箭头);B:稍等T1信号;C:DWI表现为稍低信号;D:增强扫描呈明显均匀强化,呈窄基底与小脑幕相连(白箭头);E:病理镜下瘤细胞胞质丰富,可见核分裂象(HE,× 200)Figure 1 SFT/HPC Ⅱgrade A:MRI showed lesion with slightly equal T2 signal,pseudocapsule formation (black arrow);B:Slightly equal T1 signal;C:DWI showed slightly low signal;D:Enhancment scan showed markedly homogenous enhanced with a narrow base attached to the tentorium(white arrow);E:Pathologically,the cytoplasm of the tumor cells was abundant,and the karyokinesis can be seen (HE,×200)
CT平扫病变呈不均匀稍高密度影,可伴周围颅骨骨质破坏,与脑膜瘤所致的颅骨骨质增生不同[15-16]。MRI平扫,与脑实质相比,T1WI上5例表现为等信号,2例表现为稍低信号,3例表现为混杂信号;T2WI上6例表现为等信号,4例表现为混杂信号,这是SFT/HPC的特征性表现,而脑膜瘤则多表现为等T1、等T2信号,两者并不相同[17]。DWI多呈低信号,可能由于肿瘤中有坏死囊变,水分子弥散自由度较高[18]。
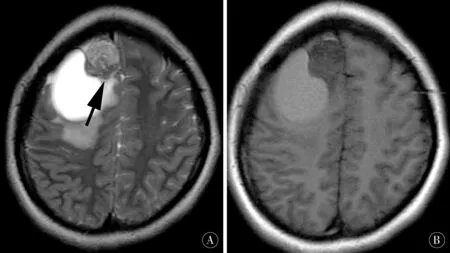
图2 SFT/HPC Ⅲ级 A、B:MRI示病灶表现为以长T2、短T1为主的混杂信号;C:增强扫描呈明显不均匀强化,病灶内部可见多发迂曲流空血管影(白箭头);A、C:瘤内T2低信号区可见明显强化(黑箭头)Figure 2 SFT/HPC Ⅲ grade A,B:MRI showed lesion with mixed signals dominated by long T2 and short T1 signal;C:Enhancment scan showed markedly inhomogenous enhanced,and there were multiple tortuous vascular shadows inside the lesion (white arrow);A,C:Intratumoral T2 low signal area showed obvious enhancement (black arrow)
SFT/HPC多表现为混杂信号,同时病理示病灶多出现出血、坏死,原因是肿瘤较大,部分血管玻璃样变,从而导致肿瘤内部血供较少[19]。瘤内有较多血管流空信号,是由于有大量鹿角状及裂隙状血管存在所致,血管流空信号也是SFT/HPC的特征性表现[20-21]。肿瘤内既有大量的血管,又有充足的胶原纤维存在,因此,强化方式因血管及胶原纤维含量不同而不同。由于胶原纤维的存在,T2WI上会存在较低信号区并呈明显强化,同样是SFT/HPC较为特征性的表现之一(图2A、C)。文献[22-23]报道,SFT/HPC增强扫描强化方式不一,强化可均匀或不均匀,与本研究一致。
本组部分病例瘤周有轻-中度水肿,瘤周水肿程度可能与肿瘤对临近静脉窦的推压、周围组织的侵犯程度及肿瘤对脑组织的浸润,血-脑屏障的损害程度有关[19,21,24-28];也可能与肿瘤P73蛋白的表达有关,P73表达阳性率越高,水肿程度就越高[25,29-30]。病灶与硬脑膜呈窄基底相连7例,与硬脑膜呈宽基底相连3例,5例伴脑膜尾征。较少出现脑膜尾征、病灶与硬脑膜呈窄基底相连,这些特征的出现可能是因 SFT/HPC生长时间短,发展速度较快,对硬膜的浸润、侵袭的程度并不足以形成脑膜尾征[15]。
3.3鉴别诊断从发病部位及组织学上考虑,SFT/HPC主要与脑膜瘤、神经鞘瘤进行鉴别诊断。脑膜瘤起源于脑膜上皮,多发生于老年女性病人,病灶内部信号较为均匀一致,大多表现为等T1、等T2信号,边界清楚,多数有脑膜尾征,周围骨质硬化增生,强化方式均匀一致,但强化程度不及 SFT/ HPC[15-16,26-28]。
神经鞘瘤内部易出现囊变坏死,增强扫描实性部分强化较明显,但实质部分强化程度仍不及SFT/HPC[27,30-35]。此外,SFT/HPC应与起源于硬膜、颅骨的淋巴瘤进行鉴别,淋巴瘤存在于颅骨两侧,内部信号均一,表现为等T1、等T2信号影,周围颅骨无增厚及破坏,无流空血管影及囊变坏死区,且DWI呈高信号影[28,36-38]。SFT/HPC还需要与颅骨的转移瘤进行鉴别,发现原发病灶有利于鉴别。
总之,SFT/HPC多表现为分叶状或不规则形,周边及内部可见迂曲流空血管影,短T2信号区明显强化,DWI上多呈低信号,边缘无或轻-中度水肿,肿瘤较大时可伴有坏死、出血、囊变,周边骨质破坏,与硬脑膜一般呈窄基底相连,脑膜尾征不常见,增强扫描后病灶呈均匀或不均匀明显强化,了解SFT/HPC以上特点,有助于正确诊断,但确诊仍需靠病理学检查。
