HPLC-MS/MS法测定瓜蒌皮注射液中腺苷和唾液酸的含量
2018-09-20王辉俊柯樱叶冠
王辉俊 柯樱 叶冠
摘 要 目的:建立瓜蒌皮注射液中腺苷和唾液酸的HPLC-MS/MS定量分析方法。方法:采用Waters Xbridge C18色谱柱(4.6 mm×50 mm,3.5 mm),流动相为甲醇-0.1%甲酸溶液,梯度洗脱。质谱条件为电喷雾离子源(ESI),负离子模式监测,源喷射电压:-4.500 kV;雾化温度:550 ℃,采用多反应监测模式(MRM)对瓜蒌皮注射液中腺苷和唾液酸进行定量分析。结果:腺苷和唾液酸线性关系均良好(R≥0.995),线性范围均为250~32 000 nmol/L,腺苷和唾液酸的检出限分别为31.25 nmol/L和3.91 nmol/L。应用建立的HPLC-MS/MS方法测定了3批瓜蒌皮注射液中腺苷和唾液酸的含量,分别为1.407~1.465 mmol/L和251.0~678.7 nmol/L。结论:该方法灵敏性、专属性和选择性好,可用于瓜蒌皮注射液中腺苷和唾液酸的定量测定和质量控制。
关键词 瓜蒌皮注射液 HPLC-MS/MS 腺苷 唾液酸
中图分类号:TQ460.72; R286 文献标志码:A 文章编号:1006-1533(2018)17-0072-04
Determination of the contents of adenosine and N-acetylneuraminic acid in Gualoupi injection by HPLC-MS/MS*
WANG Huijun**, KE Ying, YE Guan***
(Shanghai Pharmaceuticals Holding Co., Ltd., Shanghai, 201203, China)
ABSTRACT Objective: To establish an HPLC-MS/MS method for the determination of adenosine and N-acetylneuraminic acid (NANA) in Gualoupi injection. Method: HPLC analysis was performed on a column of Waters Xbridge C18 (4.6 mm×50 mm, 3.5 mm) with linear gradient elution of methanol-0.1% formic acid solution. Mass spectrometry analysis was carried out at ion spray voltage of ?4.500 kV and the turbo spray temperature of 550 ℃ with electrospray ionization (ESI) ion source in negative mode. The contents of adenosine and NANA in Gualoupi injection were quantitatively determined by multiple reaction monitoring (MRM). Results: The standard curves of both adenosine and NANA showed good linearity (R≥0.995) over the range of 250-32 000 nmol/L and their detective limits were 31.25 nmol/L and 3.91 nmol/L. The contents of adenosine and NANA determined by HPLC-MS/MS in three batches of Gualoupi injections were 1.407-1.465 mmol/L and 251.0-678.7 nmol/L, respectively. Conclusion: This method possesses good sensitivity, specification and selectivity and can be used for the determination and quality control of adenosine and NANA in Gualoupi injection.
KEy WORDS Gualoupi injection; HPLC-MS/MS; adenosine; N-acetylneuraminic acid
瓜蔞皮注射液为上药集团子公司上海第一生化药业有限公司独家产品,是以瓜蒌皮为原料,经水提醇沉,再经过离子交换树脂洗脱而制成的灭菌水溶液,收载于国家中成药标准汇编内科-心系分册438页(WS-11417(ZD-1417)-2002-2008)。临床上用于冠心病、稳定性心绞痛的治疗,具有行气除满、开胸除痹之功效[1-5]。瓜蒌皮注射液临床应用广泛,但目前仅测定与功能主治无关的精氨酸作为含量测定标准。我们前期已做了大量瓜蒌皮注射液物质基础的工作,鉴定出7个氨基酸、4个核苷酸、5个黄酮、1个多肽、1个唾液酸、1个含氮化合物和2个低分子量聚糖[6-8],其中腺苷具有治疗室上心肌过速,动脉粥样硬化,急性心肌梗死、心肌保护和突发性耳聋等作用[9-12]。有报道证明唾液酸(N-乙酰神经氨酸,简称NANA)能够降低血液高凝血状态,从而预防和阻止凝血相关的心血管疾病发生[13]。本研究通过HPLC-MS/MS对瓜蒌皮注射液中的腺苷和唾液酸进行含量测定,为瓜蒌皮注射液的质量控制提供参考。
1 材料
1.1 药品与试剂
瓜蒌皮注射液(上海医药集团股份有限公司上海第一生化药业有限公司提供,4 ml/支,批号为1707201,1707202,1707203),对照品腺苷(纯度99.5%,货号A108808-5 g)和唾液酸(纯度98%,货号A100555-100 mg)购自阿拉丁试剂(上海)有限公司;超纯水(实验室自制);HPLC级甲醇购自德国Merck公司;甲酸(FA)为色谱纯,购自美国Fluka公司;其它的试剂均为市售分析纯。
1.2 仪器
岛津CBM20A系列高效液相色谱仪(包括自动进样器、输液泵、柱温箱、脱气机等)(日本岛津公司)配API 4000 MDTM MS/MS系列三重四级杆质谱仪、Turbo Spray离子源和Analyst 1.6.1 software数据系统(均为美国AB公司)。
1.3 方法
1.3.1 色谱条件
Waters Xbridge C18色谱柱(4.6 mm×50 mm,3.5 mm);柱温:35 ℃;流速:0.6 ml/min;进样量:5 ml;以0.1%甲酸溶液(A)和甲醇(B)为流动相进行梯度洗脱:0~1 min,2% B;1~3.5 min,2%~95% B;3.5~4.5 min,95% B;4.5~4.6 min,95%~2% B;4.6~5.5 min,2% B。
1.3.2 质谱条件
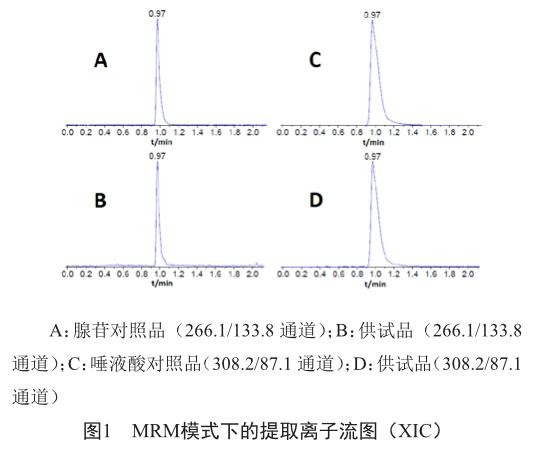
电喷雾离子源(ESI),负离子模式,定量分析采用多反应离子监测模式(MRM);源喷射电压(IS):-4.500 kV;雾化温度(TEM):550 ℃;雾化气(GS1):60 psi;辅助气(GS2):40 psi;气帘气(CUR):20 psi;碰撞气(CAD):6 psi;接口加热,全程通入氮气,腺苷和唾液酸解簇电压(DP)分别为-30 V和-35 V和碰撞能量(CE)分别为-26 eV和-22 eV,监测离子对分别为266.1/133.8和308.2/87.1。对照品和供试品的提取离子流图见图1。
1.3.3 溶液的制备
1)供试品溶液 取瓜蒌皮注射液3批,每批3瓶。每瓶样品取2 ml,用0.22 mm微孔滤膜滤过备用,用于唾液酸含量测定;另取样品20 ml加入1 980 ml超纯水涡旋混匀,并用0.22 mm微孔滤膜滤过备用,用于腺苷含量测定。
2)混合对照品溶液 分别取腺苷和唾液酸对照品适量,精密称定,加超纯水制成对照品储备液。精密量取上述对照品储备液适量,加超纯水制成0.1 mmol/L的混合对照品溶液,备用。
1.3.4 线性关系考察
将混合对照品溶液进一步稀释成0.25、0.50、1.00、2.00、4.00、8.00、16.0、32.0 μmol/L的混合标准品工作液,分别测定峰面积。分别以腺苷和唾液酸对照品的摩尔浓度为横坐标,峰面积/1 000为纵坐标,进行线性回归。
1.3.5 选择性和检出限
取标准品溶液逐级稀释,以其相应特征离子对作为检测离子对进行检测,并以其相应特征离子对的信噪比3∶1为对应的检出限浓度,检测腺苷和唾液酸检出限。
1.3.6 精密度试验
精密吸取同一混合对照品溶液5 ml,连续进样6针,计算腺苷和唾液酸基峰面积的RSD,考察仪器精密度。
1.3.7 稳定性试验
取同一供试品溶液(批号1707201),于制备后2、4、6、8、12、18、24 h进样分析测定,记录峰面积,考察供试品溶液的稳定型。
1.3.8 重复性试验
取同一批號供试品(批号1707201),制备供试品溶液各6份,进样测定腺苷和唾液酸的峰面积,计算质量分数的RSD值,考察方法的重复性。
1.3.9 加样回收率试验
精密取同一批样品(批号1707201)12份,分别精密加入高、中、低3个浓度水平的对照品溶液,制备“原液”和“稀释液”供试品溶液,并分别测定唾液酸和腺苷的峰面积,计算回收率和RSD值。
2 方法与结果
2.1 线性关系考察
计算得腺苷回归方程为:Y=19.588X+18.628,R=0.995,唾液酸回归方程为:Y=123.77X+56.24,R=0.999,结果表明,腺苷和唾液酸进样浓度在0.25~32 μmol/L与峰面积呈良好的线性关系。
2.2 选择性和检出限
本实验由于使用多反应监测(MRM)模式,具有检测灵敏性高和特异性强等优点[14-15],选择腺苷特征离子对266.1/133.8通道和唾液酸特征离子对308.2/87.1通道检测,无测定干扰,故本方法有很高的灵敏性和特异性。测得的腺苷和唾液酸检出限浓度分别为31.25 nmol/L和3.91 nmol/L。
2.3 精密度试验
腺苷和唾液酸基峰面积的RSD分别为1.39%和1.10%,说明仪器精密度良好。
2.4 稳定性试验
腺苷和唾液酸峰面积的RSD分别为2.85%和1.55%,表明供试品溶液在24 h内稳定性良好。
2.5 重复性试验
腺苷和唾液酸的RSD分别为3.15%和2.29%,说明本方法重复性良好。
2.6 加样回收率试验
腺苷和唾液酸的高浓度的平均加样回收率为101.9%和98.3%,RSD分别为1.48%和1.86%;中浓度的平均加样回收率为104.1%和101.3%,RSD分别为2.45%和0.81%;低浓度的平均加样回收率为98.4%和102.2%,RSD分别为3.82%和1.78%。
2.7 样品测定
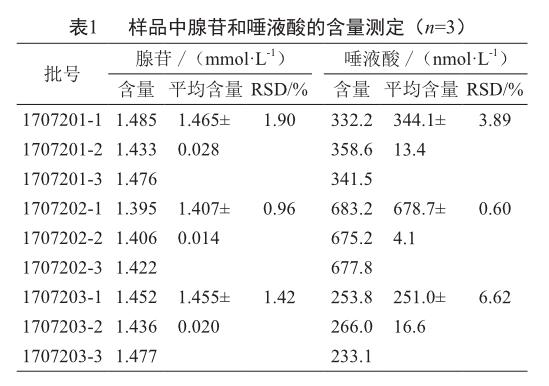
以所建立的方法对3批9份样品进行测定,均检出腺苷和唾液酸特征离子对,其含量计算数据见表1。
3 讨论
本实验考查了甲醇-水和乙腈-水为流动相,结果表明两种流动相对两种化合物均不能进行分离,但甲醇-水溶液为流动相峰形最佳,为改善峰形,比较了加入不同比例甲酸和乙酸对分离效果的影响,结果表明流动相为甲醇-0.1%甲酸水时峰形最佳。由于两个化合物较难进行色谱分离,本实验采用了多反应监测模式(MRM),通过母离子和子离子的双重质量筛选作用后,去除不符合规则离子信号的干扰,大大降低了基质干扰,也避免了腺苷和唾液酸的相互干扰,图1中可以看出,瓜蒌皮注射液与对照品溶液一样,在各个检测通道的基线非常平稳。
腺苷是经美国FDA批准的转复阵发性室上性心动过速(PSVT)的一线药物,它几乎可以终止所有以房室结作为部分折返通路的PSVT[16]。经测定腺苷在瓜蒌皮注射液中含量较高且批次间含量稳定,因此建议增加腺苷为该制剂的质量指标。唾液酸虽然对心血管有一定的积极作用,但含量较低且批次之间含量差异较大,不建议作为指标性成分。唾液酸批次之间含量差异大的原因可能是由于瓜蒌皮注射液中唾液酸的含量较低所致,另外唾液酸为糖蛋白带电荷,瓜蒌皮注射液制备过程中提取条件及离子交换洗脱液的浓度、pH和洗脱速度等均有可能影响唾液酸的含量。
综上所述,本研究首次建立了一种灵敏度高、特异性强、快速和准确的HPLC-MS/MS分析方法,同时测定瓜蒌皮注射液中的腺苷和唾液酸成分的含量,可为进一步完善瓜蒌皮注射液的质量控制提供依据。
参考文献
[1] 桑俊, 雍秀华. 瓜蒌皮注射液辅助治疗冠心病稳定型心绞痛的临床观察[J]. 中国卫生产业, 2013, 10(7): 63.
[2] 莫子明, 张志广, 廖尚宇. 瓜蒌皮注射液治疗冠心病稳定型心绞痛的临床观察[J]. 国际内科学杂志, 2005, 32(8): 357-359.
[3] 刘莉, 牛新萍. 瓜蒌皮注射液对稳定型心绞痛痰瘀互结证血管内皮功能的影响[J]. 中西医结合心脑血管病杂志, 2014, 12(1): 3-5.
[4] 宋宏雁, 班努·库肯. 瓜蒌皮注射液治疗不稳定型心绞痛疗效观察[J]. 现代中西医结合杂志, 2009, 18(31): 3820-3821.
[5] 王群群, 张忠辉. 瓜蒌皮注射液治疗冠心病的临床观察[J]. 心血管病防治知识:学术版, 2016(5): 60-62.
[6] 王辉俊, 柯樱, 叶冠. 瓜蒌皮注射液中化学成分的UPLC/ ESI-QTOF-MS分析[J]. 上海医药, 2017, 38(5): 60-65.
[7] 王辉俊, 柯樱, 叶冠. 活性导向分离瓜蒌皮中具有抗血管紧张素转化酶作用的成分[J]. 中国中药杂志, 2017, 42(16): 3131-3135.
[8] 王辉俊, 柯樱, 叶冠. 活性导向分离瓜蒌皮中具有抗肾素作用的成分[J]. 中草药, 2017, 48(19): 3935-3940.
[9] Sueta D, Kojima S, Izumiya Y, et al. A destabilized case of stable effort angina pectoris induced by low-dose adenosine triphosphate[J]. Intern Med, 2016, 55(22): 3291-3294.
[10] 龙海珊, 刘博. 三磷酸腺苷在突发性耳聋治疗中应用[J].国际耳鼻咽喉头颈外科杂志, 2005, 29(6): 379-381.
[11] Rosales OR, Eades B, Assali AR. Cardiovascular drugs: adenosine role in coronary syndromes and percutaneous coronary interventions[J]. Catheter Cardiovasc Interv, 2004, 62(3): 358-363.
[12] Rivkees SA, Wendler CC. Regulation of cardiovascular development by adenosine and adenosine-mediated embryo protection[J]. Arterioscler Thromb Vasc Biol, 2012, 32(4): 851-855.
[13] Yida Z, Imam MU, Ismail M, et al. N-Acetylneuraminic acid attenuates hypercoagulation on high fat diet-induced hyperlipidemic rats[J/OL]. Food Nutr Res, 2015, 59: 29046. doi: 10.3402/fnr.v59.29046.
[14] 廖梅. 基于UHPLC-QTRAP-MS/MS(MRM)技術的紫草中紫草素和紫草呋喃类成分特征轮廓谱的构建及其应用于紫草资源品质评价研究[D]. 武汉:华中科技大学, 2016.
[15] 侯桂雪, 王全会, 刘斯奇. 多重反应监测(MRM): 靶标蛋白质定量的新方法[J]. 中国科学:化学, 2014, 44(5): 746-752.
[16] 朱文玲. 腺苷在心血管病诊治中的应用前景[J]. 中华心血管病杂志, 2004, 32(10): 948-951.
