硫酸法制备硫酸钡微粒影响因素分析
2018-09-12谢凯旋刘玉敏李彦林
谢凯旋,刘玉敏,梁 泽,李彦林,齐 然,刘 越
(河北科技大学化学与制药工程学院,河北石家庄050018)
硫酸钡是一种重要的无机化工产品,其成本低廉、容易开发,具有吸油值低、硬度低、亮度高、颜色浅、分散性好、无毒害和防酸碱等众多优越性能,因此广泛应用于涂料、油墨、印刷、医学、注塑等领域,现已发展成为一种不可或缺的无机填充(功能)材料[1-2]。近年来,许多研究者探索亚微米级及微米级硫酸钡制备方法以获得小比表面积和低吸油值的大颗粒硫酸钡颗粒。中国对于大颗粒硫酸钡的研究起步较晚,生产的大部分产品与国外相比存在明显差距,研究开发分散性好、粒径均匀的硫酸钡产品势在必行。
目前,制备亚微米级及微米级硫酸钡的方法有物理机械粉碎法[3]和化学法。其中化学法又包括溶析 结 晶 法[4]、EDTA 络 合 沉 淀 法[5-7]、 芒 硝-硫 酸 钠法[8],而采用硫酸法制备硫酸钡的方法文献报道很少。物理法制备硫酸钡微粒工艺简单、成本低,但是该方法在干燥过程中粒子团聚,颗粒粒径不均匀;溶析结晶法产品纯度高,但是粒子容易聚集,粒子大小难以控制;EDTA络合沉淀法是以EDTA为络合剂,可以制备较大粒径的硫酸钡微粒,但是反应过程中加入聚乙二醇(PEG)后溶液黏稠,产品分离困难;芒硝-硫酸钠法技术较为成熟,以重晶石和芒硝为原料,但是此法能耗较大,且粒径分布范围广,产品质量偏低。利用硫酸法制备硫酸钡微粒过程中,由于粒子具有较小的比表面能,容易发生聚集,从而使产品粒径分布不均匀。同离子效应可以降低沉淀物的过饱和度,使其不至于瞬间生成很多细小晶核,有利于晶体的成长,制得粒径分布均匀的大颗粒硫酸钡晶体。笔者采用硫酸法中加入浓盐酸,利用其同离子效应制备大颗粒的硫酸钡微粒。
1 实验部分
1.1 实验原料
浓硫酸(分析纯,质量分数为98%);浓盐酸(分析纯,质量分数为 37.5%);氯化钡(分析纯,BaCl2·2H2O)。
1.2 实验过程
实验装置为180 mL内衬聚四氟乙烯晶化釜及自制搅拌釜反应器。称取5份2.46 g浓硫酸,分别加入 0.00、6.15、9.84、17.22、22.14 g 浓 盐 酸 中 , 配 制m(H2SO4)∶m(HCl)分别为 1∶0.0、1∶2.5、1∶4.0、1∶7.0、1∶9.0的浓硫酸-浓盐酸混酸溶液,将混酸溶液和一定量的氯化钡(BaCl2·2H2O)固体加入晶化釜中,然后置于搅拌釜反应器中,在高温动态条件下反应,过滤洗涤后在80℃干燥5~6 h,即得硫酸钡微粒。
1.3 反应原理
沉淀的形成如同溶液结晶一样分为3个步骤[9-10]:过饱和度的形成、晶核的形成和晶体的成长。在反应结晶(沉淀)过程中较小的晶粒可能会发生聚并现象,原因在于系统中的固体倾向于向表面自由能最小的方向发展,粒子在结晶过程中发生聚结是很正常的,会在一定程度上改变晶体的粒度分布。聚结过程可大致分3步描述:一是粒子间发生碰撞;二是通过分子间相互作用力相互黏附;三是通过化学键聚结,通过聚结过程晶体长大,制备大颗粒沉淀晶体。硫酸法制备硫酸钡反应方程式:
BaCl2·2H2O+H2SO4
→BaSO4+2HCl+2H2O (1)
1.4 产品表征
采用S4800-Ⅰ型冷场发射高分辨率扫描电镜(SEM)观察颗粒形貌;采用D/max-2500PC X射线衍射仪(XRD)分析晶体结构;采用NOVA2000型比表面积分析仪(BET)测定产物比表面积;采用SCP-106激光粒度分析仪测定产物粒径。
2 结果与讨论
2.1 m(H2SO4)∶m(HCl)对硫酸钡粒度的影响
固定条件:反应温度为120℃、反应时间为36 h。考察浓硫酸与浓盐酸质量比对硫酸钡产品粒径和比表面积的影响,结果见图1。由图1看出,随着HCl用量增大,硫酸钡粒径先增大后减小、比表面积先减小后增大;加入盐酸制备硫酸钡的平均粒径大于不加盐酸制备硫酸钡的平均粒径。这可能是因为,盐酸中Cl-的引入使BaCl2固体溶解度降低,Ba2+浓度较不加盐酸时降低,反应生成沉淀的速率减小,从而降低沉淀物的过饱和度,使其不至于瞬间生成很多细小晶核,有利于晶体的成长,制得了较大颗粒的硫酸钡晶体。但是当反应体系中浓硫酸配比较大时,浓硫酸电离出的H+抑制了盐酸的同离子效应,使得反应体系中沉淀过饱和度增大,沉淀成核速率增大,制得小晶核数量增多,产品平均粒径有所下降。由图1 看出,当 m(H2SO4)∶m(HCl)=1∶4 时,制得的硫酸钡粒径最大。

图 1 硫酸钡粒径、比表面积随 m(H2SO4)∶m(HCl)的变化
2.2 反应时间对硫酸钡粒度的影响
固定条件:m(H2SO4)∶m(HCl)=1∶4、反应温度为120℃。考察反应时间对硫酸钡粒径和比表面积的影响,结果见图2。由图2看出,随着反应时间增加,硫酸钡粒径先增大后减小、比表面积先减小后增大。反应原料在动态条件下反应,表面能小的粒子碰撞,受相互作用力的吸引黏附在一起,制得粒径均匀的产品;二级成核过程,随着反应时间延长,晶体成长,粒径增大;但是反应时间超过36 h以后,晶体会微溶于硫酸,表面的晶体破裂使得粒径变小。因此,反应时间为36 h时制得的硫酸钡粒径最大。
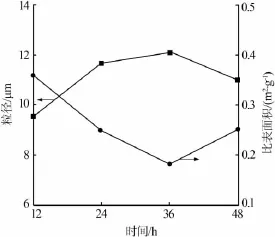
图2 硫酸钡粒径、比表面积随反应时间的变化
2.3 反应温度对硫酸钡粒度的影响
固定条件:m(H2SO4)∶m(HCl)=1∶4、反应时间为36 h。考察反应温度对硫酸钡粒径和比表面积的影响,结果见图3。由图3看出,硫酸钡粒径随反应温度的升高先增大后减小、比表面积先减小后增大。晶体的生长过程是,待结晶的组分借助离子(或分子、原子)扩散效应穿过靠近晶体表面的静置液层由溶液中转移到晶体表面,扩散到晶体表面的离子(或分子、原子)嵌入晶体表面进行反应。结晶温度较低时,扩散传质速率较表面反应速率增加幅度大,结晶过程属于表面反应控制,小晶体的生长比大晶粒的生长慢;而结晶温度较高时,表面反应速率较扩散传质速率增加幅度大,结晶过程通常属于扩散传质控制,小晶体的生长快于大晶体的生长。所以,当温度较低时,主要是大晶体的生长,晶体越来越大;而当温度较高时,主要是小晶体的生长,晶体平均粒径有所下降。因此,当反应温度为120℃时,制得的硫酸钡粒径最大。
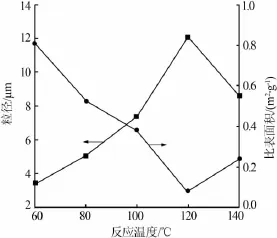
图3 硫酸钡粒径、比表面积随反应温度的变化
2.4 机理分析
两种含有相同离子的盐(或酸、碱)溶于水时,它们的溶解度都会降低,这种现象叫做同离子效应。笔者研究的反应体系中发生式(1)化学反应,同时由于反应体系加入饱和盐酸,还会出现式(2)~(5)过程,其中式(4)过程产生氯离子,由于同离子效应式(3)过程氯化钡的电离平衡向左移动,使其溶解度降低,溶液中钡离子含量较只加纯硫酸体系少很多,使反应生成沉淀的速率减小,从而降低沉淀物的过饱和度[11],有利于硫酸钡晶体的成长,制得微米级颗粒的硫酸钡晶体。


图 4为未加盐酸(a)和加盐酸(b)条件下,在120℃反应36 h制得硫酸钡XRD谱图。由图4看出,两种样品的衍射峰都与正交晶系BaSO4的(101)(111) (021) (121) (002) (212) 晶 面 衍 射 峰 对 应(JCPDS卡片24-1035)。加盐酸制备的硫酸钡较不加盐酸制备的硫酸钡各个晶面的衍射峰强度增加,其中(101)(002)晶面衍射峰明显增强,说明加入盐酸制得的硫酸钡各个晶面都有不同程度的生长,尤以(101)(002)晶面显露的比例最多。通过计算可知,未加盐酸和加盐酸XRD谱图的I101/I002由0.84降低到 0.66,说明(002)晶面的强度大于(101)晶面的强度,晶体沿着极性较弱的(002)晶面方向生长,同时说明弱极性的(002)晶面显露较多,使得硫酸钡表面的极性减弱,颗粒分散性提高[12]。而且,此时的硫酸钡特征峰格外尖锐,强度较不加盐酸时大大增加,这也从侧面验证了晶粒的尺寸变大,发育逐渐完全。与图5的SEM照片吻合。

图4 未加盐酸和加盐酸制得硫酸钡XRD谱图

图5 未加盐酸和加盐酸制得硫酸钡SEM照片
2.5 适宜条件下制得硫酸钡的性能
在 m(H2SO4)∶m(HCl)=1∶4、反应温度为 120 ℃、反应时间为36 h条件下制备硫酸钡,其粒径分布见图6。由图6看出,硫酸钡粒径分布窄,平均粒径为10.52 μm左右,与图5的SEM照片基本一致。表1为制备的硫酸钡主要质量指标检测结果并与国家标准对比。由表1看出,硫酸钡主要质量指标均满足GB/T2899—2008《工业沉淀硫酸钡》中优等品要求。
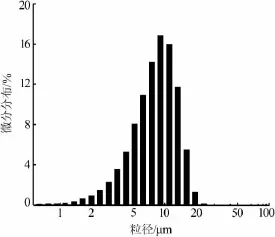
图6 硫酸钡粒径分布图

表1 适宜条件下制得硫酸钡主要质量指标检测结果并与国家标准比较
3 结论
采用硫酸法制备硫酸钡,加入浓盐酸后利用同离子效应可制得微米级硫酸钡粒子,比不加浓盐酸时制得的硫酸钡颗粒粒径大、分布窄。加入浓盐酸后晶体沿着极性较弱的(002)晶面方向生长,使得硫酸钡表面的极性减弱、颗粒分散性提高。在搅拌反应釜中在动态条件下,在 m(H2SO4)∶m(HCl)=1∶4、反应温度为120℃、反应时间为36 h条件下,得到最大粒径的硫酸钡颗粒,颗粒平均粒径为10.52 μm。
