肺腺癌中Napsin A、SP-A蛋白的表达和EGFR基因突变及临床相关性
2018-09-04王学文郝佳洁孙晓男王明荣贾雪梅
王学文,郝佳洁,周 菲,孙晓男,常 晨,蔡 岩,徐 昕,王明荣,贾雪梅
肺腺癌是肺癌的一种,且是最常见的一种病理类型。在中国,肺癌是发病率最高的肿瘤也是癌症死因之首。根据其组织学特点,肺癌可分为非小细胞肺癌(non-small cell lung cancer, NSCLC)和小细胞肺癌,肺腺癌属于NSCLC[1]。不同类型的肺癌治疗方法不同,准确判断肿瘤的病理分型非常重要。天冬氨酸蛋白酶A(novel aspartie proteinase A, Napsin A)是天门冬氨酸蛋白酶家族成员,参与表面活性物质蛋白的水解过程,起到诱导蛋白前体成熟、维持肺的形态及正常功能的作用。Napsin A 在Ⅱ型肺泡上皮和原发性肺腺癌中有特异性表达[2]。表面活性蛋白A(surfactant protein A, SP-A)是肺表面活性物质重要组成成分,属于C型凝集素家族重要成员,在维持表面活性剂的稳定和防御呼吸道病原体中起着重要的作用[3]。Napsin A蛋白和SP-A蛋白常用于肺腺癌的诊断和鉴别诊断[4-6]。表皮生长因子受体(epidermal growth factor receptor, EGFR)是人表皮生长因子受体(human epidermal growth factor receptor, HER)家族成员之一,由胞外区、跨膜区和胞内区三部分组成。EGFR信号通路对细胞的生长、增殖和分化等生理过程发挥重要的作用。EGFR基因突变状态是晚期NSCLC最重要的疗效预测因子和选择治疗方式的分子指标,是肺癌靶向药物治疗的靶点之一[7-8]。该文研究了肺腺癌组织中Napsin A蛋白和SP-A蛋白的表达及EGFR基因突变情况,分析其与临床病理特征及预后的关系,以期为肺腺癌的诊断和预后提供帮助。
1 材料与方法
1.1病例资料本研究使用的216例肺腺癌组织以及同一患者手术切缘形态学正常的肺组织均为临床诊断后剩余的标本,取自2005年~2012年于中国医学科学院肿瘤医院接受手术治疗的原发肺腺癌患者,所有患者签署了知情同意书,该项研究经中国医学科学院肿瘤医院伦理委员会批准(审批号12-098/632)。所有患者手术前未经过放疗和化疗,均经组织病理学诊断为肺腺癌。其中男113例,女103例;年龄32~78岁,中位年龄58.5岁。T1期29例,T2期125例,T3期38例,T4期24例。淋巴结转移146例,淋巴结转移情况不详1例。肿瘤分期按照UICC第7版TNM分类标准进行,Ⅰ期48例,Ⅱ期43例,Ⅲ期109例,Ⅳ期16例。其中有完整随访记录病例210例,死亡病例48例,随访时间1~63个月,中位随访时间25个月。
1.2主要试剂与仪器鼠抗人Napsin A单克隆抗体(克隆号IP64)(北京中杉金桥生物技术有限公司);鼠抗人SP-A单克隆抗体(克隆号PE10)(福州迈新生物技术开发有限公司);PV9000免疫组织化学检测试剂盒及浓缩型DAB显色试剂盒(北京中杉金桥生物技术有限公司);冰冻组织DNA提取试剂盒(德国QIAGEN公司);PCR试剂盒(日本TaKaRa公司);PCR仪(美国ABI公司);电泳仪(美国Bio-rad公司);NanoDrop 2000C紫外分光光度计(美国Thermo公司)。
1.3组织微阵列制备将取得的组织标本进行常规石蜡包埋、切片和HE染色,经过显微镜阅片,每例针对手术切缘取2个点(正常肺组织形态)以及各区域肿瘤组织取3个点(共5个点),并将相应组织点在蜡块上标记。利用穿刺针将供体蜡块转移至受体蜡块,制作成组织微阵列。切片厚度为4 μm。
1.4免疫组化组织微阵列切片常规脱蜡至水,磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤,3%过氧化氢封闭内源性过氧化物酶15 min,高压抗原修复,37 ℃一抗孵育1 h,PBS洗,依次滴加PV9000免疫组化试剂盒中的聚合物辅助剂和酶标山羊抗鼠/兔IgG聚合物,37 ℃下分别孵育20 min和30 min。二氨基联苯胺(diaminobenzidine, DAB)显色,苏木精复染,自来水返蓝,梯度乙醇脱水,中性树胶封片。
1.5冰冻组织基因组DNA提取从-80 ℃冰箱中取出组织,切取肺腺癌肿瘤组织及手术切缘组织各25 mg,分别置于1.5 ml的Eppendorf管中,提取基因组DNA操作流程按QIAamp DNA Mini试剂盒(Cat No.51304)说明书进行。
1.6EGFR基因目的片段PCR扩增及测序使用NanoDrop 2000C紫外分光光度计检测基因组DNA的质量和浓度,并用无DNase水稀释至20 ng/μl作为模版。PCR扩增反应体系:10×PCR缓冲液2 μl,dNTP混合液(2.5 mmol/L)1.6 μl,引物(10 μmol/L)1 μl,模板DNA(20 ng/μl)1 μl,rTaq DNA聚合酶0.2 μl,去离子水14.2 μl。反应条件为:98 ℃预变性5 min;98 ℃变性10 s,60 ℃退火5 s,72 ℃延伸50 s,30个循环;最后72 ℃延伸8 min。EGFR基因19外显子引物序列:F:5′-GCAATATCAGCCTTAGGTGCGGCTC-3′,R:5′-CATAGAAAGTGAACATTTAGGATGTG-3′;EGFR基因21外显子引物序列:F:5′-CTAACGTTCGCCAGCCATAAGTCC-3′,R:5′-GCTGCGAGCTCACCCAGAATGTCTGG-3′。引物由北京天一辉远生物技术有限公司合成。PCR产物经1%琼脂糖凝胶电泳鉴定后,送至北京天一辉远生物技术有限公司进行测序。
1.7免疫组化结果及基因突变结果判断参照相应文献[9]及目前比较成熟的美国FDA推荐的免疫组化结果评分系统(Dako, HercepTestTMInterpretation Manual),制定评分标准。免疫组织化学染色以细胞质或细胞膜出现棕色状染色为阳性,对阳性细胞染色强度和阳性细胞百分比进行评分。按染色强度评分:无染色0分,浅棕色1分,中度着色2分,深棕色3分。按阳性细胞百分比评分:阳性细胞百分比<10%为1分,10%≤阳性细胞百分比<50%为2分,50%≤阳性细胞百分比<80%为3分,阳性细胞百分比≥80%为4分。根据阳性细胞染色强度和阳性细胞百分比评分之积进行总体评分。每例3个区域肿瘤位点分别进行评分,取3个肿瘤位点的平均分为最终评分。最终评分<1分为阴性,≥1分定义为阳性。EGFR基因突变的判断,使用BioEdit软件读取序列图谱和碱基序列。癌组织和配对的手术切缘组织序列进行对比,并将结果在NCBI网站进行BLAST对比,最终确定标本中EGFR基因是否突变。
1.8统计学处理采用软件SPSS 23.0进行统计学分析。计数资料采用χ2检验、配对χ2检验,采用Kaplan-Meier方法分析Napsin A蛋白和SP-A蛋白表达情况与患者术后总生存之间的关系,并通过Cox比例风险模型分析不同临床病理参数和Napsin A、SP-A蛋白表达情况对肺腺癌患者术后生存时间的影响。检验水准为α=0.05。
2 结果
2.1NapsinA蛋白在肺腺癌组织中的表达与临床病理特征的关系免疫组化结果显示,Napsin A蛋白在肿瘤组织中阳性表达位于细胞质和细胞膜,阳性率为74.5%(161/216);手术切缘肺组织中,阳性表达位于肺泡Ⅱ型上皮细胞的细胞膜和细胞质(图1)。Napsin A蛋白表达情况与肺腺癌患者的年龄、T分期、淋巴结转移等临床病理特征无统计学相关性(表1)。
2.2SP-A蛋白在肺腺癌组织中的表达与临床病理特征的关系免疫组化结果显示,SP-A蛋白在肿瘤组织中阳性表达位于细胞质和细胞膜,阳性率为34.3%(74/216),在手术切缘组织中不表达(图2)。SP-A蛋白表达与肺腺癌患者的年龄、T分期、淋巴结转移等临床病理特征无统计学相关性(表1)。

图1 Napsin A蛋白在肺腺癌组织和手术切缘组织的表达 ×200
A:手术切缘组织中Ⅱ型肺泡细胞中等阳性;B:癌组织弱阳性;C:癌组织中等阳性;D:癌组织强阳性
2.3NapsinA和SP-A蛋白与肺腺癌患者预后的相关性Kaplan-Meier生存分析显示,Napsin A蛋白阳性的肺腺癌患者生存时间长于Napsin A蛋白阴性患者(P=0.003)(图3),SP-A蛋白表达情况与术后生存时间无统计学相关性。Cox多因素回归分析显示,Napsin A蛋白表达是肺腺癌患者预后良好的一个独立预测因素(P=0.002),见表2。

图2 SP-A蛋白在肺腺癌组织和手术切缘组织的表达 ×200
A:手术切缘组织中阴性;B:癌组织弱阳性;C:癌组织中等阳性;D:癌组织强阳性

图3 Napsin A蛋白表达与肺腺癌患者术后生存时间的关系

临床病理指标nNapsin A蛋白阳性例数阴性例数χ2值P值SP-A蛋白阳性例数阴性例数χ2值P值年龄(岁) ≥6010076240.2100.64732680.4220.516 <6011685314274性别 男11379342.6710.10236770.6060.436 女10382213865吸烟情况 是8865230.0350.43629590.1120.738 否12896324583T分期 T1~T2154119352.1160.146541000.1550.694 T3~T46242202042淋巴转移 有147110370.0210.88550970.0120.912 无6951182445临床分期 Ⅰ~Ⅲ199146531.1250.289651342.8590.091 Ⅳ1715298

表2 肺腺癌患者术后生存时间的Cox回归分析
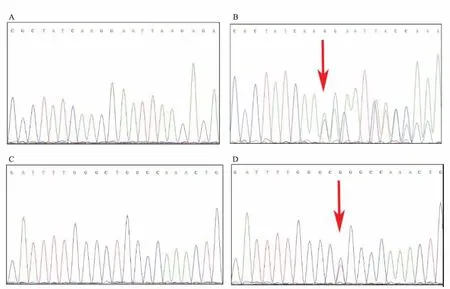
图4 肺腺癌组织中EGFR基因19外显子和21外显子野生型与突变型序列峰图
2.4EGFR基因突变情况与肺腺癌患者临床病理特征的关系45例肺腺癌组织EGFR基因突变率为31.1%(14/45),其中19外显子突变率为16.3%(7/43),均为缺失突变。21外显子突变率为17.8%(8/45),均为L858R点突变(图4)。没有19外显子与21外显子同时发生突变的病例。EGFR基因突变与肺腺癌患者的年龄、T分期和淋巴结转移情况等临床病理特征无统计学相关性(表3)。
2.5肺腺癌组织中NapsinA和SP-A蛋白的表达、EGFR基因突变的相关性Napsin A蛋白在肿瘤组织中的阳性率为74.5%(161/216),SP-A蛋白在肿瘤组织的阳性率34.3%(74/216)。Napsin A蛋白在肺腺癌中的阳性率高于SP-A蛋白,差异有统计学意义(P<0.001),见表4。Napsin A蛋白表达阳性者,SP-A蛋白的阳性率为42.9%(69/161);Napsin A蛋白表达阴性者,SP-A蛋白的阳性率为9.1%(5/55)。

表3 EGFR基因突变情况与肺腺癌患者临床病理特征的关系(n)

表4 Napsin A、SP-A蛋白阳性率分析(n)
Napsin A蛋白阳性者EGFR基因突变率为41.7%(15/36),Napsin A蛋白阴性者,没有病例发生EGFR基因突变。SP-A蛋白阳性者EGFR基因突变率为33.3%(5/15),SP-A蛋白阴性者EGFR基因突变率为33.3%(10/30),差异无统计学意义。Napsin A蛋白表达阳性病例EGFR基因突变率较表达阴性病例突变率高,差异有统计学意义(P=0.020),见表5。
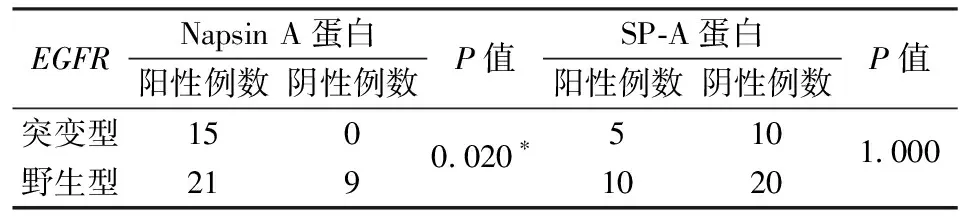
表5 Napsin A、SP-A蛋白的表达与EGFR突变的相关性(n)
*Fisher精确检验
3 讨论
EGFR突变主要发生于18~21外显子,其中19外显子缺失突变和21外显子点突变是最常见的[13-14]。该研究中EGFR基因突变的患者,Napsin A蛋白表达均为阳性。尽管该相关性还需扩大样本量进一步验证,但作为一个重要提示,对Napsin A蛋白阳性的患者可进行EGFR基因突变的检测,为应用EGFR靶向药物进行个体化治疗提供依据,以期提高肺癌患者的生存质量。
目前在肺癌的早期诊断方面并没有很理想的方法,肺癌的恶性程度高,肿瘤进展迅速。有文献[15]报道,肺癌确诊时已有40%的患者发生远处转移,错过了最佳的手术时机。肺癌的治疗方法有手术、放疗、化疗及靶向药物治疗等。肺癌患者临床诊疗中首先要确定肺癌的亚型分类,才能采取相应的治疗方法。免疫组化技术和基因检测技术常用来确定肿瘤的亚型和分子分型。该研究结果提示,Napsin A蛋白阳性表达有助于肺腺癌亚型的诊断,Napsin A蛋白阳性表达的肺腺癌患者其预后较好。而且,Napsin A蛋白阳性患者检测出EGFR基因突变的概率较高,有可能应用于基于EGFR基因突变的肺癌靶向治疗。
