清气化痰汤对哮喘小鼠肺组织TLR4和MUC5AC表达影响
2018-09-04罗贞清李圣钻
陈 竹, 彭 玉,陶 琼, 吴 敏, 罗贞清,李圣钻
支气管哮喘(简称哮喘)是全球威胁公众健康的常见慢性呼吸道疾病,其发病率呈逐年增高趋势[1]。儿童是哮喘的高发人群,近年来我国0~14岁儿童哮喘患病率平均为3.02%,较十年前增加了53.3%[2]。迄今哮喘的发病机制仍未完全明确,哮喘发作时痰液易生难消,成为中西医治疗中的难点。清气化痰汤临床运用能有效缓解痰热壅肺所致咳嗽、痰鸣诸症。前期的研究[3]证实该方能抑制炎症介质的释放,减少肺组织中炎性渗出,减轻肺组织损伤,但减少哮喘痰液生成的具体机制不明确。基于TLRs在哮喘的发生发展中起着较为重要的作用[4],该实验通过对小鼠血清和支气管肺泡灌洗液(broncho alveolar lavage fluid,BALF)中多种炎性介质的检测、肺组织中TLR4基因和蛋白表达、黏蛋白MUC5AC基因和蛋白的表达观察,探讨清气化痰汤对哮喘模型小鼠气道黏液高分泌表达的干预机制,为临床运用清气化痰汤治疗小儿哮喘提供依据。
1 材料与方法
1.1材料
1.1.1实验动物 BALB/c小鼠,雌性,4~6周龄,SPF级,合格证号SYXK(黔)2012-001,购自贵州省实验动物工程中心。
1.1.2清气化痰汤制备 清气化痰汤由胆南星、全瓜蒌、法夏、浙贝、枳壳、陈皮、茯苓、杏仁等10味中药组成,用该方540 g克加水900 ml 煎煮,滤出药液,药渣加500 ml再煎煮滤出,合并两次滤液浓缩至100 ml。
1.1.3试剂和试剂盒 2% Aluminium Hydroxide Gel Adjuvant购自美国Invivogen公司(Lot #5113);卵清白蛋白(albumin from chicken egg white, OVA)购自美国Sigma公司(批号1001988500);注射用地塞米松磷酸钠购自马鞍山丰原制药有限公司(批号150512-1);小鼠肿瘤坏死因子(tumor necrosis factor-α,TNF-α)(JEM-12)、白介素(interleukin,IL)-4(JEM-04)和IL-5(JEM-03)定量分析酶联免疫检测试剂盒购自安徽巧伊生物科技有限公司;小鼠IL-13定量分析酶联免疫检测试剂盒购自联科生物科技有限公司(221341235);动物组织总RNA提取试剂盒购自天根生化科技(北京)有限公司(#03901);Prime ScriptTMRT reagent Kit 和SYBR Premix Ex TaqTMⅡ购自日本TaKaRa公司;兔抗TLR4多克隆抗体(BA1717)、兔抗MUC5AC多克隆抗体(BA3293)购自武汉博士德生物工程有限公司;GTVisionⅢ抗鼠/兔通用型免疫组化检测试剂盒购自基因科技(上海)有限公司(批号2015121601)。
1.2方法
1.2.1哮喘小鼠模型的建立及实验分组 根据文献[5]的方法并予以改进建立哮喘模型:第1、8、15天腹腔注射OVA及氢氧化铝凝胶混合液0.2 ml(内含OVA 60 μg及2.25 mg氢氧化铝凝胶)致敏;第21天开始用5%OVA溶液8 ml行超声雾化,每次30 min,连续雾化5 d进行激发。实验分组,45只小鼠分为5组,每组9只:① 正常组(CON组),用生理盐水代替OVA进行致敏和雾化,不给药;② 哮喘组( MOD组),按上述方法进行致敏和激发,不给药;③ 地塞米松组(TRE组),按上述方法进行致敏和激发,于每次激发前30 min腹腔注射地塞米松(0.5 mg/kg);④ 清气化痰汤治疗组(X1组),按上述方法进行致敏和激发,于每次激发前30 min灌胃给予清气化痰汤0.01 ml/g;⑤ 清气化痰汤和地塞米松联合治疗组(X2组),按上述方法进行致敏和激发,于每次激发前30 min灌胃给予清气化痰汤0.01 ml/g,腹腔注射地塞米松(0.25 mg/kg)。于治疗后第6天处死小鼠3只/组,分别称小鼠体重和肺组织重量并记录;同时摘眼球取血并制备血清冻存于-20 ℃;从气管注射无菌生理盐水 0.5 ml入肺,抽吸3次后将抽出液体即BALF冻存于-20 ℃;取右下肺叶置于4%多聚甲醛中固定;余下肺组织冻存于-80 ℃。各组小鼠不再激发,隔天给予相应药物1次,持续5次后,处死小鼠,留存标本及相应检查同前。
1.2.2肺组织TLR4和MUC5AC mRNA的检测 采用Real-time PCR法,TLR4上游引物:5′-CAGCAAAGTCCCTGATGACA-3′;下游引物:5′-AGAGGTGGTGTAAGCCATGC-3′;MUC5AC上游引物:5′-ACACCGCTCTGATGTTCCTCACC-3′;下游引物:5′-ATGTCCTGGGTTGAAGGCTCGT-3′;GAPDH上游引物:5′-CATGGCCTTCCGTGTTCCTA-3′;下游引物:5′-GCGGCACGTCAGATCCA-3′。每个样品各取约20 mg肺组织,参照说明书提取总RNA,逆转录合成cDNA。以2 μl cDNA为模板行Real-time PCR检测。反应条件:预变性(95 ℃,30 s),PCR反应(40个循环,95 ℃,5 s;52 ℃,30 s)。确定Real-time PCR的扩增曲线和融解曲线,记录各组的Ct值。分别以GDPDH为内参,计算各组样本中MUC5AC、TLR4基因的表达量,并对表达量的比值(2-ΔΔCt)进行分析。
1.2.3肺组织TLR4和MUC5AC蛋白的检测 常规方法制备肺组织石蜡切片,采用免疫组化SP法进行操作。阳性部位成棕褐色。采用Image-Pro Plus图像分析软件进行图像分析,取平均积分光密度值表示目的蛋白的表达水平。
1.2.4血清及BALF中TNF-α、IL-4、IL-5和IL-13因子的含量检测 根据试剂盒说明书方法进行,根据检测结果绘制标准曲线,计算各样品中指标因子的含量,制作柱形图。

2 结果
2.1小鼠肺组织TLR4和MUC5ACmRNA的表达qRT-PCR的结果显示,MOD组肺组织TLR4基因在治疗第5天或15天时较CON组上调,而治疗TRE组、X1组和X2组可下调TLR4基因的表达;MOD组肺组织MUC5AC 基因表达在治疗第5天或15天时均明显增高,治疗TRE组、X1组和X2组可下调MUC5AC基因的表达,见图1。

图1 清气化痰汤对哮喘小鼠肺组织TLR4和MUC5AC mRNA表达的影响
2.2小鼠肺组织TLR4和MUC5AC蛋白的表达TLR4蛋白表达在上皮细胞表面,MUC5AC蛋白主要表达在支气管上皮细胞,存在于胞质内,阳性染色表现为棕褐色颗粒。治疗5 d或15 d后,MOD组肺组织TLR4蛋白表达强于TRE组、X1组和X2组,以TRE组和X2组显著(P<0.01)(图2);MOD组肺组织MUC5AC 蛋白表达明显高于CON组,而TRE组、X1组和X2组肺组织这两种蛋白的表达均下调,以TRE组和X2组下调显著(P<0.01)(图3)。
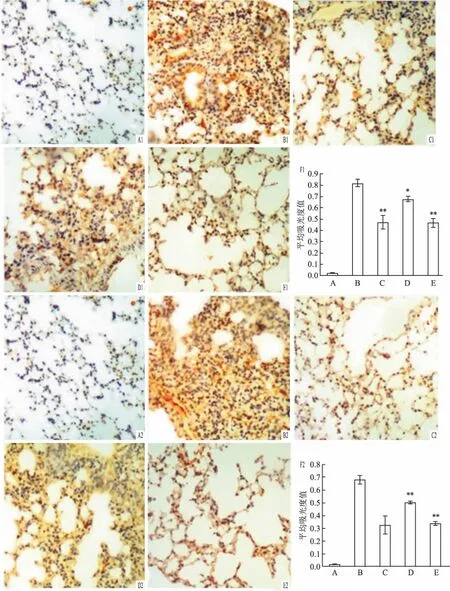
图2 清气化痰汤对哮喘小鼠肺组织TLR4蛋白表达的影响 ×200

图3 清气化痰汤对哮喘小鼠肺组织MUC5AC蛋白表达的影响 ×200
2.3小鼠血清中TNF-α、IL-4、IL-5和IL-13因子的含量在治疗后第5天和第15天时,MOD组血清的TNF-α、IL-4、IL-5和IL-13因子的含量均显著高于CON组,TRE组和X2组的血清的TNF-α、IL-4、IL-5和IL-13因子的含量显著下调,单独应用清气化痰汤的X1组血清的TNF-α、IL-4、IL-5亦较MOD组的含量降低(P<0.05)。以上下调作用以清气化痰汤和地塞米松联用的X2组更为显著(P<0.01)(图4)。
2.4小鼠BALF中TNF-α、IL-4、IL-5和IL-13因子的含量在治疗后第5天和第15天时,MOD组BALF中的TNF-α、IL-4、IL-5和IL-13因子的含量均较CON组明显增高,TRE组和X2组的血清的TNF-α、IL-4、IL-5和IL-13因子的含量下调,单独应用清气化痰汤的X1组血清的IL-5和IL-13亦较MOD组的含量降低(P<0.05)。以上下调作用以清气化痰汤和地塞米松联用的X2组更为显著(P<0.01)(图5)。
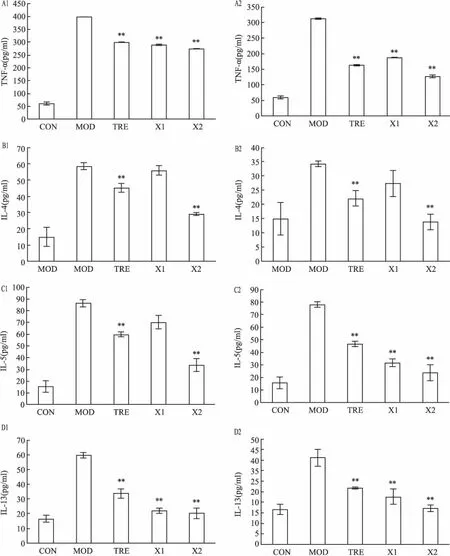
图4 清气化痰汤对哮喘小鼠血清中的TNF-α、IL-4、IL-5和IL-13因子含量的影响

图5 清气化痰汤对哮喘小鼠BALF中的TNF-α、IL-4、IL-5和IL-13因子含量的影响
3 讨论
支气管哮喘,是一种以慢性气道炎症和气道高反应性为特征的异质性疾病[6],气道黏液高分泌是其重要的病理特征。气道黏液(mucus)由气道杯状细胞和黏膜下腺体分泌细胞生成,杯状细胞是产生黏液的重要细胞,它将粘蛋白快速分泌到气道的表面,使气道内持续过度分泌黏液,导致并加重呼吸道气流阻塞,加速肺功能下降。同时,气道储留的黏液为细菌生长提供了良好培养基,易导致呼吸道感染的发生并难以控制[7]。MUC5AC是由杯状细胞产生,气道上皮MUC5AC蛋白的含量和MUC5AC mRNA代表气道黏液分泌的程度。研究显示哮喘气道杯状细胞增生明显,同时肺组织中的MUC5AC蛋白的含量和MUC5AC mRNA也明显升高,MUC5AC被认为是哮喘气道杯状细胞增生和分泌亢进的主要标志,是影响哮喘病情发展及其预后的独立危险因素[8-9]。
TLRs介导天然免疫并连接获得性免疫,TLRs 基因多态性与哮喘个体的易感性和严重程度密切相关[10],往往决定了个体对过敏原的敏感性[11]。TLRs在气道炎症的调节中有重要意义,其中TLR4承担了重要作用。实验证明,TLR4主要分布在气道上皮细胞、肺泡巨噬细胞等[12],能激发一系列信号通路,促进炎症的发生及加重[13]。研究[14]显示,TLR4 基因多态性特征中TLR4/TRIF信号通路可激活NF-κB,导致炎症因子如TNF-α、IL-4、IL-6等炎症因子增加,上调粘蛋白基因转录或刺激气道上皮杯状细胞和黏膜下腺体细胞增生,使气道黏液分泌增加,并引起严重的气道炎症和气道重塑。
痰易生难消是目前治疗哮喘的一个难点,中医认为痰伏储于气道是哮喘发生和加重的病理基础。结合现代医学对哮喘因病机的认识,推测哮喘“痰饮伏肺”的中医病理特征与现代医学哮喘气道炎症、气道黏液高分泌表达存在必然的联系。本实验结果显示,清气化痰汤可在基因和蛋白水平下调TLR4的表达,使血清和BALF中的促炎因子TNF-α、IL-4、IL-5和IL-13的含量均下调,提示清气化痰汤可通过调节TLR4的表达,干预哮喘小鼠的免疫应答,继而影响炎症因子的释放,减轻哮喘小鼠气道炎症反应。
同时,研究显示MOD组肺组织TLR4、MUC5AC基因及蛋白的表达水平在治疗第5天或第15天时较CON组上调,且随哮喘时间延长而显著增加,说明哮喘时气道黏液存在高分泌,与文献[15]报道一致,这与中医认为“夙痰伏于肺,遇触即发”的病机有一致性。治疗TRE组、X1组和X2组可下调MUC5AC基因的表达,说明清气化痰汤可通过下调肺组织MUC5AC的基因和蛋白表达,缓解气道黏液高分泌。
本研究结果表明,清气化痰汤可能通过TLR4/ TRIF信号通路抑制NF-κB,下调TLR4和MUC5AC的表达以拮抗哮喘气道炎症反应、减轻气道黏液高分泌,从而有效缓解哮喘发作时痰液壅盛所致的痰多、咳嗽、喘息等症。但研究显示清气化痰汤不论是在干预炎症因子的释放还是在减轻气道黏液高分泌方面与地塞米松联用时具有协同作用,其作用机制需进一步研究。
名老中医药专家学术思想和临床经验是我国传统医学的精髓,也是现代中医文化传承的重要内容。很多名老中医经验方的临床疗效确切,但由于其作用机制未阐明,限制和束缚了临床的广泛运用。探讨清气化痰汤多途径、多环节、多靶点的治疗作用,研究其在减少气道黏液生成,减轻气道重塑的作用机制,不仅为名老中医经验方的临床应用提供理论依据,也为治疗儿童哮喘提供了新的治疗思路和手段。
