成骨细胞特异性识别多肽对人成骨细胞黏附和迁移作用的实验研究
2018-09-04宋婷婷王泽华高启坤庄艳琴吴齐越吴明月
宋婷婷,王泽华,高启坤,庄艳琴,吴齐越,吴明月
牙种植体负重能力主要取决于良好的种植体-骨界面,普遍认为接触成骨是该界面的理想状态[1-2],这种接触方式能使周围骨组织受力均匀, 保证种植体的长期稳定[3-4]。成骨细胞作为锚合依赖性细胞,其在种植基材表面的黏附、丛集是接触成骨的关键[5]。因此,如何提高成骨细胞在种植体表面黏附、增殖、聚集等成骨活性, 一直是该领域研究的热点。该实验以课题组前期研究获得的成骨细胞特异性识别多肽为研究对象,探讨该多肽在特定浓度下对人成骨细胞黏附、迁移作用的影响,旨为该特异性多肽对成骨细胞成骨活性的影响机制研究提供实验基础。
1 材料与方法
1.1试剂与仪器DMEM培养基、RPMI 1640培养基、胎牛血清、胰蛋白酶(杭州四季青公司);成骨细胞特异性识别多肽(上海科肽生物科技有限公司);SW-CJ-2F双人双面净化工作台、二氧化碳孵箱(FORMA3111, 美国Thermo公司);荧光倒置显微镜(DMI3000B,德国Leica公司);流式细胞仪(美国Coulter公司);H-600IV型透射电镜;DMEM(H)培养基、胎牛血清(美国Gibco公司);0.25%胰酶-EDTA(上海博光生物科技有限公司提供);磷酸盐缓冲液(PBS:0.01 mol/L,pH 7.4); transwell小室(美国millpore公司)。
1.2方法
1.2.1细胞培养 人颅骨成骨细胞株购自上海抚生实验有限公司,10% FBS、1105U/L青霉素、100 mg/L链霉素的DMEM培养基培养,每2~3 d换液1次,细胞融合约80%~90%时传代。
1.2.2细胞黏附实验 实验组根据条件培养液浓度分别为10-4mol/L组、10-5mol/L组、10-6mol/L组、10-7mol/L组、10-8mol/L组,以不含多肽的条件培养液作为对照组,每组6个孔,将基本长满细胞的培养皿内条件培养液倒去,加入含不同浓度(10-4mol/L,10-5mol/L,10-6mol/L,10-7mol/L,10-8mol/L)的成骨细胞特异性识别多肽诱导培养基,对照组则加入不含多肽的培养基,置37 ℃、5% CO2培养箱孵育24 h, 按细胞数2×104/L接种于96孔板, 共设5个时间点即0.5、1、2、4、8 h,每个时间点设6个孔。分别于相应时间点吸弃培养基,PBS清洗,4%多聚甲醛固定。采用体视学的方法,显微镜下计算孔内黏附的细胞数目。每组记6个区域,计算出平均值(细胞个数/mm2)。
1.2.3细胞划痕修复实验 将成骨细胞特异性识别多肽用无血清培养基配制成5个浓度梯度作为实验组,不含多肽的无血清培养基作为对照组。取状态良好的细胞,常规消化离心,吹打重悬,血细胞计数器计数,调整密度至1×108/L,均匀接种至6孔培养板,每孔加1 ml细胞悬液,补充含10%胎牛血清的DMEM 培养基至2 ml。待细胞铺满整个孔底后,用2 μl枪头在单层细胞表面缓慢竖直划出一条笔直痕迹,吸弃培养液,PBS小心冲洗2次,洗去残留细胞分别加入实验组及对照组的无血清培养液,放入37 ℃、5% CO2培养箱,继续培养。分别在0、24、48 h拍照观察细胞的相对划痕愈合面积(迁移前划痕的面积-迁移后划痕的面积),以24 h划痕愈合面积作为统计学计算标准。实验重复3次。

图1 不同浓度多肽对人成骨细胞黏附性能的影响

图2 划痕愈合实验检测不同浓度成骨细胞特异性识别多肽对成骨细胞迁移的影响
1.2.4Transwell迁移实验 实验分为6组,即对照组、10-4mol/L组、10-5mol/L组、10-6mol/L组、10-7mol/L组、10-8mol/L组。实验前1天将细胞培养液换成无血清培养液。胰酶消化后,离心收集细胞,用无血清培养液清洗2次,再次离心收集用含1%血清培养基配置成1×105个/ml的细胞悬液,以每孔100 μl细胞悬液接种于24孔,8 μm聚碳酸酯膜孔径的transwell小室即上室里,下室按照实验分组加入含不同浓度多肽的含30%血清培养液600 μl,对照组加入不含多肽的含30%血清培养液600 μl,37 ℃、5% CO2培养箱培养72 h, 72 h后取出小室,刮去上层未迁移的人成骨细胞及碎片,PBS冲洗3次, 4% 多聚甲醛固定30 min, 0.1%结晶紫染色10 min,光镜下观察、计数、拍照。

2 结果
2.1细胞黏附实验结果不同浓度成骨细胞特异性多肽培养一定时间后,对成骨细胞的黏附性能有不同的影响。细胞黏附0.5 h、1 h及8 h,实验组除10-7mol/L及10-8mol/L组外,其余各实验组黏附细胞数目均高于对照组(P<0.05);细胞黏附2 h及4 h,实验组除10-8mol/L组外其余各实验组黏附数目均高于对照组(P<0.05)。见图1。
2.2成骨细胞特异性识别多肽对人颅骨成骨细胞迁移能力的影响
2.2.1成骨细胞划痕修复实验结果 实验组各浓度组与对照组之间划痕愈合面积的差异均有统计学意义(F=75.87,P<0.05),见表1;与对照组及其余实验组相比,10-4mol/L与10-5mol/L组细胞划痕愈合面积均显著增加(P<0.05),见图2、3。
2.2.2transwell小室实验检测成骨细胞迁移结果实验组各组细胞迁移数目均高于对照组,且差异有统计学意义(F=127.999,P<0.05),见表1。10-4mol/L组与10-6mol/L组组间差异无统计学意义(F=0.25,P>0.05),其余各实验组间比较,差异均有统计学意义(P<0.05),见图3、4。
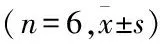
表1 成骨细胞特异性识别多肽对人成骨细胞迁移作用的影响
与对照组比较:*P<0.05

图3 不同浓度成骨细胞特异性识别多肽对成骨细胞迁移的影响
A:10-4mol/L 组;B:10-5mol/L 组;C:10-6mol/L 组;D:10-7mol/L 组;E:10-8mol/L 组

图4 transwell小室实验检测不同浓度的成骨细胞特异性识别多肽对成骨细胞迁移的影响 ×50
3 讨论
机体正常生长发育过程中, 细胞黏附与迁移是不可或缺的生理活动,也是组织工程中的重要现象,是重新构建生成组织和器官的重要手段,而组织损伤、感染及修复离不开细胞黏附、迁移[5]。临床上一切形式骨缺损后的骨愈合以及种植体的骨整合,均需要进行以成骨为主的组织修复,而新骨形成主要是成骨细胞活动的结果。种植体界面的骨整合是决定种植体成功与否的关键,常见的界面接触形式分为骨与种植体接触和纤维组织与种植体接触两种,前者是种植成功的标志,后者则可导致种植失败。多项研究显示成骨细胞在种植基材表面的初期黏附是一个最先发生且决定其命运的关键环节[6-7],成骨细胞无论是在体内还是体外都必须与其所附着的材料表面发生适当的黏附才能进行迁移和增殖[8]。因此,如何提高成骨细胞在种植体表面黏附、迁移、聚集和增殖等成骨活性并通过对材料表面改性以提高种植基材的生物相容性是该领域研究的中心问题。通过材料表面的生物化修饰,从分子水平调控细胞与材料间的相互作用,诱发特异性细胞反应,抑制非特异性反应,实现细胞的黏附、迁移、增殖,甚至细胞的分化、凋亡及细胞外基质的重构成为目前研究热点[9-10]。本实验采用的成骨细胞特异性识别多肽是课题组通过噬菌体肽库筛选技术所得,本课题前期体内实验证实:10-8~10-4mol/L浓度范围内的特异性多肽能够显著促进人颅骨成骨细胞增殖和矿化相关蛋白表达,其中10-5mol/L浓度最为显著,体内实验证实:该多肽可促进兔颅骨缺损的骨修复[11-12]。本研究通过细胞黏附、迁移实验,探讨该多肽分子对成骨细胞成骨活性的影响,结果证实特定浓度的特异性多肽可促进成骨细胞的黏附和迁移。
细胞黏附与迁移能力是表征细胞生物学性能的一个重要指标,成骨细胞在种植基材表面的黏附、迁移直接关系到种植体骨愈合的质量。本实验通过细胞黏附、细胞划痕和transwell小室实验,探讨特异性多肽对成骨细胞黏附、迁移的影响。结果显示:在各个时间段(0.5、1、2、4、8 h),该特异性多肽在10-6~10-4mol/L浓度均能促进成骨细胞黏附,其中10-5mol/L浓度的黏附促进作用最为显著,且与其他实验组比较,差异有统计学意义(P<0.05)。划痕愈合及transwell小室实验显示10-8~10-4mol/L浓度范围的特异性识别多肽与对照组相比均对成骨细胞迁移有不同程度的促进作用,其中10-5mol/L及10-4mol/L促进迁移作用较为显著。综上所述,成骨细胞特异性识别多肽能够促进成骨细胞的黏附与迁移,且10-5mol/L浓度促进人颅骨成骨细胞黏附与迁移作用最为显著。
在采用划痕愈合及transwell小室定时定量监测细胞迁移的实验中,早期(即24 h)即可观察到明显划痕愈合的现象,而transwell小室实验在以10%血清作为趋化条件下,各个时间段(24、48、72 h)均未见细胞穿过小室底,而后实验调整为以30%血清作为趋化条件,72 h后小室底可见理想的细胞迁移数目。细胞迁移涉及到细胞骨架和细胞黏附相关的动态组装和空间位置的改变,细胞胞质内的骨架结构是细胞移行的基础, 而分布在细胞表面的趋化因子受体及黏附分子则能够使细胞对周围环境中的化学物质或其他细胞做出反应[13],而划痕实验及transwell小室实验能否很好地模拟细胞的这种活动可能取决于所研究细胞系的特点。成骨细胞系在病理状态下如组织损伤、感染及修复时细胞迁移可能以侧向运动为主,所以划痕愈合实验能够很好地模拟这种运动形式,而transwell小室实验需要在合适的趋化条件和时间下才能达到理想的效果。上述推论尚待进一步研究证实。
