KLF16对胃癌细胞增殖、克隆能力的影响及机制
2018-08-20顾清张莉张新星代小松陈和平
顾清,张莉,张新星,代小松,陈和平
(四川省医学科学院·四川省人民医院,成都610072)
胃癌是全球最常见的恶性肿瘤之一,每年死亡病例数约68万,其中约50万在中国[1]。多数胃癌患者就诊时已处于中晚期,以手术切除为基础并辅助放化疗的综合治疗方案是目前主要的临床治疗策略,然而放化疗耐药、对其他组织器官的侵袭等严重制约了胃癌患者的治疗效果,胃癌患者的预后不佳,临床亟需寻找新的与胃癌治疗相关的生物靶分子[2]。Krüppel样转录因子(KLF)可与富含GC序列的启动子区结合,调节基因表达。KLF在各种生理和病理过程中发挥重要作用,如血管形成[3]、肿瘤形成[4,5]等。研究证实,KLF2可通过上调p15和p21基因表达,抑制肿瘤增殖[6]。KLF16是Kaczynski等[7]在2002年鉴定的一个新的KLF家族成员,可抑制胰腺癌细胞增殖,而关于KLF16在胃癌中的表达文献报道甚少。2016年1月~2017年10月,我们检测了KLF16在人胃癌细胞中的表达,并探讨了其对胃癌细胞增殖、克隆能力的影响及机制。
1 材料与方法
1.1 材料 人胃上皮细胞株GES-1、人胃癌细胞株BGC-823、SGC7901、HCG-27和AGS(中国科学院上海细胞库),RPMI 1640培养基、胎牛血清(FBS)和双抗(美国Gibco公司),免疫组化试剂盒(上海经科化学科技有限公司),兔抗人KLF16多克隆抗体(ab187973,IHC-P,美国Abcam公司),RNA提取试剂盒和逆转录试剂盒(大连宝生物工程有限公司),Real-time PCR引物序列(上海生工生物工程技术服务有限公司),脂质体Lipofectamine 3000(美国Invitrogen公司),shRNA(上海吉玛制药技术有限公司),CCK-8溶液(上海翊圣生物科技有限公司),低熔点琼脂糖(北京凯瑞基生物科技有限公司),RIPA蛋白裂解液、BCA蛋白定量试剂盒和ECL发光液(上海碧云天生物技术有限公司),兔抗人KLF16多克隆抗体(ab175892,美国Abcam公司),兔抗人p21单克隆抗体(ab109520,美国Abcam公司),兔抗人周期蛋白依赖性激酶4(CDK4)单克隆抗体(ab108357,美国Abcam公司),兔抗人GAPDH多克隆抗体(ab9485,美国Abcam公司),HRP标记的羊抗兔二抗(北京博奥森生物技术有限公司)。紫外分光光度计(ND-2000,美国Thermo公司),荧光定量PCR仪(7600,美国ABI公司),酶标仪(ELX800,美国伯腾仪器有限公司),凝胶成像仪(2500R,上海天能科技有限公司)。
1.2 细胞培养 取人胃上皮细胞株GES-1及人胃癌细胞株BGC-823、SGC7901、HCG-27、AGS,均培养于RPMI1640培养基(含双抗+10% FBS),置于37 ℃、5% CO2培养箱中,取复苏后第4~10代细胞进行试验。
1.3 细胞中KLF16 mRNA相对表达量检测 取约5×104个处于对数生长期的BGC-823和SGC-7901细胞,每种细胞分为3组,接种于6孔板中,24 h后,sh-KLF16 1#、2#、3#组采用脂质体Lipofectamine 3000,分别将sh-KLF16 1#(5′-AGC GCT TCA CCC GCA GTG A-3′)、sh-KLF16 2#(5′-GTG CTC ATG GCC ATC TCT T-3′)、sh-KLF16 3#(5′-CGC ACC TAA AGT CGC ACCT-3′)转染至细胞中,sh-NC组将shRNA无关序列转染至细胞中,以不转染shRNA的细胞为空白对照组。操作步骤参照试剂说明书。转染后12 h,Real-time PCR法检测KLF16 mRNA相对表达量。试验重复3次。基因表达量以2-ΔΔCt法计算。
1.4 细胞增殖活性检测 采用CCK-8法。将转染后的细胞悬液,接种至96孔板中,接种密度约8 000/孔,每组设置3个复孔,24、48和72 h后,每孔加入CCK-8溶液10 μL,培养箱中继续孵育4 h,在酶标仪450 nm波长处测定吸光度值,计算3个复孔的平均值。试验重复3次后,进行统计分析。
1.5 细胞克隆数目测算 制备1.2%和0.7%低熔点琼脂糖溶液,高压灭菌后,置于40 ℃水浴;按1∶1比例,制备1.2%低熔点琼脂糖溶液和2×RPMI 1640培养基(2×双抗和20%FBS)的混合液,取混合液2 mL至6孔板中,冷却凝固备用;取转染后的单细胞悬液,细胞计数后,调整细胞密度为1×106/L;按1∶1比例,制备0.7%低熔点琼脂糖溶液和2×RPMI 1640培养基(含20% FBS和2×双抗)的混合液,再加入细胞悬液200 μL,充分混匀,取适量(约500个细胞)加入至上述6孔板中,形成双层琼脂层,凝固后,置于培养箱中10~14 d,观察并记录细胞克隆数目。试验重复3次后,进行统计分析。
1.6 细胞中KLF16、p21和CDK4蛋白表达检测 采用Western blotting法。收集各组细胞约1×106个,加入RIPA蛋白裂解液150 μL,充分裂解后,提取细胞全蛋白,BCA蛋白定量试剂盒检测蛋白浓度。SDS-PAGE胶电泳分离蛋白后,湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温振荡封闭30 min,TBS-T溶液洗涤1次,分别加入兔抗人KLF16多克隆抗体,兔抗人p21单克隆抗体,兔抗人CDK4单克隆抗体,兔抗人GAPDH多克隆抗体室温孵育1 h。TBS-T溶液洗涤3次,分别加入HRP标记的羊抗兔二抗,室温孵育1 h,TBS-T溶液洗涤3次,ECL发光液进行化学发光显影,凝胶成像仪对蛋白条带进行观察,获取图像,采用Image Lab软件对图像进行灰度分析,计算目的蛋白与内参蛋白的灰度比值。试验重复3次后,进行统计分析。

2 结果
2.1 各组KLF16 mRNA相对表达量比较 BGC-823细胞中,空白对照组,sh-NC组,sh-KLF16 1#、2#、3#组KLF16 mRNA相对表达量分别为1.13±0.10、1.06±0.15、0.57±0.11、0.72±0.14、0.39±0.13,SGC-7901细胞中,空白对照组,sh-NC组,sh-KLF16 1#、2#、3#组KLF16 mRNA相对表达量分别为1.09±0.12、1.02±0.14、0.59±0.15、0.53±0.11、0.31±0.15;两种细胞中,sh-KLF16 #3组的KLF16 mRNA相对表达量低于sh-KLF16 #1组和sh-KLF16 #2组(P均<0.05)。
2.2 各组细胞增殖活性比较 在BGC-823和SGC-7901细胞中,与空白对照组和sh-NC组相比,sh-KLF16 3#组转染48、72 h细胞增殖活性低(P均<0.05)。见表1。
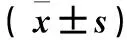
表1 各组转染24、48、72 h后细胞增殖活性比较
注:与同时点空白对照组和sh-NC组相比,*P<0.05。
2.3 各组细胞克隆数目比较 BGC-823细胞中,空白对照组、sh-NC组、sh-KLF16 3#组细胞克隆数目分别为(180.45±19.32)、(189.83±22.43)、(109.32±24.31)个;SGC-7901细胞中,空白对照组、sh-NC组、sh-KLF16 3#组细胞克隆数目分别为(148.41±21.43)、(152.95±24.75)、(87.82±18.43)个;sh-KLF16 3#组细胞克隆数目低于空白对照组、sh-NC组(P均<0.05)。见图1。

图1 平板克隆形成试验检测各组细胞克隆形成能力(×200)
2.4 各组细胞中KLF16、p21和CDK4蛋白表达比较 BGC-823细胞中,空白对照组KLF16、p21、CDK4蛋白相对表达量分别为1.13±0.10、0.84±0.12、1.21±0.18,sh-NC组分别为1.15±0.12、0.79±0.15、1.36±0.32,sh-KLF16 3#组分别为0.21±0.03、1.34±0.21、0.31±0.11。SGC-7901细胞中,空白对照组KLF16、p21、CDK4蛋白相对表达量分别为1.02±0.09、0.78±0.11、1.13±0.08,sh-NC组分别为1.09±0.13、0.69±0.22、1.09±0.14,sh-KLF16 3#组分别为0.26±0.07、1.38±0.28、0.42±0.08。在BGC-823和SGC-7901细胞中,干扰KLF16基因表达后,p21蛋白表达增加,而CDK4蛋白表达下降(P均<0.05)。
3 讨论
胃癌是最常见的胃肠道恶性肿瘤之一,其发病率仅次于肺癌[8]。手术切除可有效改善胃癌患者的预后,但患者的5年总生存率仅29%左右。目前已有多个靶向治疗药物进入临床试验阶段,但效果并不理想[9,10],临床仍亟需寻找能有效靶向治疗胃癌的生物靶标。
KLF是真核细胞中一类含有锌指结构的转录因子,以细胞周期和启动子依赖性的方式参与调节基因转录。KLF在肿瘤形成和恶性进展中发挥多种功能,如KLF2通过调节p15和p21表达,在肺癌中发挥抑癌基因功能[6];KLF4可抑制胰腺癌[11]、胃癌[12]和结肠癌[13]等肿瘤细胞增殖。此外,KLF15被证实在乳腺癌等多种肿瘤细胞中发挥抑癌基因功能[14]。目前,关于KLF16的研究主要集中于代谢和内分泌方面[15],在视网膜神经节细胞中,KLF16可抑制神经突起生长,导致轴突冠萎缩[16];此外,KLF16可减少PPARγ表达进而抑制脂肪生成[17],而在KRAS癌基因突变的肿瘤细胞中,KLF16可抑制细胞增殖[18]。
本研究结果显示,在BGC-823和SGC-7901细胞中干扰KLF16基因表达后,细胞的增殖和克隆形成能力被显著抑制,鉴于现有的文献报道,推测KLF16可能参与了细胞周期调节。研究证实,p21蛋白通过其N末端特异性地与PCNA、Cyclin-CDK结合,抑制CDK活性,阻滞细胞周期,进而抑制细胞增殖;CDK4蛋白正向调控细胞周期,促进细胞由G1期向S期转化,CDK4高表达促进多种肿瘤的恶性进展[18]。本研究中,Western blotting试验结果发现,干扰BGC-823和SGC-7901细胞中KLF16基因表达,可显著增加p21蛋白表达,同时降低CDK4蛋白表达,提示KLF16表达下降,可能导致了细胞周期阻滞,进而抑制了细胞增殖。
综上所述,干扰KLF16基因表达,可抑制细胞增殖和克隆形成能力。KLF16发挥癌基因的功能可能是通过上调CDK4和下调p21表达,导致细胞周期阻滞实现。KLF16可作为胃癌患者治疗和预后预测的生物靶标,后续研究将继续探讨KLF16对细胞周期调节的具体内在机制。
