菌株CICC 6294生物学特性及其在辣椒发酵中的应用
2018-08-10翟磊谢九艳姚粟宋振杨玉新程池
翟磊,谢九艳,姚粟,宋振,杨玉新,程池*
1(中国食品发酵工业研究院有限公司,北京,100027) 2(新疆中亚食品研发中心(有限公司),新疆维吾尔自治区 乌鲁木齐,830001)
戊糖乳杆菌(Lactobacilluspentosus)属于厚壁菌门(Firmicutes),芽胞杆菌纲(Bacilli),乳杆菌目(Lactococcus),乳杆菌科(Lactobacillaceae),乳杆菌属(Lactobacillus)。戊糖乳杆菌具有典型乳杆菌特征,呈规则的杆状,属于革兰氏阳性菌,不产芽胞,无鞭毛,不运动,兼性厌氧,异型乳酸发酵[1]。自从1894年,FRED从酸菜中第一次分离到戊糖乳杆菌[2],起初该菌种被划分到植物乳杆菌中,1987年ZANON等通过DNA杂交和生理生化等试验重新定义了该菌的分类地位,命名为戊糖乳杆菌[3]。
戊糖乳杆菌是目前公认的安全菌,主要应用于发酵乳制品,发酵肉制品,酱腌菜等发酵食品和一些青贮饲料中。戊糖乳杆菌作为益生菌可以产生分子量小,稳定性高,有较广的抑菌图谱的戊糖乳杆菌素,对金黄色葡萄球菌等革兰氏阳性致病菌和李斯特菌等革兰氏阴性致病菌有一定的抑制作用[4-5]。戊糖乳杆菌可以利用戊糖如D-木糖等产生D-乳酸,快速的繁殖和强大的产酸耐酸特性能够很好的降解玉米秸秆和短芒大麦草中的五碳糖,对于青贮饲料的应用具有很大的潜在应用价值[6]。戊糖乳杆菌还能利用生物柴油副产物废甘油为直接原料进行发酵,产生大量的乳酸,有效地减少环境污染,提高产品的利用率[7];同时高产γ-氨基丁酸(GABA)戊糖乳杆菌的筛选[8],对于微生物在药用和保健功能食品研究领域有重要的意义。
新疆传统发酵食品的制作和食用历史悠久,风味独特,营养丰富,而经过长时间的自然驯化,传统发酵食品中一些具有优良特性的乳酸菌保留了下来。本研究建立乳酸菌功能评价模型,从耐酸耐盐特性、产酸能力、抑菌能力、降解亚硝酸盐能力和氨基酸脱羧酶能力等方面对分离于新疆特色辣椒的乳酸菌CICC 6294进行鉴定和生物学特性研究。在此基础上,将该菌株应用于新疆特色辣椒发酵。
1 材料与方法
1.1 实验菌株与培养条件
菌株CICC 6294分离于新疆特色辣椒样品,保藏于中国工业微生物菌种保藏管理中心 (CICC)。菌株CICC 6294在MRS培养基37 ℃培养48 h。
用于抑菌试验的菌种:大肠杆菌(Escherichiacoli) O157:H7 CICC 10907;肠沙门氏菌 (Salmonellaenteric) CICC 10871;金黄色葡萄球菌(Staphylococcusaureus)CICC 10790;单增李斯特菌(Listeriamonocytogenes) CICC 21635,均来自中国工业微生物菌种保藏管理中心。
1.2 实验试剂及设备
MRS培养基、胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)、革兰氏染色试剂盒,北京陆桥技术有限公司;API试剂条,生物梅里埃公司;细菌基因组DNA提取试剂盒,OMEGA公司;GoldView,北京赛百盛基因技术有限公司;溶菌酶,Sigma公司;蛋白酶,Merk公司;Taq DNA聚合酶、dNTP、DL2000 marker,北京天根生物有限公司。
光学显微镜Olympus BH-2,奥林巴斯有限公司;pH计FE20,梅特勒-托利多仪器(上海)有限公司;紫外分光光度计7200,尤尼科(上海)仪器有限公司;温度梯度PCR仪,Biometra公司;恒温培养箱BHG-8082型,上海一恒科学仪器有限公司。
1.3 实验方法
1.3.1 菌株CICC 6294多相分类学鉴定
利用细菌基因组DNA提取试剂盒(OMEGA公司)提取菌株CICC 6294基因组DNA,用0.8%的琼脂糖凝胶电泳进行检测。以基因组DNA为模板,利用通用引物27F和1492R对该菌株的16S rRNA基因进行PCR扩增[9]。PCR扩增反应体系按照PCR Mixture使用说明进行配制(Tiangen公司)。反应程序为:94 ℃预变性2 min,94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min 30 s,30个循环后72 ℃延伸10 min。利用引物21F (5′-CAYCCNGCHCGYGAYATGC-3′)和23R(5′-GGRTGRACCATVCCNGCHCC-3′)对pheS基因序列进行扩增。PCR反应体系同上,反应条件:94 ℃ 预变性2 min,94 ℃变性 1 min,46 ℃复性2min 15 s,72 ℃延伸1 min 15 s,3个循环;94 ℃变性 1 min 15 s,46 ℃复性1 min 15 s, 72℃延伸1 min 15 s,30个循环后72 ℃延伸7 min。扩增产物用0.8%的琼脂糖进行检测后,送至北京诺赛基因组研究中心有限公司进行测序。使用ContigExpress软件对测序结果进行分析,将分析后结果递交到EzBioCloud和NCBI数据库进行比对分析[10],确定菌株CICC 6294与已知菌株的同源关系。采用MEGA 4软件中的Clustal 功能对菌株CICC 10774与近缘种菌株的16S rRNA基因和pheS基因进行多序列比对,并使用Neighbour3Joining法进行系统发育及分子进化分析[11]。
菌株CICC 6294接种到MRS培养基上,37 ℃培养48 h后,观察菌落形态特征[12]。收集新鲜菌体,加入2.5%戊二醛4 ℃固定过夜。离心收集菌体,100 mmol/L磷酸盐缓冲液(pH 7.2)漂洗3次。30%,50%,70%,85%,95%乙醇梯度脱水后100%乙醇脱水3次。脱水后使用仪器BAL-TEC CPD030进行二氧化碳临界点干燥。喷金-离子溅射仪 BAL-TEC SCD005进行喷金后,使用扫描电镜Hitachi SU8010进行菌体形态观察。使用API 50 CHL鉴定系统对菌株CICC 6294底物利用特征进行测定[13]。
1.3.2 菌种CICC 6294生物学特性研究
挑取新鲜培养的单菌落接种到4 mL MRS液体培养基中,37 ℃静置培养18 h后作为接种种子液。菌种CICC 6294生物学特性研究均设置3次平行。
生长及产酸能力测定:将种子液按1%接种量接种于200 mL MRS液体培养基中培养,以不接种培养基作为对照,每隔2 h取样测定600 nm下吸光值(OD600),同时测定发酵液的pH值[14]。
耐盐耐酸特性测定:将种子液按1%接种量接入分别含20、40、60、80和100 g/L NaCl以及入pH 2、3、4、5、6、7的MRS液体培养基中,37℃静置培养48 h,测定600 nm下吸光值(OD600),并记录结果[15]。
亚硝酸盐降解能力测定:将种子液按1%接种量接种于含125 μg/mL NaNO2的200 mL MRS液体培养基中37℃培养,每隔24 h定时取样测定NaNO2含量。参考GB/T 5009.33—2003中的盐酸萘乙二胺法进行测定,不接种的MRS培养基(含125 μg/mL NaNO2)作为空白对照[16]。
氨基酸脱羧酶试验:挑取新鲜培养的单菌落于3 mL无菌生理盐水中研磨,制备成0.5 McFarland悬液,分别滴入氨基酸脱羧酶试验的安培瓶中,每瓶3滴,并加无菌液体石蜡覆盖培养基表面,培养24 h后,观察试验管与对照管颜色变化,试验管为紫色,对照管为黄色,结果为阳性;试验管与对照管均为黄色,结果为阴性。
抑菌试验:采用滤纸片法测定目标菌株的抑菌性能。挑取新鲜培养的指示菌株,大肠杆菌 O157:H7 (Escherichiacoli, CICC 10907),肠沙门氏菌 (Salmonellaenteric, CICC 10871),金黄色葡萄球菌 (Staphylococcusaureus, CICC 10790) 和单增李斯特菌 (Listeriamonocytogenes, CICC 21635),将菌悬液浓度调至0.5 麦氏浊度并均匀涂布在TSA培养基上,然后将滤纸片浸泡在200 μL培养48 h的菌株CICC 6294发酵液中,置于上述培养基中,37 ℃培养箱中培养48 h,记录结果[17]。
1.3.3 发酵辣椒特性测定
将新疆辣椒清洗干净打浆破碎后,将种子液按1%接种量接种于破碎辣椒中,同时加入3%糖和3%盐,以不接乳酸菌的自然发酵辣椒为对照组,30 ℃恒温连续发酵7 d。每天取样测定发酵辣椒的pH值。按照GB/T 12456—2008:《食品中总酸的测定》中酸碱滴定法测定发酵辣椒的总酸含量[18]。使用HPLC法测定有机酸的种类和含量。按照GB 5009.33—2010:《食品中亚硝酸盐与硝酸盐的测定》测定发酵辣椒的亚硝酸盐含量[19]。按照GB/T 5009.208—2008:《食品中生物胺含量的测定》使用HPLC法对发酵7 d的辣椒中生物胺的种类和含量进行测定[20]。发酵辣椒特性测定均设置了3次平行,数据分析使用SPSS 16.0软件对实验数据进行分析。
2 实验结果
2.1 菌株CICC 6294 多相分类学鉴定
菌株CICC 6294在MRS琼脂培养基上37 ℃培养48 h,菌落为乳白色,圆形,湿润,边缘整齐,表现为典型的乳杆菌菌落特征。显微镜下观察,菌株呈杆状,大小为0.4~0.5 μm×0.6~1.5 μm,单个,成对或者成堆排列,革兰氏染色呈阳性。菌株CICC 6294电镜照片见图1,利用碳源产酸能力见表1。

图1 菌株CICC 6294扫描电镜图Fig.1 The scanning electron microscope of strain CICC 6294

检测项目结果检测项目结果检测项目结果检测项目结果甘油+赤藓糖醇-D-阿拉伯糖-L-阿拉伯糖+D-核糖+D-木糖+L-木糖-阿东醇-β-甲基-D-木糖苷-D-半乳糖+D-葡萄糖+D-果糖+D-甘露糖+L-山梨糖-L-鼠李糖-卫矛醇-肌醇-甘露醇+山梨醇+α-甲基-D-甘露糖苷-α-甲基-D-葡萄糖苷+N-乙酰葡糖胺+w苦杏仁苷+熊果苷+七叶灵+水杨苷+D-纤维二糖+D-麦芽糖+D-乳糖+D-蜜二糖+D-蔗糖+D-海藻糖+菊糖-D-松三糖-D-棉籽糖+淀粉-糖原-木糖醇-D-龙胆二糖+D-土伦糖-D-来苏糖-D-塔格糖-D-岩藻糖-L-岩藻糖-D-阿拉伯醇-L-阿拉伯醇-葡萄糖酸钾-2-酮基-葡萄糖酸盐-5-酮基-葡萄糖酸盐-
注:“+”表示阳性;“-”表示阴性;“+w”表示弱阳性。
将菌株CICC 6294扩增的16S rRNA基因序列测序递交数据库比对后(图2),与其亲缘最近的是LactobacilluspentosusJCM 1558T,同源性为100%,然而同源率高于98.65%的模式菌种还包括Lactobacillusplantarumsubsp.plantarumATCC 14917T,LactobacillusparaplantarumDSM 10667T,Lactobacillusplantarumsubsp.argentoratensisDKO 22T,LactobacillusfabifermentansDSM 21115T,Lactobacillusxiangfangensis3.1.1T和Lactobacillusmudanjiangensis11050T。因此,通过16S rRNA基因序列只能将菌株CICC 6294鉴定到乳酸杆菌属(Lactobacillussp.)。在此基础上,通过pheS基因比对分析发现(图2),与菌株CICC 6294同源性最高的菌株为Lactobacilluspentosus(100%),与其他菌株的同源性均在85%以下,因此综合上述基因比对分析结果,菌株CICC 6294鉴定为戊糖乳杆菌(Lactobacilluspentosus),其16S rRNA 基因序列登录号为KY694989,pheS基因序列登录号为KY694987。

A-16S rRNA基因;B-pheS基因图2 菌株CICC 6294系统发育树Fig.2 The phylogenetic trees of strain CICC 6294注:采用MEGA5.0软件,邻位连接法显示菌株与相关模式种系统发育树,进行1 000次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株。
2.2 菌种CICC 6294生物学特征测定结果
生长曲线测定表明,菌株CICC 6294进入对数期较快,培养10 h开始进入对数期,培养36 h进入稳定期。产酸能力测定结果表明,菌株CICC 6294产酸速度较快,培养32 h pH值就降到4,最终pH值可以降到3.8(图3-A)。由此可见,生长速度与产酸速度成正比,菌株CICC 6294进入对数期较快,其产酸速率也较快。
耐酸耐盐试验结果表明,菌株CICC 6294生长pH值范围为4~7,最适pH值为5。随着pH值升高,菌株CICC 6294生长呈现升高后降低的趋势,pH 5 条件下生长最旺盛,pH 2和pH 3条件下几乎不能生长(图3-B);菌株CICC 6294生长与NaCl质量浓度成反比,即随着NaCl质量浓度的升高,乳酸菌的生长受到明显的抑制,菌株CICC 6294对NaCl耐受范围为0~80 g/L,在含80 g/L NaCl培养基中最终生长的OD600能够达到0.5(图3-B)。因此,菌株CICC 6294具有较好的耐酸和耐盐特性。
亚硝酸盐降解能力测定试验结果表明,随着培养时间的延长,菌株降解的亚硝酸盐越多。培养24 h后,菌株CICC 6294的亚硝酸盐降解率可达到98.8%;培养30 h后,可达到100%(表2)。氨基酸脱羧酶试验结果表明,菌株CICC 6294赖氨酸脱羧酶、鸟氨酸脱羧酶、色氨酸脱羧酶和精氨酸双水解酶4种氨基酸脱羧酶活性均显阴性。抑菌试验结果表明,菌株CICC 6294对于肠炎沙门氏菌的抑菌直径可达26 mm,对于大肠杆菌的抑菌直径可达到13 mm,对金黄色葡萄球菌抑菌直径为19 mm,对单增李斯特菌的抑菌直径为10 mm(表2)。

A-生长和产酸;B-耐酸和耐盐图3 菌株CICC 6294 生物学特性Fig.3 The biological properties of strain CICC 6294

生物学特性菌株CICC 6294亚硝酸盐降解率/%a98.8亚硝酸盐降解率/%b100氨基酸脱羧酶赖氨酸脱羧酶-鸟氨酸脱羧酶-色氨酸脱羧酶-精氨酸双水解酶-抑菌直径/mm肠炎沙门氏菌26大肠埃希氏菌13金黄色葡萄球菌19单增李斯特菌10
注:“a”表示菌株培养24 h后的亚硝酸盐降解率,“b”表示菌株培养30 h后的亚硝酸盐降解率;“-”表示阴性。
2.3 发酵辣椒特性测定
将菌株CICC 6294按1%接种量接种于破碎辣椒中,同时加入3%糖和3%盐,以不接乳酸菌的自然发酵辣椒为对照组,30℃恒温连续发酵7 d。辣椒发酵试验结果表明,随着发酵时间的增加,发酵辣椒的pH值不断下降,发酵7 d后,pH值不再明显下降,因此7 d作为发酵的终点。自然发酵辣椒的终pH值在3.26,接种菌株CICC 6294的发酵辣椒,发酵终pH值在2.99,明显低于自然发酵(图4-A)。总酸含量测定表明,自然发酵辣椒的总酸含量仅为20.9 g/kg,接种菌株CICC 6294的发酵辣椒最终的酸含量能够达到27.6 g/kg,明显高于自然发酵辣椒(图4-A),这与发酵辣椒pH值测定是一致的。发酵辣椒中亚硝酸盐含量测定结果表明,随着发酵时间的增加,亚硝酸盐的含量呈现先增加后减少的趋势,发酵第2天亚硝酸盐的含量达到峰值,自然发酵辣椒(CK)中亚硝酸盐含量为6.5 mg/kg,而接种CICC 6294菌株的发酵辣椒中亚硝酸盐含量为5.7 mg/kg(图4-B)。接入菌株CICC 6294能够显著的降低发酵辣椒中的亚硝酸盐含量,发酵7 d亚硝酸盐含量最低仅为0.81 mg/kg,远低于自然发酵辣椒中亚硝酸盐含量(2.63 mg/kg)。国家标准中规定,蔬菜及其制品中亚硝酸盐的含量不得超过20 mg/kg[21],尽管自然发酵辣椒亚硝酸盐的含量低于国家标准,但菌株CICC 6294的接入进一步降低了发酵辣椒中的亚硝酸盐,提高了发酵辣椒食用安全性。
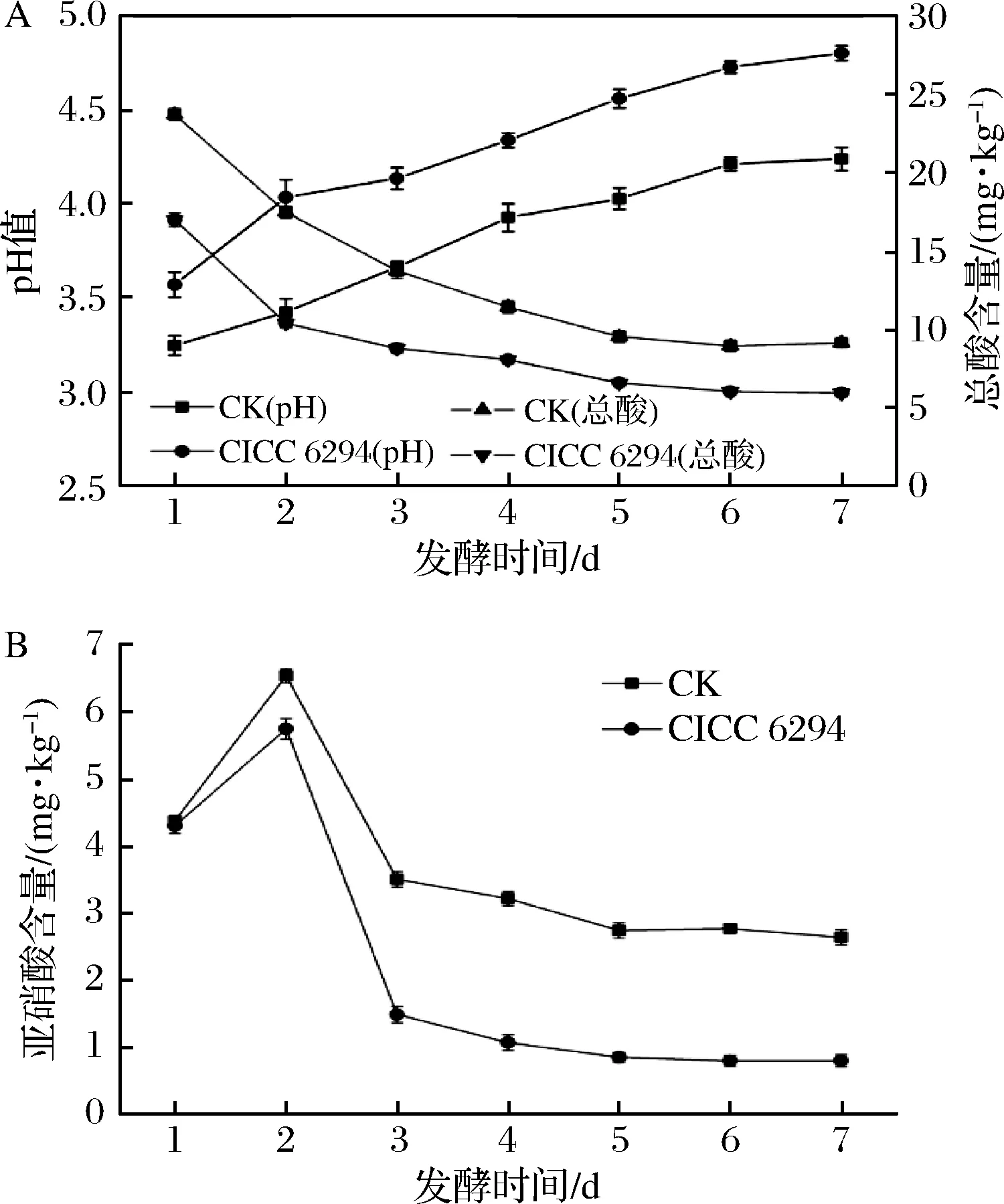
图4 发酵辣椒特性测定pH和总酸(A)以及亚硝酸盐含量 (B)Fig.4 Properties of fermented chili pH and total acid (A) nitrite content(B)
生物胺测定结果表明,发酵辣椒中的生物胺主要为腐胺。接入菌株CICC 6294能够显著的降低发酵辣椒中腐胺的含量,腐胺的含量仅为3.19 μg/mL,远低于自然发酵辣椒的19.36 μg/mL(表3),这表明菌株CICC 6294的接入能很大程度的提高发酵辣椒的安全性。

表3 自然发酵和接种CICC 6294发酵辣椒的性能比较Table 3 Properties comparison between naturalfermentation chili and fermented chili with CICC 6294
3 讨论
本研究通过多相分类学技术对分离于新疆特色发酵辣椒的菌株CICC 6294进行鉴定,菌株CICC 6294符合乳酸菌的典型特征,系统发育学分析将该菌株鉴定为戊糖乳杆菌。
乳酸菌对低酸环境和渗透压的耐受性也是作为发酵剂和潜在益生菌的必要条件[22]。本研究结果表明菌株CICC 6294生长速度快,产酸速度快,同时能够耐受酸性和高渗环境,在pH 4条件下OD600能够达到1.0,80 g/L NaCl条件下OD600能够达到0.5,表现了良好的耐酸和耐盐能力。亚硝酸盐降解能力和生物胺生成能力也是乳酸菌作为果蔬发酵剂的重要参考因素[23-24]。菌株CICC 6294具有很强的亚硝酸盐降解能力,在改良MRS培养基中培养30 h,亚硝酸盐降解率可达到100%;多种氨基酸脱羧酶活性均显阴性,生物胺生成能力较低;并且对4种食品常见致病菌具有抑制作用。上述生物学特性使得菌株CICC 6294具有作为果蔬发酵剂的潜力。
本研究将菌株CICC 6294应用于发酵辣椒,与自然发酵相比,所得的发酵辣椒具有显著的优势。接种该菌株的发酵辣椒总酸含量显著提高,能够达到27.6 g/kg;亚硝酸盐的含量仅为0.81 mg/kg,远低于自然发酵中亚硝酸盐含量;生物胺的主要种类为腐胺,含量仅为3.19 μg/mL,远低于自然发酵辣椒,这些特性都与菌株的生物学特性是一致的。菌株CICC 6294 的接入能够提高发酵辣椒的安全性,缩短发酵周期,作为乳酸菌发酵剂应用于发酵具有广阔前景。
