阪崎肠杆菌生物膜形成条件及超声波对其去除作用
2018-08-10杨璐环邓一秒吴希阳陈振强唐书泽
杨璐环,邓一秒,吴希阳,陈振强,唐书泽*
1(暨南大学 食品科学与工程系,广东 广州,510632) 2(暨南大学 食品安全与营养研究院,广东 广州,510632) 3(暨南大学 光电工程系,广东 广州,510632)
阪崎肠杆菌(Cronobactersakazakii)是一种危及婴幼儿健康的条件致病菌。1961年,英国首次报道了两例由阪崎肠杆菌引起的新生儿脑膜炎病例,两个婴儿在出现症状后的两天内均死亡[1]。之后,科研人员从食品和环境中分离出阪崎肠杆菌,2002年LECLERCQ[2]等从奶酪、牛肉、蔬菜、腊肠中分离到阪崎肠杆菌, 但目前还不能确定该菌的自然宿主。近年,在美国、日本、墨西哥、阿根廷等地都出现过奶粉阪崎肠杆菌感染婴幼儿病例[3-6]。低体重、早产婴儿与免疫缺陷婴儿是易感人群,感染症状主要是脑膜炎、菌血症和小肠结肠炎[7]。在中国,虽阪崎肠杆菌中毒事件的报道鲜少,但在广州、甘肃、福建龙岩等多地市售婴幼儿奶粉中曾分离出阪崎肠杆菌[8-10]。
多年来,学者主要研究的是浮游菌,但大多数细菌是以群体方式存在,即生物膜(biofilm)形式。阪崎肠杆菌主要以生物膜方式存在,附着在加工生产线、车间墙壁、地面等表面,是一个三维结构菌细胞群体,被胞外聚合物(extracellular polymeric substance, EPS)及其基质网包裹。其形成过程包括可逆附着期、不可逆附着期、菌落形成期、成熟期及老化脱落期[11]。时间、温度、pH值、营养条件、有机化合物、金属离子尤其是二价离子如Ca2+、Mg2+、Cu2+等因素都会影响生物膜的形成。细菌生物膜极易出现在被忽略的隐蔽处如凹槽、空隙等,在食品加工过程中,食品通过接触这些微小地方染菌,引发食品中毒。生物膜控制方法有超声波法、消毒剂清洗消毒法等[12]。超声波可以在邻近表面的液体中产生空化气泡,从而分散在生物膜的表面而去除生物膜[13]。DROR等[14]研究表明超声波处理能有效去除87.5%的生物膜。超声处理初始温度、时间、功率等都能影响生物膜去除效果。BAUMANN等[15]对单核细胞李斯特菌生物膜研究结果表明超声波与臭氧处理结合能有效去除食品不锈钢表面生物膜。TORLAK等[16]认为超声波与苯扎氯铵联合作用能导致生物膜中活细胞水平显著降低。
阪崎肠杆菌近年来在食品中尤其是奶粉中的检出率逐年增加,周汉洪等[17]对四川省达州市婴幼儿食品阪崎肠杆菌污染情况进行检测,检测率高达26.83%。但对阪崎肠杆菌生物膜的形成因素和控制技术研究报道甚少,本文通过建立生物膜体外模型,测定生物膜含量并观察其形态变化,探讨阪崎肠杆菌生物膜形成条件,同时通过超声波处理,研究超声波作用对玻璃表面生物膜去除效果。
1 材料与方法
1.1 菌株及培养基
阪崎肠杆菌标准菌株ATCC29544(含标准冻干菌株与菌株复苏液),购自广东环凯微生物科技有限公司。
胰蛋白胨大豆肉汤培养基 (TSB):称取15.0 g加入500 mL蒸馏水,混匀溶解后,121 ℃高压灭菌15 min,4 ℃保存备用。
胰蛋白胨大豆琼脂培养基 (TSA):称取干粉20.0 g加入500 mL蒸馏水,121 ℃高压灭菌15 min,待冷却到45 ℃倒平板,4 ℃保存备用。
1.2 主要试剂
pH=7.4 无菌磷酸盐缓冲溶液(phosphate buffer solutions,PBS)(本实验室配置); 结晶紫(Sigma);甲醇、体积分数为33%冰乙酸(天津市大茂化学试剂厂);LIVE/DEADTMBacLightTMBacterial Viability Kit (L13152,含SYTO9/PI);抗荧光淬灭剂(碧云天P0126);指甲油 (浙江艳庄化妆品有限公司)。
1.3 主要仪器
多功能酶标仪 (Infiniti M200pro,Switzerland),帝肯贸易有限公司;6/96孔细胞培养板,Costar;盖玻片 (玻璃材质,20 mm×20 mm),载玻片(玻璃材质,25 mm×75 mm),江苏世泰实验器材有限公司;智能数字超声仪器(KQ-350D),东莞市科桥超声波设备有限公司;倒置生物显微镜 (BDS400),重庆奥特光学仪器有限公司;激光共聚焦扫描显微镜 (LSM700),德国Zeiss。
1.4 方法
1.4.1 菌种复苏与活化
参照微生物检测冻干质控菌种阪崎肠杆菌使用说明书对菌种进行复苏,开启瓶盖前需用体积分数为75%酒精棉球对瓶子表面进行消毒,所有操作均在无菌条件下进行。复苏后的菌悬液于5 mL TSB培养基中以100 r/min、37 ℃下进行摇床培养过夜。
1.4.2 菌种培养
取活化后的菌悬液100 μL涂布于TSA培养基,在生化培养箱中37 ℃培养过夜。挑取菌落在TSA中采用分区划线稀释法进行平板划线,培养繁殖过夜后形成阪崎肠杆菌单菌落。挑取单个菌落加入5 mL TSB培养基中,在37 ℃、100 r/min进行摇床培养16 h至生长稳定期得到种子液[18]。对得到的菌悬液以4 500 r/min离心10 min,弃去上清液培养基,收集菌体沉淀,加5 mL 无菌PBS对菌体洗涤3次,弃去上清液浮游菌,使菌体重新悬浮于PBS溶液,用酶标仪在595 nm测光密度(optical density, OD),用无菌PBS调整菌悬液OD595值为0.5,用于后续实验。
1.4.3 阪崎肠杆菌BF体外模型建立与测定
1.4.3.1 96孔细胞培养板BF形成与测定
96孔培养板在体积分数为75%酒精浸泡过夜,超净工作台中紫外杀菌30 min。吸取100 μL菌液与100 μL TSB培养基加入至96孔培养板中混匀,以加入200 μL TSB培养基孔作为阴性对照,置生化培养箱37 ℃培养24 h,吸出培养液,加入200 μL无菌PBS洗涤3次以洗去浮游菌。以结晶紫染色法测OD值,步骤参照 LEE[19]等进行适当修改:加100 μL体积分数为10%甲醇固定15 min,吸出甲醇,自然风干,加200 μL质量分数为1%结晶紫染色15 min,吸出结晶紫,用无菌蒸馏水清洗3次至无色,自然干燥后加200 μL 33%冰乙酸,37 ℃培养箱中静置20 min以完全溶解染料,多功能酶标仪在595 nm测定其OD值。
1.4.3.2 6孔细胞培养板载玻片BF形成
6孔培养板、盖玻片在体积分数为75%酒精浸泡过夜,超净工作台中紫外杀菌30 min。将盖玻片转移至6孔培养板,并吸取200 μL菌液与5 mL TSB培养基加入至6孔培养板中。置生化培养箱37 ℃培养24 h,无菌PBS洗涤3次以洗去盖玻片的浮游菌。
1.4.4 培养温度与培养基初始pH值对阪崎肠杆菌生物膜形成的影响
按1.4.3.1阪崎肠杆菌形成生物膜方法,用体积分数为10% HCl和质量分数为10% NaOH调节配制初始pH值为2.0、3.0、5.0、6.5、7.0、7.5、8.0、10.0、12.0的TSB培养基,121 ℃高压灭菌15 min后,将其分别放于4、25、37、45、55 ℃培养箱中培养,作空白对照。按1.4.3.1操作测定OD值,每组试验设置6个平行,试验重复3次,取平均值。
1.4.5 倒置显微镜观察37 ℃下不同pH值生长条件下的生物膜
按1.4.3.1阪崎肠杆菌形成生物膜方法,配制初始pH值为2、5、7.5、10、12的TSB培养基,采用结晶紫染色法在倒置显微镜观察生物膜,96孔板可直接放在倒置显微镜下观察并拍照。
1.4.6 培养基成分对阪崎肠杆菌生物膜形成的影响
按1.4.3.1操作,各组分别以不加NaCl,CaCl2,MgCl2,CuSO4,乙二胺四乙酸 (ethylenediaminetetraacetic acid,EDTA) 作为阳性对照,37 ℃培养24 h,不加菌液培养基作阴性对照。按1.4.3.1操作测定OD值,每组试验设置6个平行,试验重复3次,取平均值。
1.4.6.1 盐度对阪崎肠杆菌生物膜形成的影响
向TSB培养基中添加NaCl至质量分数为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、4.0%、5.0%、6.0%、7.0%,121 ℃高压灭菌15 min后按1.4.3.1操作测定OD值。
1.4.6.2 无机盐Ca2+、Mg2+、Cu2+对阪崎肠杆菌生物膜形成的影响
分别配制含质量分数为0.01%、0.03%、0.05%、0.10%、0.50%、1.00%、1.50%、2.00%的CaCl2的TSB培养基;配制含质量分数0.05%、0.10%、0.50%、1.00%、1.50%、2.00%、2.50%、3.00%的MgCl2的TSB培养基;配制含质量分数为0.05%、0.10%、0.30%、0.50%、0.80%、1.00%、1.50%、2.00%的CuSO4的TSB培养基,121 ℃高压灭菌15 min后按1.4.3.1操作测定OD值。
1.4.6.3 有机化合物EDTA对阪崎肠杆菌生物膜形成的影响
配制含质量分数为0.2%、0.4%、0.6%、0.8%、1.0%、1.5%、2.0%、2.5%的EDTA的TSB培养基,121 ℃高压灭菌15 min后按1.4.3.1操作测定OD值。
1.4.7 超声波法对玻璃表面阪崎肠杆菌生物膜去除作用
1.4.7.1 超声波法对玻璃表面阪崎肠杆菌生物膜处理及平板菌落计数法
按1.4.3.2处理后将洗好的盖玻片转移至装有10 mL无菌水的无菌离心管中,密封。对其进行超声波处理,混匀所得菌悬液,将其以十倍稀释法进行稀释,选取合适的梯度以涂布平板法进行计数,每个梯度设置3个平行。若不进行稀释,则培养过夜后,培养基上的菌落会成片,致无法计数。从冰箱拿出的TSA培养基需倒置放入37 ℃培养箱中静置2 h,防止培养基含水分从而稀释菌液且延长涂布时间。吸取100 μL菌液滴加至灭菌的TSA培养基中,用涂布器进行涂布,使菌液均匀分布,于37 ℃培养16~24 h后进行菌落计数。试验重复3次,取平均值。计算公式如下:
玻璃表面脱落 菌落数(CFU/cm3)=
(1)
1.4.7.2 超声初始温度对玻璃表面阪崎肠杆菌生物膜去除作用的影响
设定超声波功率为180 W,分别在超声初始温度为20 、25 、30 、35 、40 、45 、50 、55 ℃超声处理5 min,按1.4.7.1以平板菌落计数法进行计数,记录结果并计算出玻璃表面脱落菌落数,以确定最佳的超声初始温度。
1.4.7.3 超声时间对玻璃表面阪崎肠杆菌生物膜去除作用的影响
设定超声波初始温度为30 ℃,超声功率为180 W,分别对其进行超声处理2、5、8、11、14、17、20、23 min,按1.4.7.1以平板菌落计数法进行计数,记录结果并计算出玻璃表面脱落菌落数,以确定最佳的超声时间。
1.4.7.4 激光共聚焦扫描(CLSM)观察超声初始温度对玻璃表面阪崎肠杆菌生物膜去除作用影响
按照活SYTO9/PI染料试剂盒说明书进行操作,加100 μL 染料,染色孵育15 min,在载玻片上滴加1滴抗荧光淬灭剂,指甲油封片,于激光共聚焦扫描显微镜观察,采集图像。
1.4.7.5 激光共聚焦扫描(CLSM)观察超声时间对玻璃表面阪崎肠杆菌生物膜去除作用影响
按1.4.7.4步骤操作。
2 结果与分析
2.1 温度与培养基初始pH值对阪崎肠杆菌生物膜形成的影响
培养温度、培养基初始pH值和生物膜形成密切关系(见图1)。阪崎肠杆菌在37 ℃生长状况最好,45 ℃环境下的阪崎肠杆菌生物膜量比25 ℃时多,这与魏奇等[20]报道一致。在4 ℃低温下,阪崎肠杆菌基本不生长,在55 ℃环境中培养阪崎肠杆菌,其也形成了一定数量的生物膜,证明了阪崎肠杆菌的耐高温特性,也说明了在奶粉等食品中需要60 ℃以上才能达到杀灭阪崎肠杆菌目的。在一定的温度下,阪崎肠杆菌的生长受初始pH值的影响较大,当培养基为碱性时,其生长严重受到抑制,当培养基为酸性时,其生长也受到抑制,但影响相对较小。当初始pH值为2.0~7.5时,生物膜量随之增加,初始pH值为7.5的生物膜量最大,最适合阪崎肠杆菌生长。当初始pH值为8.0~12.0时生物膜量随之迅速减少,且pH值为2.0时的生物膜量比初始pH值为12.0时多,pH值为12.0时基本不形成生物膜,说明阪崎肠杆菌具有耐酸性。
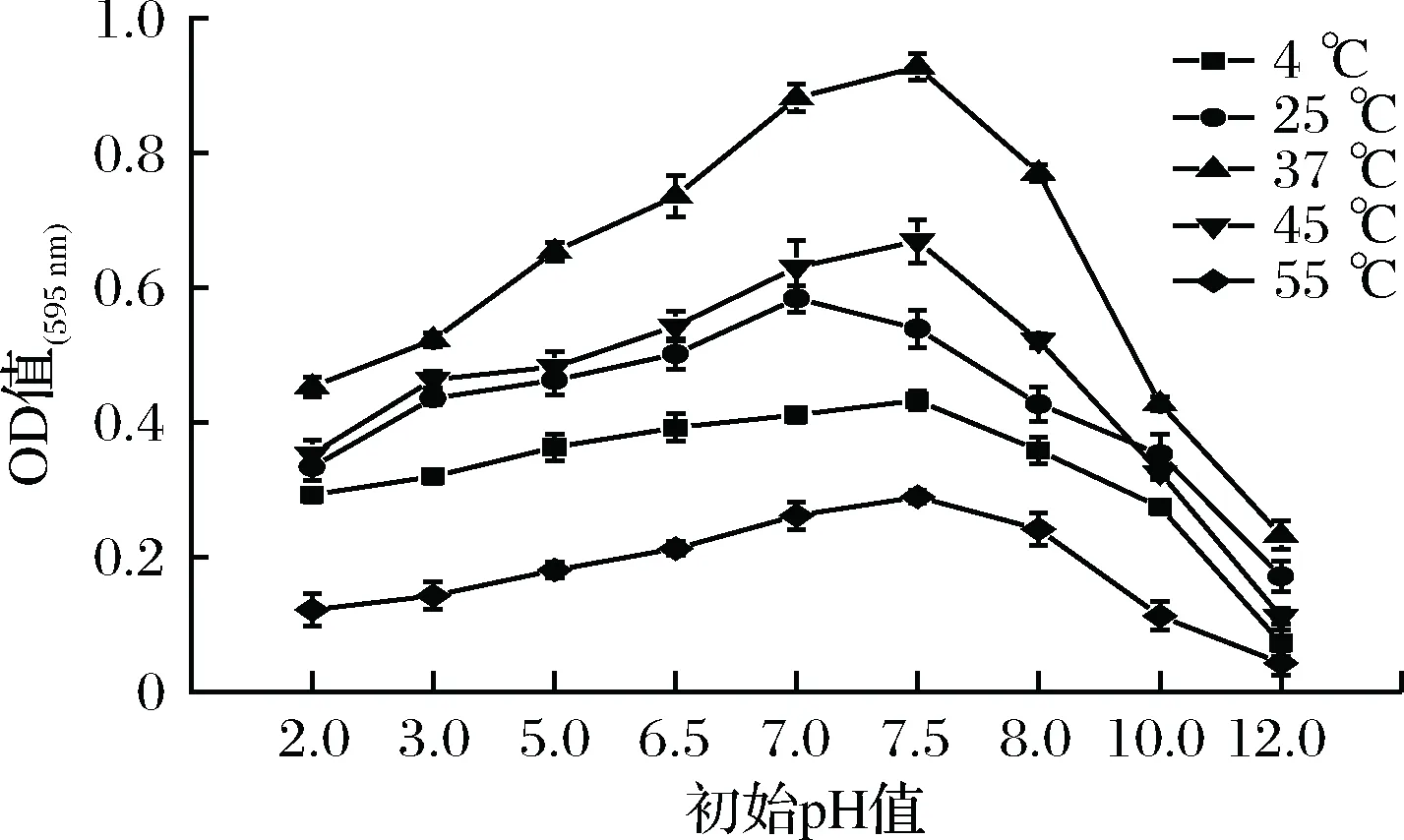
图1 阪崎肠杆菌生物膜培养光密度值随培养基初始pH值与温度的变化Fig.1 Influence of medium initial pH and temperature on the opticaldensity of Cronobacter sakazakii
2.2 倒置显微镜观察37℃下不同pH值生长条件下的生物膜
图2-a为空白对照组图,即未加入菌悬液的TSB培养基组。图中未观察到紫色菌体,表明无生物膜形成。图2-b为培养基初始pH值2.0时显微镜观察图,可明显看出其已有少量生物膜形成。图2-c显示,培养基初始pH值为5.0时的生物膜量比培养基初始pH值为2.0时多,且染色颜色深,证明生物膜较成熟,胞外多糖与结晶紫形成紧密。图2-d为阪崎肠杆菌在最适培养基初始pH值为7.5时观察图,可看出其生物膜已经完全成熟。图2-e表明,当培养基初始pH值增大为10.0时,生物膜含量大大降低。从图2-f可看出,当培养基初始pH值为12.0时,几乎不形成生物膜。图2-b与图2-f比较,培养基初始pH值为酸性时的生物膜量比培养基初始pH值为碱性时要多,进一步说明阪崎肠杆菌的耐酸特性。
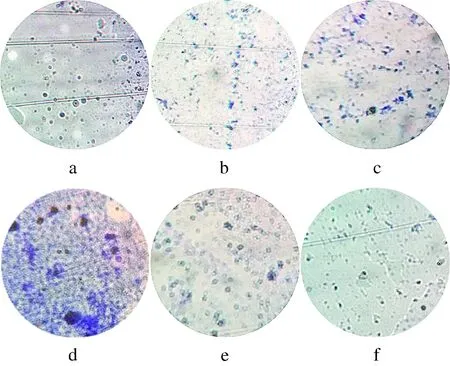
图2 不同pH值下阪崎肠杆菌生物膜结晶紫染色倒置显微镜镜检 10×20(结晶紫染色×200)Fig.2 Inverted microscope observations of Cronobacter sakazakii biofilm by crystal violet staining with different pH注:a为空白对照组,b~f分别表示在培养基初始pH为2.0、5.0、7.5、10.0、12.0条件下阪崎肠杆菌生物膜倒置显微镜下观察图。
2.3 培养基成分对阪崎肠杆菌生物膜形成的影响
2.3.1 盐度对阪崎肠杆菌生物膜形成影响
阪崎肠杆菌生物膜在培养基盐度0.5%~3.0%范围内形成状况较好,OD值比较高(见图3)。盐度2.5%时,为阪崎肠杆菌生长最优参数。随着盐度增长,阪崎肠杆菌生长被抑制,生长速率降低,盐度为3.0%~7.0%时,生物膜量持续下降,但盐度为7.0%时,仍有一定的生物膜形成。
2.3.2 无机盐Ca2+、Mg2+、Cu2+对阪崎肠杆菌生物膜形成的影响
图4为无机盐Ca2+、Mg2+、Cu2+对不同质量分数条件下测的OD595nm值。CaCl2质量分数相对较低时,CaCl2明显促进生物膜的形成,待CaCl2质量分数达到0.50%,达到最高生物膜量,但随着质量分数的增加,生物膜生长被抑制。在Ca2+质量分数低于2.00%时,生物膜量总体呈上升趋势(见图4-A)。CHEN等[21]通过研究Ca2+对副溶血弧菌影响后指出,Ca2+可能是可交联的阴离子基质聚合物,当Ca2+浓度增加,使得Ca2+饱和,其可屏蔽静电相互作用并改变生物膜,使得形成的生物膜量下降。
MgCl2总体上是促进生物膜形成(见图4-B),MgCl2质量分数0.01%~1.50%时,生物膜量持续增加,1.50%时达到最大。Mg2+通过对负电荷的吸引,使菌体粘附于载体的机会增大[22]。当浓度再升高时,生物膜形成量降低,SONG和LEFF[23]研究Mg2+对荧光假单胞菌的影响规律,表明Mg2+改变了生物膜结构,从而影响其生物膜的形成。
Cu2+明显抑制生物膜形成(图4-C)。Cu2+在质量分数0.50%时,生物膜量下降较明显。当Cu2+质量分数1.50%时,几乎不形成生物膜,其他试验组的生物膜量也明显低于对照组。Cu2+是重金属离子,毒性较强,抑制生物膜活性,减少EPS分泌[24]。
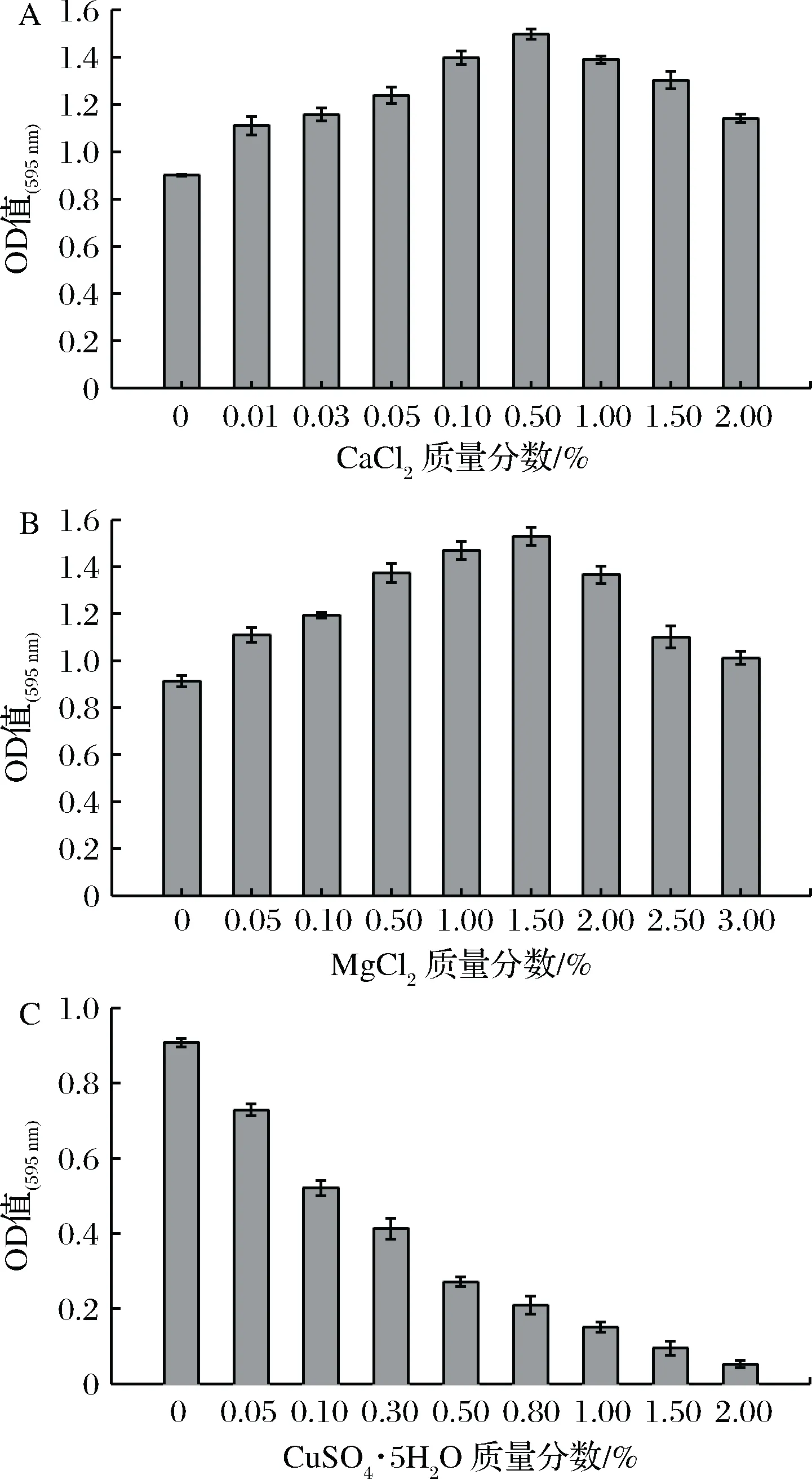
图4 无机盐对阪崎肠杆菌生物膜形成的影响Fig.4 Effect of inorganic salts on Cronobacter sakazakii biofilm formation
2.3.3 有机化合物EDTA对阪崎肠杆菌生物膜形成的影响
图5结果表明,添加0.2%EDTA,生物膜量稍增加,EDTA浓度增加,生物膜形成受到明显抑制,添加2.5%EDTA时,生物膜几乎不形成。 EMMAJ[25]等研究隐球菌生物膜形成影响因素时,发现EDTA通过影响Ca2+、Mg2+的运输,抑制生物膜形成。
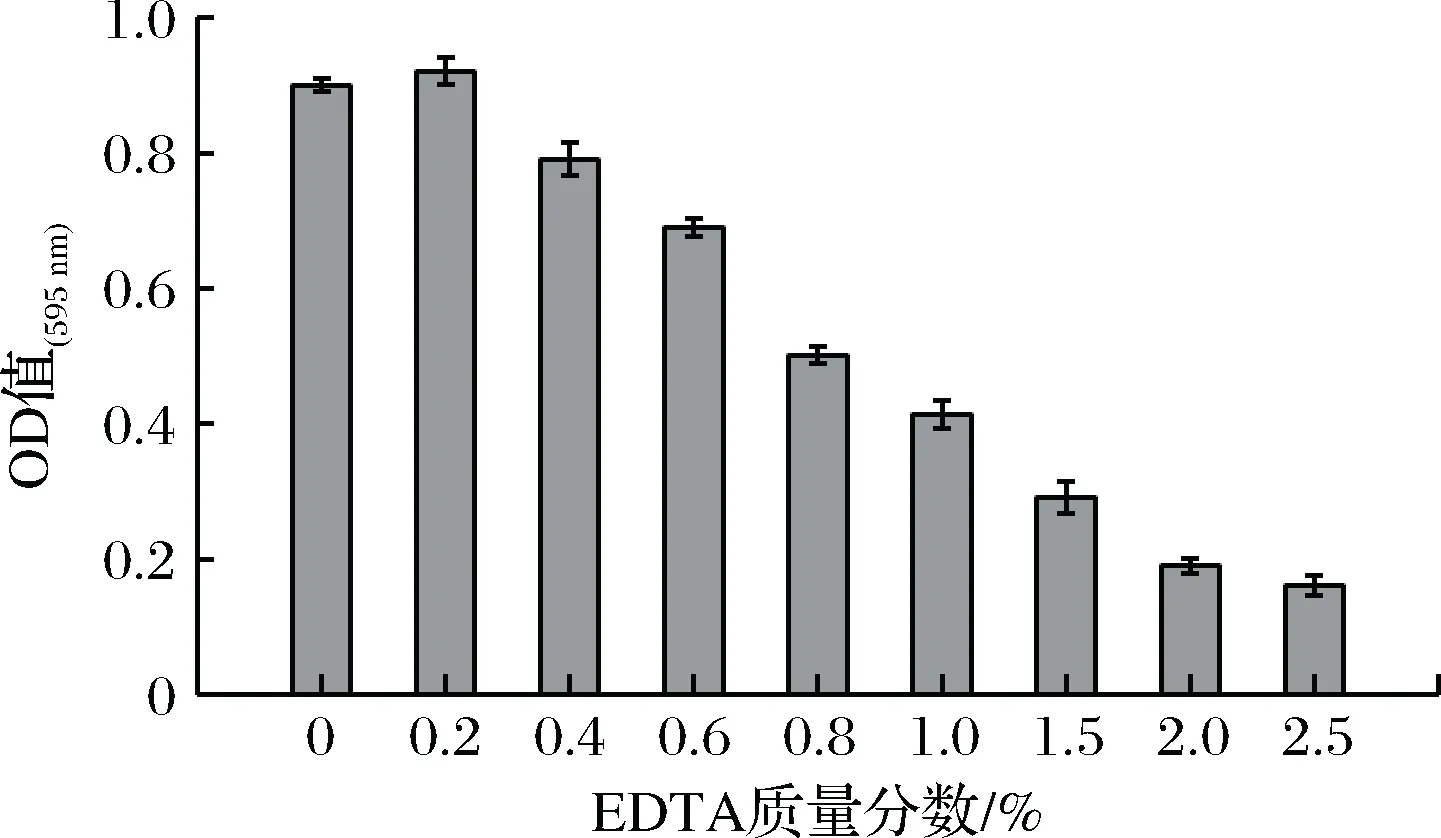
图5 EDTA对阪崎肠杆菌生物膜形成的影响Fig.5 Effect of EDTA on Cronobacter sakazakii biofilm formation
2.4 超声波法对玻璃表面阪崎肠杆菌生物膜去除作用的影响
2.4.1 超声初始温度对玻璃表面阪崎肠杆菌生物膜去除作用的影响
超声初始温度对玻璃表面阪崎肠杆菌去除作用有一定的影响(见图6)。超声初始温度低意味着超声过程中产生的热量少,随着超声初始温度的升高,脱落的活菌数越多,初始温度为30 ℃时,效果最好。当初始温度继续升高,脱落的活菌数下降,但仍较高,当初始温度超过50 ℃时,超声产热过多导致阪崎肠杆菌失活,从而使活菌脱落数降低。本实验结果表明,超声波解离阪崎肠杆菌菌株生物膜最优超声初始温度为30 ℃。

图6 超声波初始温度对阪崎肠杆菌玻璃表面生物膜去除影响Fig.6 Effect of ultrasonic initial temperature on lg(CFU/cm3) elimination of Cronobacter sakazakii biofilm on glass surface
2.4.2 超声时间对玻璃表面阪崎肠杆菌生物膜去除作用的影响
超声时间对玻璃表面阪崎肠杆菌生物膜去除作用有显著影响(见图7)。
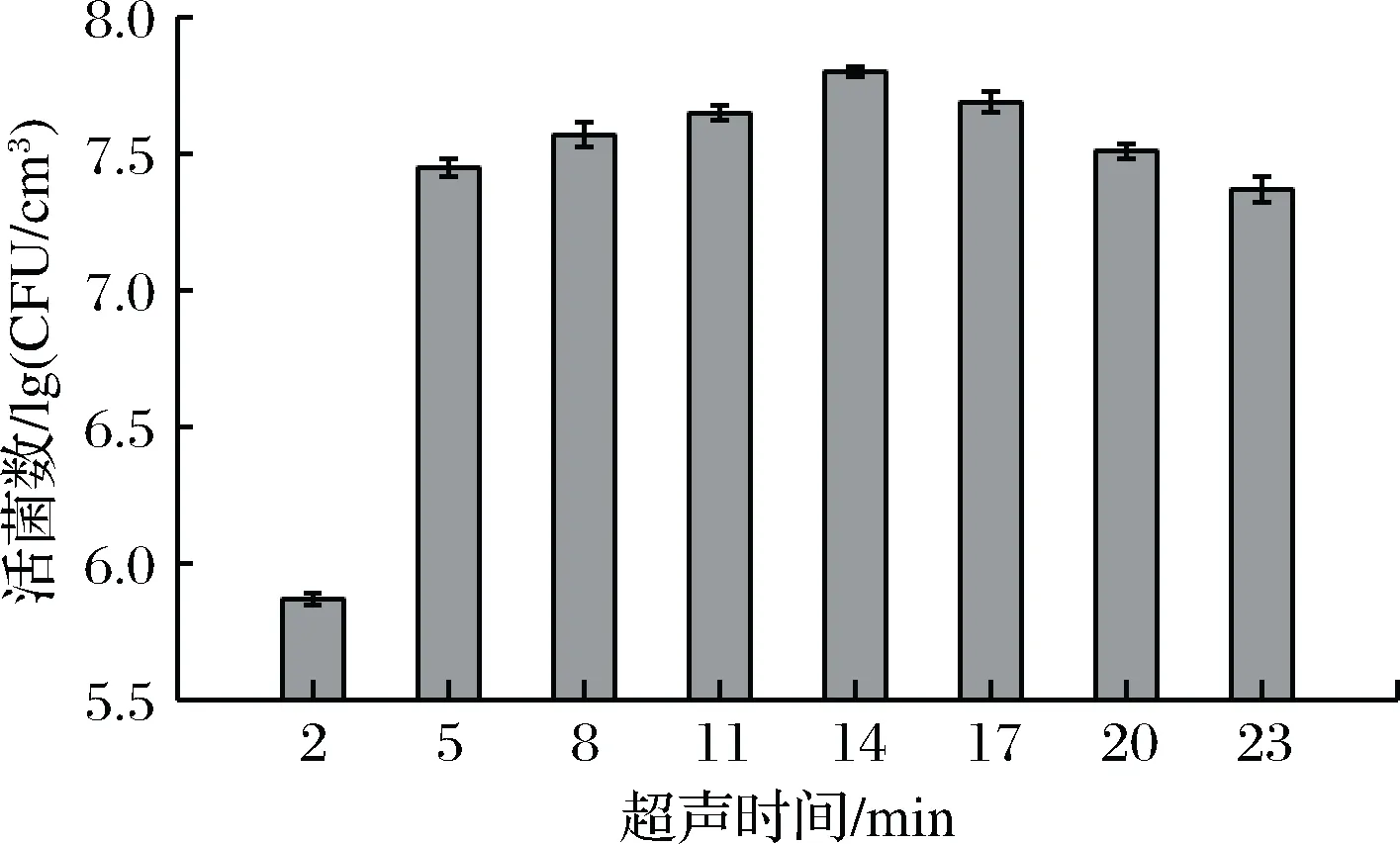
图7 超声波时间对阪崎肠杆菌玻璃表面生物膜去除影响Fig.7 Effect of ultrasonic time on lg(CFU/cm3) elimination of Cronobacter sakazakii biofilm on glass surface
当超声时间为2 min时,生物膜脱落效果不显著。这是因为生物膜有稳定的结构,需要一定的时间才能达到良好效果。随着时间的延长,活菌脱落数大幅度上升,当时间14 min时,脱落效果最好。但继续进行超声处理,其脱落效果下降,这可能是因为处理时间越久,温度越高。处理时间过长与温度过高导致菌体损失,致其死亡。本实验结果表明,超声波解离阪崎肠杆菌菌株生物膜最优超声时间为14 min。
2.4.3 激光共聚焦显微镜 (CLSM) 观察超声初始温度对玻璃表面阪崎肠杆菌生物膜脱落效果
图8为激光共聚焦显微镜观察SYTO9/PI染料对阪崎肠杆菌活死细胞染色变化直观图。图8-a为空白对照组,即未经过超声波处理组,都是绿色荧光,此时的阪崎肠杆菌最多。图8-b为超声波初始温度为20 ℃时活细胞量,盖玻片上的活细胞数量减少,图8-c为超声波初始温度为30 ℃时的活细胞量,玻片上生物膜几乎全部脱落。图8-d为超声波初始温度为50 ℃时的细胞,黄色代表死菌与活菌的重叠部分,阪崎肠杆菌不耐高温,当温度达到50 ℃时,阪崎肠杆菌即会出现部分死亡现象。从而当超声波初始温度超过一定温度时,温度越高,去除的活菌数越少。
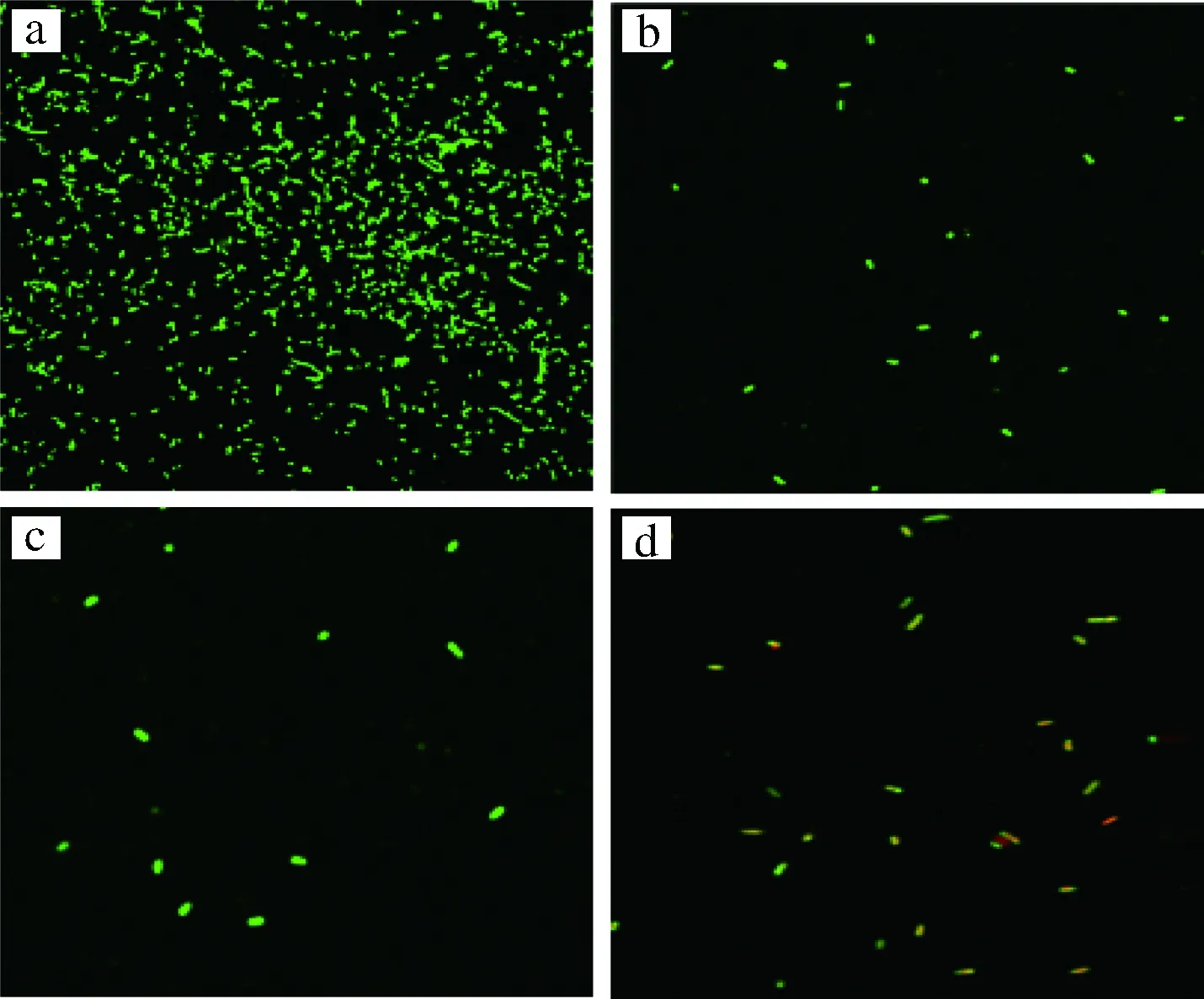
图8 CLSM观察超声温度对阪崎肠杆菌生物膜去除效果Fig.8 Laser scanning confocal microscopy of the elimination effect of the ultrasonic temperature on Cronobacter sakazakii biofilm注:a~d为超声波处理的Cronobacter sakazakii biofilm经CLSM (63×/1.4油镜)观察图。a为空白对照,未经超声波处理;b、c、d为实验组,超声波初始温度分别为20, 30,50 ℃。
2.4.4 激光共聚焦显微镜 (CLSM) 观察超声时间对玻璃表面阪崎肠杆菌生物膜脱落效果
图9为激光共聚焦显微镜观察SYTO9/PI染料对阪崎肠杆菌活死细胞染色变化直观图。图9-a为空白对照组,即未经过超声波处理组,可以清楚看到活细胞量很多。图9-b为超声波处理2 min后的活细胞量,可以看出玻片上活菌数量大幅度减少,表明超声波对活菌具有去除作用。图9-c为超声波处理14 min后的活细胞量,玻片上活菌几乎全部脱落。图9-d为超声波处理23 min后的细胞,黄色代表死菌与活菌的重叠部分,即出现了死细胞,这是因为处理时间过久,温度过高,导致菌体损伤,所以脱落的活细胞量减少。
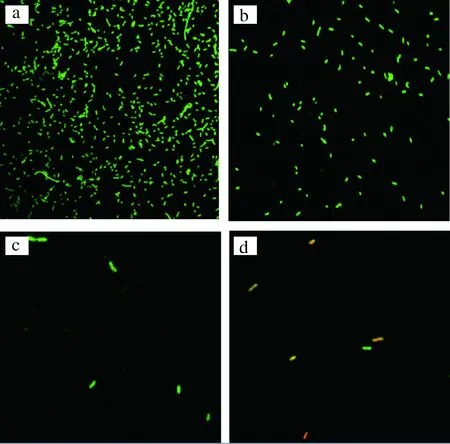
图9 CLSM观察超声时间对阪崎肠杆菌生物膜去除效果Fig.9 Laser scanning confocal microscopy of the elimination effect of the ultrasonic time on Cronobacter sakazakii biofilm注:a~d为超声波处理的Cronobacter sakazakii biofilm经CLSM(63×/1.4油镜)观察图。a为空白对照,未经超声波处理; b、c、d为实验组,超声波处理时间分别为2, 14,23 min。
3 结论
阪崎肠杆菌生物膜的形成受温度、培养基pH值及培养基成分的影响。形成阪崎肠杆菌生物膜的最适生长温度为37 ℃,最适培养基pH值为7.5。通过结晶紫染色法在倒置显微镜下可直接观察阪崎肠杆菌生物膜量的变化情况。2.5%以内盐度的培养基对生物膜形成有促进作用。加入适当的CaCl2和MgCl2均能提高生物膜量,CaCl2在质量分数为0.50%、MgCl2在质量分数为1.50%时能达到明显的促进作用。加入Cu2+、EDTA对生物膜有抑制作用,质量分数越大,抑制能力越强。一定功率的超声波能够促进玻璃表面阪崎肠杆菌生物膜的脱落,其效果受超声处理的温度与时间影响。本试验结果得到的最佳超声初始温度为30 ℃,最佳超声时间为14 min。激光共聚焦可直接观察到超声温度和超声初始时间对玻璃表面阪崎肠杆菌生物膜去除效果的影响。基于超声波对玻璃表面阪崎肠杆菌的去除作用效果,该法可用于辅助其他灭菌法对婴儿玻璃制奶瓶,盛装食品玻璃瓶等玻璃制品上的阪崎肠杆菌进行解离。
