L-鼠李树胶糖-1-磷酸醛缩酶立体选择性的半理性改造合成D-阿洛酮糖
2018-08-10汪马燕李子杰高晓冬
汪马燕,李子杰,高晓冬
(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
目前,肥胖、高血脂、高血压和糖尿病等疾病的发病率迅速增加,主要原因是过度摄入高脂肪和高糖的食物。因此,低热量的稀有糖(rare sugar)引起了广泛关注。国际稀有糖协会(ISRS)对稀有糖的定义:自然界中存在但含量极低的一类单糖及其衍生物[1]。尽管稀有糖在自然界含量很少,却在膳食、医药、保健等领域拥有重要地位,如低卡路里的木糖醇、甘露糖醇和赤藓糖醇等在食品工业已得到广泛应用[2]。
根据稀有糖的定义,D-阿洛酮糖属于一种稀有单糖[3],在分类上,D-阿洛酮糖属于己酮糖,是D-果糖三位碳所对应的差向异构体(图1)。D-阿洛酮糖能够作为一种零能量、不被消化的食用糖替代品[4-5]。商业碳水化合物和农产品中D-阿洛酮糖含量相当少,只有某些天然植物如鼠刺的提取物中含有少量D-阿洛酮糖[6]。由于D-阿洛酮糖具有零热量,难以被肠道消化吸收等特性[7],被美国食品导航网评价为最具潜力的蔗糖替代品,现多被引用为新型低卡路里甜味剂[8]。同时,D-阿洛酮糖也可以作为肝脂类酶和肠道α-糖苷酶的抑制剂,减少脂肪堆积[9]。SUNA等研究结果显示D-阿洛酮糖通过抑制睾丸组织中ROS的产生,阻止邻苯二甲酸二(2-乙基)乙酯诱导的睾丸损伤[10]。此外D-阿洛酮糖除了对6-羟基多巴胺诱导的细胞凋亡有神经保护的作用外,还能抑制高浓度葡萄糖诱导下的单核细胞趋化蛋白MCP-1的表达[11]。基于D-阿洛酮糖诸多的生理功能,在未来食品、医药和化妆品等领域的应用将会非常广泛。美国的食品药品监督管理局(FDA)于2002年已经批准D-阿洛酮糖为公认安全食品(generally recognized as safe,GRAS)[3,5],这为其工业化应用提供了有力的保障。
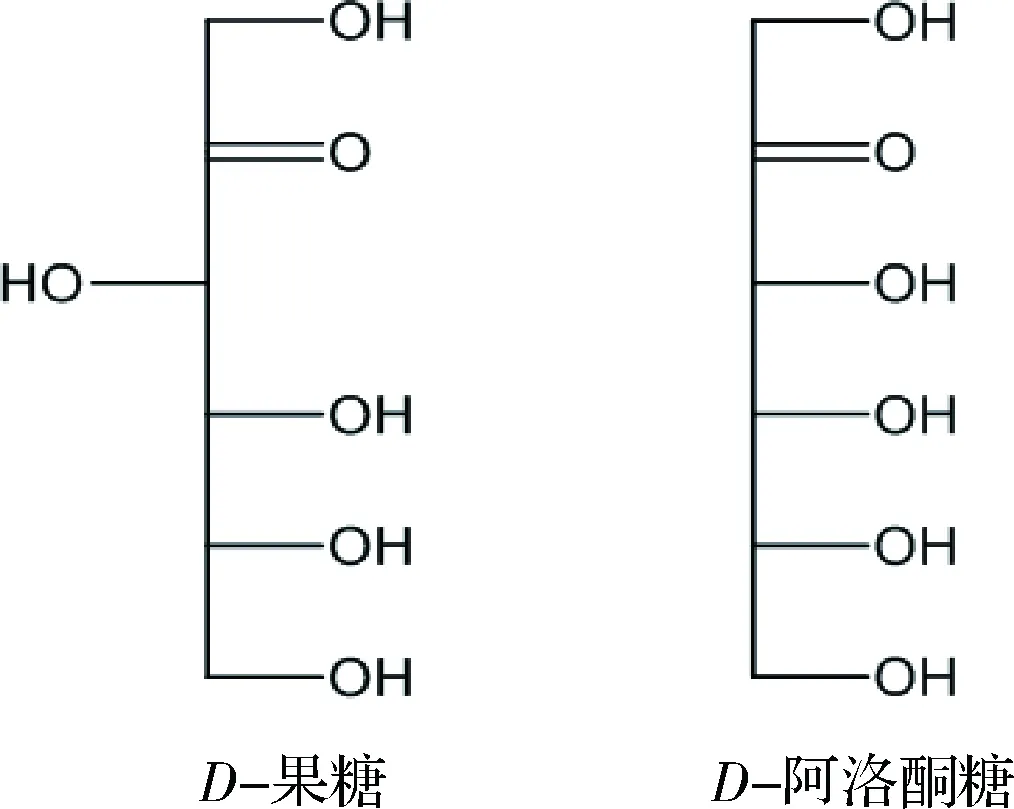
图1 D-果糖和D-阿洛酮糖的结构式比较Fig.1 Structural comparison of D-fructose and D-psicose
D-阿洛酮糖功能活性与人类健康密切相关,建立完善的高产体系迫在眉睫。目前D-阿洛酮糖的研究瓶颈主要集中在如何扩大产业化生产。早期D-阿洛酮糖的合成方法是化学转化,其合成过程不仅繁琐还存在一定的局限性,更不符合当今绿色可持续发展的社会理念[12-13]。目前生产D-阿洛酮糖主要是利用酶固定转化法,即对酶的克隆表达以及产物的分离精制[14]。不论是化学合成法还是生物转化法制备D-阿洛酮糖,都存在一个大难题,产品分离与精制十分困难[6]。粗产品中的D-阿洛酮糖往往与其他糖混合在一起,不仅产率降低,而且D-阿洛酮糖与其混杂的糖理化性质几乎完全相同,所以很难精制与提纯[13]。为了对当前的D-阿洛酮糖合成体系进行优化,就必须解决这一难题。
在醛缩酶家族中,磷酸二羟基丙酮(dihydroxyacetone, phosphate,DHAP)依赖型醛缩酶是应用最广的一类醛缩酶。该类醛缩酶催化供体DHAP与受体醛的缩合反应,生成的产物具有两个新的立体中心,并且这两个立体中心的构型一般由醛缩酶来决定[15-16]。前期研究显示,大肠杆菌MG1655来源的野生型L-鼠李树胶糖-1-磷酸醛缩酶(L-rhamnulose-1-phosphate aldolase,RhaD)在以D-甘油醛作为醛受体时,失去了对该醛受体的立体选择性,产生的D-阿洛酮糖与D-山梨糖比例约为1∶1,不利于D-阿洛酮糖的分离纯化[17]。据报道,ANDREAS等人经实验得出大肠杆菌来源的Ⅱ型醛缩酶L-墨角藻糖-1-磷酸醛缩酶(L-fuculose-1-phosphate aldolase,FucA)的113位酪氨酸(Tyrosine,Tyr)是影响醛受体结合的一个重要位点[18-19]。RhaD与FucA同属II型DHAP依赖型醛缩酶,我们推测其在催化机理上存在相似性。酶的组氨酸残基从供体上攫取一个质子得到烯醇负离子,该烯醇负离子对醛受体发起亲核进攻组氨酸和醛受体需要辅助金属离子 Zn2+在活性位点配位(图2-a)。
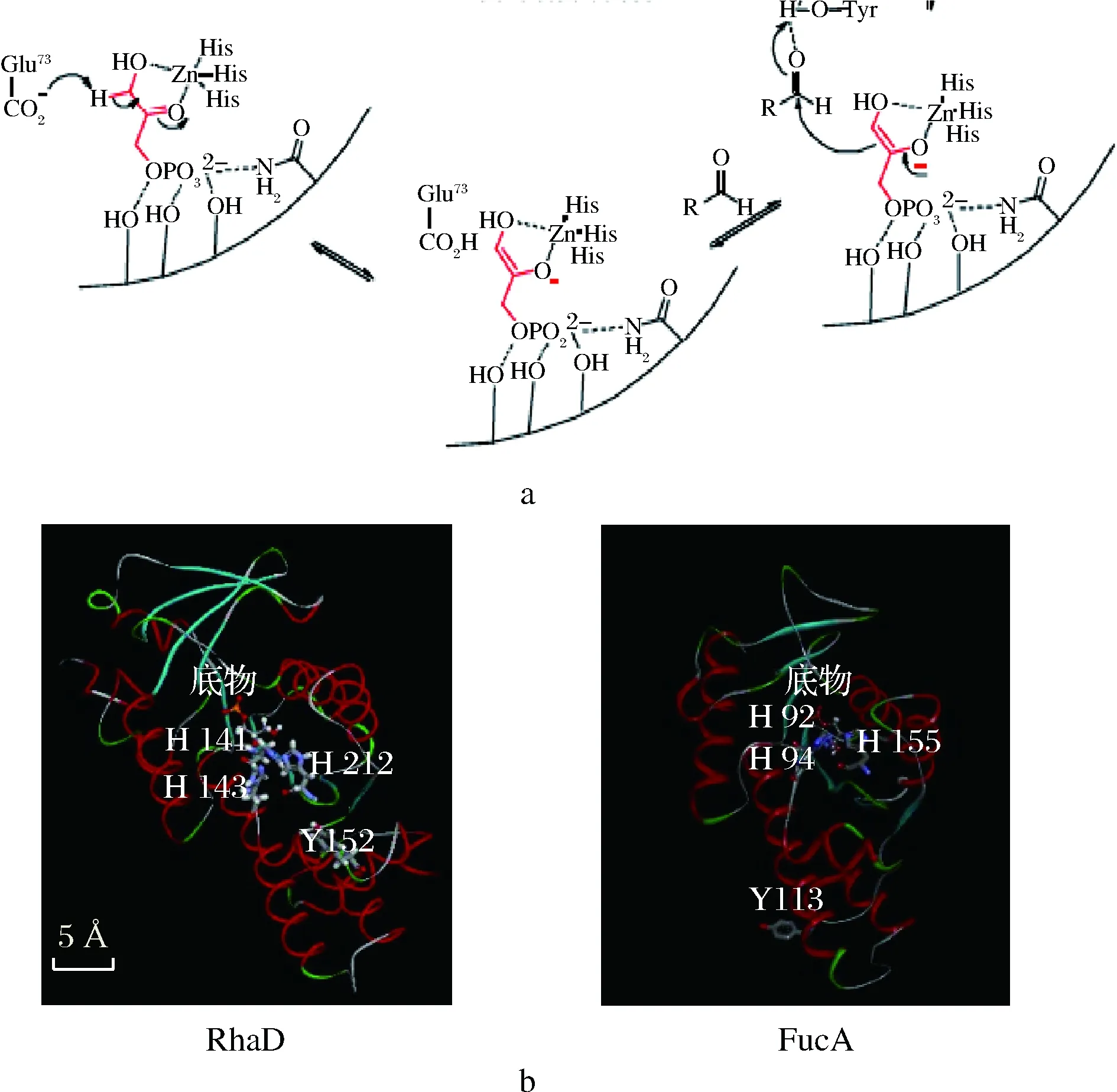
a-DHAP依赖II型醛缩酶催化机理图;b-FucA与RhaD酶分子结构图图2 FucA与RhaD酶分子结构图示以及催化机理Fig.2 Molecular structure and catalytic mechanism of FucA and RhaD
FucA的第92位、第94位、第155位3个组氨酸结合辅助的金属离子,同时从底物分子上摄取质子,这是一个可逆的过程。对比蛋白分子模型图,我们知道RhaD的第141、143以及第212位3个组氨酸残基行使类似的催化过程(图2-b)。基于氨基酸序列比对发现,RhaD和FucA在酪氨酸位点上具有保守性:FucA的113位酪氨酸对应RhaD的152位酪氨酸。本研究通过定点饱和突变对RhaD的152位酪氨酸进行半理性改造,提高该酶对D-甘油醛的立体选择性,使得专一性合成D-阿洛酮糖。
1 材料与方法
1.1 质粒和菌株
大肠杆菌MG1655、XL10-gold和Rosetta(DE3)本实验室保存。菌株XL10-gold/pET28a-rhaD、Rosetta/pET28a-rhaD为实验室前期构建。用于基因扩增的引物在华大基因合成。
1.2 酶、试剂及耗材
过氧化氢酶(catalase)、酸性磷酸酶(acid phosphatase from sweet potato,AP)、异丙基-β-D-硫代半乳糖苷(IPTG)、硫酸卡那霉素(Kan)、磷酸二羟基丙酮(DHAP)、D-甘油醛(D-glyceraldehyde)、D-山梨糖(D-sorbose)、D-阿洛酮糖(D-psicose)购于Sigma-Aldrich;Ni2+亲和层析柱购自于GE;BCA蛋白浓度测定试剂盒(加强型)购置于碧云天;Aminex HPX-87H色谱柱(300 mm×7.8 mm)购于Bio-Rad公司;TLC硅胶铝板购于Merck KGaA;定点突变试剂盒购自北京全式金生物科技有限公司;PCR反应所需试剂均购买于TaKaRa公司;质粒小量制备试剂盒购于上海生工生物工程股份有限公司。
1.3 培养基及其他溶液配制
LB培养基:酵母浸出物5 g/L,胰蛋白胨10 g/L,NaCl 5 g/L,琼脂20 g/L(固体培养基),高压灭菌(121 ℃,20 min)。
TB培养基:酵母浸出物24 g/L,胰蛋白胨12 g/L,K2HPO4·3H2O 16.4 g/L,KH2PO42.31 g/L,甘油0.4%(V/V)。
用于蛋白纯化缓冲液:裂解、平衡缓冲液:25 mmol/L Tris-HCl(pH=7.8),150 mmol/L NaCl;洗涤缓冲液:25 mmol/L Tris-HCl(pH=7.8),150 mmol/L NaCl,60 mmol/L imidazole;洗脱缓冲液:25 mmol/L Tris-HCl(pH=7.8),150 mmol/L NaCl,500 mmol/L imidazole;脱盐缓冲液:25 mmol/L Tris-HCl(pH=7.8),50 mmol/L NaCl。
1.4 主要仪器
iMarK酶标仪(Bio-Rad);蛋白纯化系统AKTAavant;高效液相色谱HPLC(HITACHI);超声波细胞粉碎机(南京新辰生物科技有限公司)。
1.5 表达载体pET28a-rhaDY152X152位突变的构建
为了对RhaD152位的酪氨酸进行定点饱和突变,分别以丙氨酸等19种氨基酸来代替酪氨酸。以本实验室质粒保藏菌提取目的质粒pET28a-rhaD,设计并合成定点突变引物共19对 (表1)。

表1 RhaD152位的酪氨酸定点饱和突变引物Table 1 Primers for site-saturation mutagenesis oftyrosine 152 of RhaD
注:下划线上的字母代表突变位点。
以152位酪氨酸突变成丙氨酸为例进行说明,PCR扩增合成氨基酸突变后的质粒pET28a-rhaDY152A。50 μL体系如下:质粒(10 ng),上下游引物(10 μmol/L),2×TransStart FastPfu PCR Super Mix (25 μL)。PCR条件:94 ℃,2~5 min;94 ℃,20 s;55 ℃,20 s;72 ℃,7 min,20个循环;72 ℃,10 min)。电泳检测目的条带大小正确后,用突变试剂盒DMT酶,37 ℃孵育1 h。取2~5 μL DMT酶消化产物转化大肠杆菌,并涂布到LB (Kan)(50 μg/mL)抗性平板上。挑选单菌落提取质粒酶切鉴定及测序,最终得到19种RhaD 152位酪氨酸定点突变的表达载体。
1.6 RhaD野生型及突变体蛋白在大肠杆菌Rosetta中的诱导表达
将携带野生型和突变型质粒(如pET28a-rhaD和pET28a-rhaDY152X)转化到Rosetta(DE3)感受态细胞,涂到LB(Kan)平板上,37 ℃过夜培养,然后挑选单菌落接种LB(Kan)液体培养基中,37 ℃过夜培养,取2 mL菌液接种到200 mL TB(Kan)液体培养基中,37 ℃振荡培养。3~4 h后OD600=0.6~0.8,转16 ℃培养同时加入200 μL IPTG(终浓度0.1 mmol/L)诱导表达。(在此之前取500 μL菌液作为诱导前样品),加入诱导剂后,16 ℃继续培养20 h(取诱导后500 μL菌液作为诱导后样品),离心收集菌体(8 000g,2 min,4 ℃),准备纯化。
1.7 RhaD野生型以及突变体蛋白的分离纯化
基于前期研究基础上[20-21],我们探索出适合纯化醛缩酶用以生产稀有糖的一系列方法流程。即用15~20 mL预冷的裂解缓冲液重悬以上收集的菌体,超声破碎。破碎约25 min后(超声破碎5 s,间隔5 s),镜检直至破碎完全。将破碎后的菌体离心(12 000g,30 min,4 ℃),利用蛋白纯化系统AKTAavant纯化上清中的蛋白(具体步骤:先用预冷的平衡缓冲液平衡镍亲和层析柱5 mL HisTrpTMHP;接着以1.5 mL/min上样,上样结束后,以预冷的洗涤缓冲液洗去非特异性结合的杂蛋白;最后换洗脱缓冲液洗脱目的蛋白,收集洗脱峰取样并进行SDS-PAGE检测)。纯化后的蛋白用超滤管脱盐后用BCA试剂盒测定蛋白浓度。
1.8 RhaD醛缩酶突变体的立体选择性分析
以DHAP和D-甘油醛为底物的反应体系如下:DHAP(0.5 mol/L,5 μL,50 mmol/L),D-甘油醛(0.5 mol/L,3 μL,30 mmol/L),RhaD醛缩酶(终质量浓度为0.5 mg/mL),加入50 mmol/L Tris-HCl (pH=7.8)缓冲液使反应终体积为50 μL。30℃反应12 h后,取1 μL反应液进行TLC检测[展开剂为正V(丁醇)∶V(乙酸)∶V(水)=2∶1∶1],茴香醛染色检测酮糖-1-磷酸的生成。用6 mol/L HCl调节反应液pH值为4.6,然后加入0.25 μL AP,30 ℃反应10 h,取1 μL TLC检测,用0.1 mol/L NaOH将pH调至7.0终止反应。反应上清液用HPLC检测分析稀有糖的种类及比例。HPLC检测条件如下:Bio-Rad Aminex HPX-87H,流动相为5 mmol/L的稀硫酸水溶液,流速为0.5 mL/min,日立示差检测器(HITACHI RI),进样量为20 μL。D-阿洛酮糖、D-山梨糖的保留时间分别为11.23 min和12.55 min。采用相同条件进行D-阿洛酮糖和D-山梨糖的标准曲线的绘制。
2 结果与分析
2.1 表达载体pET28a-rhaDY152X152位突变的构建
前期研究表明大肠杆菌来源的FucA醛缩酶的第113位的酪氨酸是参与醛受体分子结合的重要位点。通过NCBI中Blastp对大肠杆菌来源的RhaD和FucA进行氨基酸序列比对。结果显示:RhaD与FucA在酪氨酸位点上具有高度保守性,即RhaD第152位酪氨酸与FucA第113位酪氨酸对应(图3)。

图3 RhaD和FucA氨基酸序列比对Fig.3 Amino acid sequence alignment of aldolases RhaD and FucA
以质粒pET28a-rhaD为模板,经过单酶切验证扩增出完整质粒大小约6 194 bp的条带,rhaD基因片段大小为825 bp,pET-28a载体大小为5 369 bp,以pET-28a质粒单酶切作为对照(图4),重组质粒经过双酶切,能够切出rhaD基因大小的片段,与预期的结果相吻合,重组质粒经过测序表明突变成功。
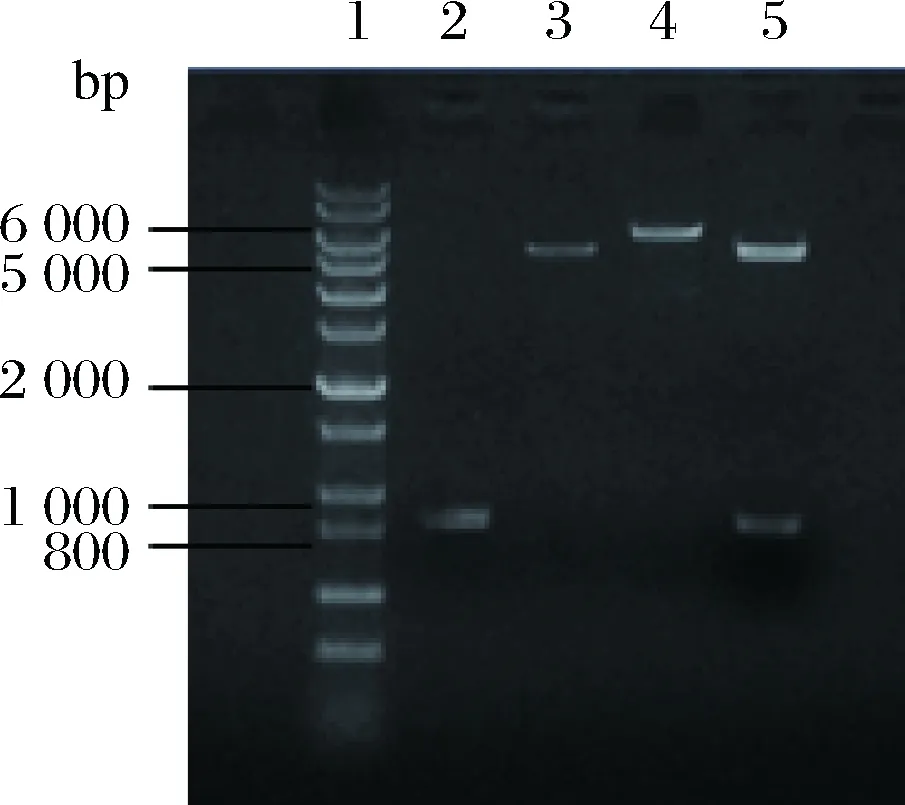
1-DNA Marker (1 kb plus);2-rhaD片段(825 bp);3-质粒pET-28a经EcoR I单酶切产物;4-PCR扩增得到重组质粒pET28a-rhaDY152X EcoR I单酶切产物;5-重组质粒pET28a-rhaDY152X EcoR I和BamH I双酶切产物图4 表达载体pET28a-rhaDY152X152位突变的构建Fig.4 Construction of expression plasmid pET28a-rhaDY152X
2.2 RhaD突变体蛋白在大肠杆菌Rosetta中的诱导表达
以丙氨酸和色氨酸分别取代152位的酪氨酸的RhaD突变体蛋白的表达纯化为例进行说明。根据SDS-PAGE结果分析(图5),经IPTG诱导后在约30 kDa处出现一条蛋白条带(3号泳道),与预期结果一致,对比之下,未经IPTG诱导的菌体(2号泳道)没有出现目的带,说明RhaD突变体蛋白成功表达。细胞破碎上清液,经过镍柱纯化后,蛋白纯度在95%以上。
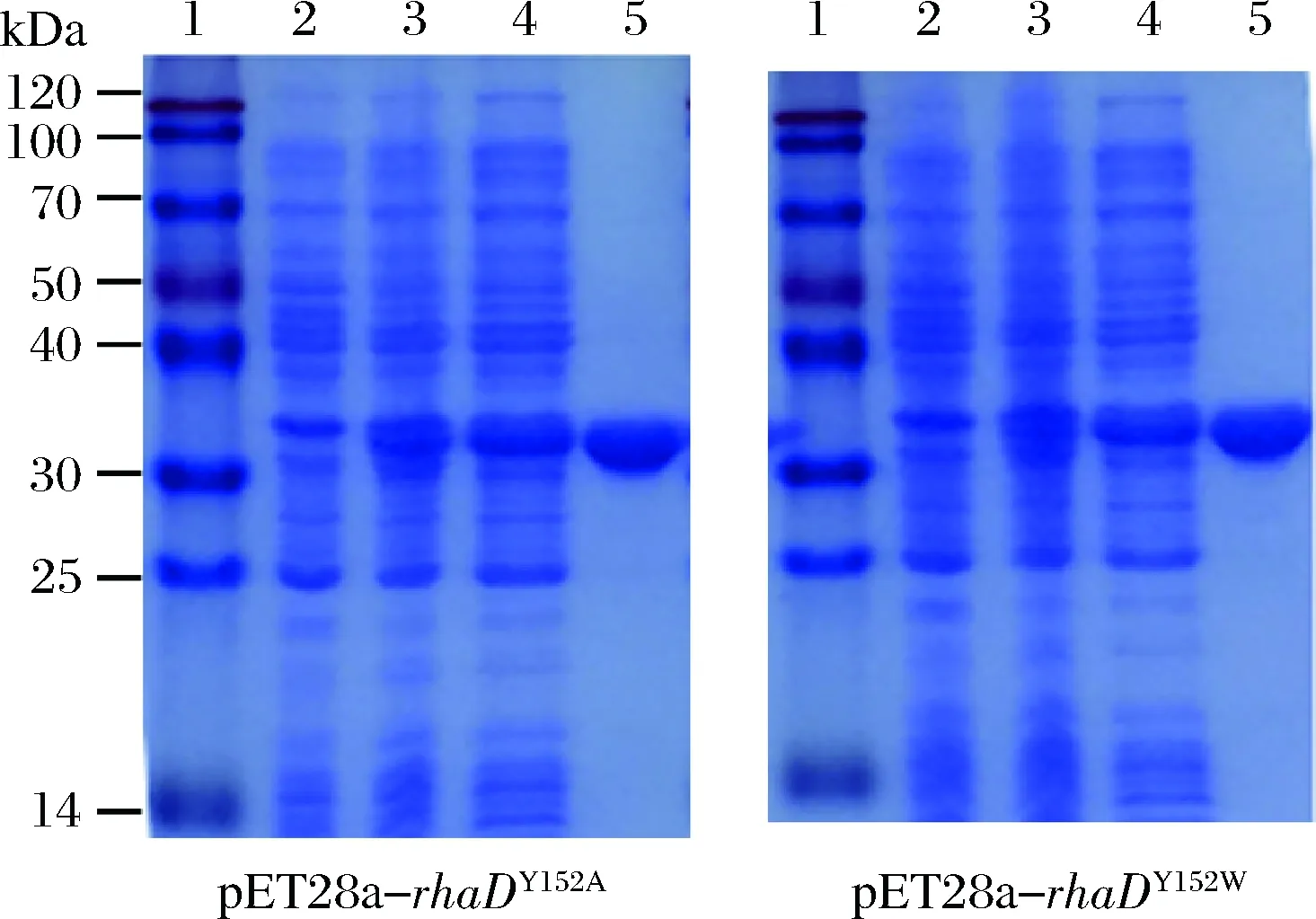
1-蛋白Marker;2-诱导前全细胞;3-诱导20 h后的全细胞;4-细胞裂解上清;5-纯化后的RhaD图5 SDS-PAGE 检测RhaD突变体的表达与纯化Fig.5 SDS-PAGE analysis of expression and purification of RhaD mutants
2.3 TLC检测RhaD突变体的酶活
以DHAP作为供体分子,以D-甘油醛为受体分子,经纯化后的RhaD突变体的催化,生成相应的酮糖-1-磷酸。在酸性磷酸酶AP的作用下,脱掉磷酸基团得到相应的酮糖。以突变体RhaD Y152A和RhaD Y152W为例进行说明。TLC结果显示(图6):两种突变体均可以催化DHAP和D-甘油醛合成酮糖-1-磷酸并在TLC板上显示深蓝色(a箭头所示);用AP处理后,可以脱掉磷酸基团得到相应的酮糖(b箭头所示)。
2.4 HPLC分析RhaD突变体的立体选择性

a-为RhaDY152A突变体催化的反应; b-RhaDY152W突变体催化的反应1-D-甘油醛;2-DHAP;3-反应0 h;4-反应20 h(脱磷酸前产物);5-脱磷酸后产物图6 TLC分析RhaD突变体的活性Fig.6 TLC analysis of the activities of RhaD mutants
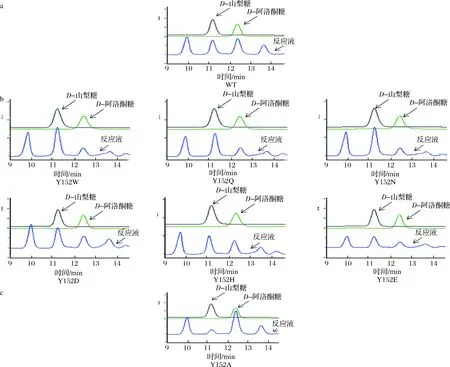
a-野生型RhaD催化的反应;b-6种代表性的RhaD突变体倾向于生成D-山梨糖的反应;c-RhaD Y152A突变体中倾向于生成D-阿洛酮糖的反应图7 HPLC分析RhaD突变体的立体选择性Fig.7 HPLC analysis of the stereoselectivity of RhaD
为了分析RhaD突变体的立体选择性,利用HPLC对反应产物及其比例进行检测,并以野生型RhaD醛缩酶催化的反应作为对照。前期结果表明,以DHAP和D-甘油醛作为底物,在野生型RhaD醛缩酶的作用下,生成D-山梨糖和D-阿洛酮糖两种稀有糖并且两种稀有糖的比例约为1∶1。如图7-a所示,本结果与前期结果保持一致,两者的比例接近与1∶1。在这19种RhaD突变体催化的反应(表2),突变体Y152W,Y152Q,Y152N,Y152D,Y152H,Y152E,Y152G,Y152K,Y152P,Y152S,Y152T,Y152V,Y152M共计13种均倾向于生成D-山梨糖,选取6种代表性的突变体的液相检测图(图7-b所示),最高比例10.8∶1(突变体Y152W)。突变体Y152F,Y152I,Y152R的立体选择性保留与野生型一样的趋势,同时也存在部分表现为酶失活的失败突变(Y152C,Y152L)。RhaDY152A催化的反应倾向于生成D-阿洛酮糖(如图7-c),两者的比例约为8∶1。
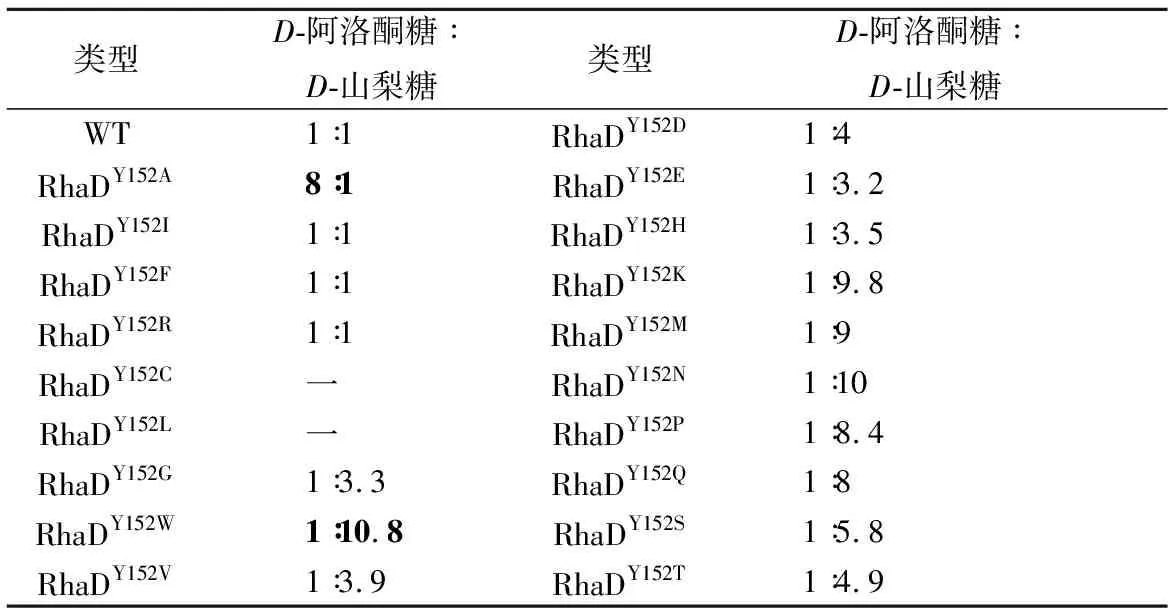
表2 RhaD所产稀有糖种类及其比例Table 2 Results of RhaD and mutants for rare sugarssynthesis and ratios
3 结论
本研究结果表明大肠杆菌来源的RhaD醛缩酶的第152位酪氨酸的定点饱和突变能够显著影响该酶的立体选择性。其中RhaDY152A更倾向于生成D-阿洛酮糖,推测可能由于丙氨酸是空间位阻最小的氨基酸,对D-甘油醛在RhaD活性口袋中的定位有着重要影响,下一步的工作将通过测定该突变体的酶动力学参数来分析立体选择性发生改变的原因。虽然RhaD Y152A突变体催化的反应仍有少量的D-山梨糖产生,需要对更多的氨基酸位点进行理性改造,使其能够专一性地合成高附加值的D-阿洛酮糖,这对于解决稀有糖同分异构体的分离纯化问题具有重要意义。
基于生物信息技术的日臻成熟,我们将采用计算机模拟对底物分子与酶分子进行对接,分析系统能量最小化时,底物与酶分子发生相互作用的关键氨基酸。通过对酶分子(半)理性改造,找到能专一性合成高附加值D-阿洛酮糖的突变体,应用到D-阿洛酮糖的工业化生产。而这一设想的提出,对今后更多DHAP依赖II型醛缩酶的立体选择性研究提供了理论依据和方法。
