重症胰腺炎急性肺损伤大鼠清胰汤灌胃治疗后肺组织炎症反应变化及其机制
2018-08-03胡炜王曼雪张桂贤李东华张一刘洪斌
胡炜,王曼雪,张桂贤,李东华,张一,刘洪斌,
(1天津医科大学研究生院,天津300070;2天津市南开医院;3天津市医药科学研究所)
重症急性胰腺炎(SAP)是临床常见的急腹症之一[1]。急性肺损伤(ALI)是导致重症急性胰腺炎患者早期高病死率的主要原因[2]。胰腺腺泡细胞损伤后,释放出与细菌同源的线粒体DAMP分子(mitochondrial DAMPs, MTD),包括甲酰肽、线粒体DNA及胞内ATP等;MTD可通过多种机制激活机体各种免疫系统,介导中性粒细胞(PMN)、巨噬细胞等炎症效应细胞之间的信号传导,刺激或抑制炎症反应[3,4],造成“脱颗粒”现象,可能是SAP早期诱发多脏器功能衰竭综合征(MODS)的机制。已有研究[5~7]证实,向大鼠静脉中注入MTD可引起肺、肾、肝等组织器官释放IL-6、IL-10、Tolls、TNF-α等炎症因子,造成组织炎症损伤。研究[8]表明,清胰汤可通过减少肠道的菌群移位,有效抑制胃肠道对内毒素的吸收作用,保护肠屏障,从而降低血清中内毒素的含量,起到对肺脏的保护作用。但清胰汤能否通过MTD-甲酰肽受体(FPRs)途径作用于重症急性胰腺炎急性肺损伤(SP-ALI),目前尚无研究报道。本研究观察了SP-ALI大鼠清胰汤灌胃治疗后肺组织炎症反应变化,并观察了肺组织中FPR1和FPR2的表达变化,探讨清胰汤的治疗作用机制。
1 材料与方法
1.1 实验动物及主要材料 健康Wistar大鼠30只(天津放射医学研究所提供),雄性,体质量(300±10)g。大鼠适应环境1周后开始实验。牛磺胆酸钠购自美国Sigma公司。清胰汤由南开医院急腹症研究所提供。anti-FPR1购自美国Fitzgerald公司。anti-FPR2购自美国Invitrogen公司。山羊抗兔IgG-HRP购自中杉金桥公司。Revert Aid First Strand cDNA SynthesisKit、Max ima SYBR Green/Fluore scein Qpcr Master Mix(2×)均由Thermo公司提供。化学发光分析仪、iQ5荧光定量PCR仪购自美国Bio-Rad公司。NanodroPND-2000超微量核酸蛋白测定仪购自Thermo公司。DM4000B显微镜、M4000B图像采集仪购自德国Leica公司。
1.2 SP-ALI模型制备及清胰汤用法 将大鼠随机分为3组,清胰汤组、模型组、对照组各10只。参照文献[9]方法,动物实验前禁食12 h,不禁水。清胰汤组在实验前30 min给予清胰汤10 mL/kg灌胃,其余两组给予等量的生理盐水。术前腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉。清胰汤组与模型组在大鼠胆胰管内逆行注射5%牛磺胆酸钠1 mL/kg,速率为0.05 mL/min,观察5~10 min后关腹。对照组仅在开腹后轻轻翻动胰腺,即关闭腹腔。将各组大鼠放回鼠笼常规饲养,密切关注其生命体征。
1.3 肺组织病理观察 24h后,颈椎脱臼法处死大鼠,取出各组肺组织固定在10%的甲醛溶液中,24 h后脱水包埋,做4 μm厚切片。病理损伤评分参照文献[10]。
1.4 肺组织中FPR1、FPR2 mRNA检测 采用RT-PCR法。取各组大鼠肺组织,手提动物组织总RNA,引物由生工Sangon Biotech公司合成。在Bio-Rad荧光PCR仪中进行扩增,通过溶解曲线得到管家基因与目的基因的Ct值,用2-ΔΔCt表示目的基因相对表达量。
1.5 肺组织中FPR1、FPR2蛋白检测 采用Western blotting法。取各组大鼠肺组织,提取总蛋白,BCA法测定蛋白浓度,经10%SDS-PAGE电泳,转膜,室温封闭1 h,加入anti-FPR1(1∶500)、anti-FPR2(1∶500)、anti-Tublin(1∶2 000)孵育,4 ℃过夜;次日加入二抗羊抗兔(1∶5 000)室温孵育1 h,TBST洗膜后,显色;Quantity One软件进行图像分析,以目的蛋白与内参蛋白的吸光度比值表示目的蛋白的相对表达量。
2 结果
2.1 各组肺组织病理损伤评分比较 与对照组相比,模型组肺组织有明显肺血肿、肺淤血表现,大部分肺泡间隔明显增宽,肺泡腔部分融合成肺大泡,肺泡中有大量的PMN、巨噬细胞浸润,而清胰汤组上述炎症反应则明显减轻;与对照组相比,模型组肺组织中可见明显的肺泡水肿,大量的中性粒细胞浸润等病理表现,清胰汤组炎细胞浸润、肺泡水肿程度较模型组明显降低。在高倍镜视野下清胰汤组、模型组、对照组病理评分分别为(1.34±0.32)、(2.10±0.57)、(0.16±0.03)分,模型组肺组织病理损伤评分高于对照组(P<0.01),清胰汤组肺组织病理损伤评分低于模型组(P<0.05)。
2.2 各组肺组织中FPR1、FPR2 mRNA及蛋白表达比较 模型组肺组织中FPR1、FPR2 mRNA和蛋白相对表达量高于对照组,清胰汤组肺组织中FPR1、FPR2 mRNA和蛋白相对表达量低于模型组(P均<0.01)。详见表1。
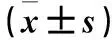
表1 各组肺组织中FPR1、FPR2 mRNA及蛋白相对表达量比较
3 讨论
因SP-ALI早期病死率高,如何有效防治SP-ALI越来越受到大家的关注。SAP中腺泡细胞的“早期事件”启动的固有免疫炎症反应,在SAP早期MODS发生机制中占重要地位,对SAP的转归至关重要[3,4]。国际上近年来关于固有免疫与炎症关系的免疫学新机制,提出了损伤相关分子模式(DAMP)。研究[11]表明,线粒体DAMP分子 (MTD)在创伤、脓毒症及器官损伤发生中具有关键作用。本课题组前期实验[12]将胰腺腺泡中的MTD注射入大鼠肺脏、肾脏、肝脏中,均可观察到严重的病理组织损伤,表明MTD可触发过强的炎症反应。也有报道[13]称,在SAP早期,胰腺腺泡破坏,各种胰酶酶原激活,胰腺自身被消化,大量的MTD释放入血,内含有甲酰肽、线粒体DNA(mtDNA)、细胞内ATP分子等信号分子,MTD通路启动造成全身各器官、组织损伤,可能是SAP早期MODS的反应机制。
甲酰肽是一种由微生物和组织细胞分泌的趋化性物质,可在感受到外来抗原病原体时,趋化中性粒细胞的聚集,属于一种白细胞趋化性肽。一方面,肺组织中聚集的甲酰肽趋化因子能被肺泡里的PMN、巨噬细胞等炎症效应细胞表面的FPRs(包括FPR1和FPR2)识别为外源性物质,启动固有免疫系统,可使炎细胞的形态发生改变,趋化活性增高,细胞黏附、迁移能力增强,细胞颗粒释放及产生过氧化物等,清除入侵的病原体[14]。这种由FPR介导的趋化反应、细胞脱颗粒和“失敏反应”等生物学功能,对急性肺损伤的发生具有重要的作用。另一方面,释放入血的mtDNA与TOLL样受体9(TLR9)结合,TLR9进一步激活NF-κB;胞内ATP与嘌呤型受体P2X7结合,P2X7可刺激炎症小体;激活的NF-κB与炎症小体也可刺激炎症前体并且释放大量的炎症因子[15]。还有研究表明,甲酰肽也可作用于微血管内皮细胞表面的甲酰肽受体,启动细胞骨架RhoA/Rock通路,它们具有GTP酶的活性,可激发肌动蛋白聚合、内皮细胞收缩、细胞与细胞间孔隙扩大、巨噬细胞等炎症效应细胞发生渗漏,可引起水肿、毛细血管渗漏症等[16]。故我们推测若可以阻断上述途径,可能对SAP早期的MODS具有一定的防治作用。
SP-ALI在中医属于“胃痛”“下心痛”范畴。中医学认为,饮食伤胃,肝脾瘀滞,湿热瘀结于中焦,致肝胆失调、脾胃不和、气机不畅、疏泄不利、气滞血瘀而发为本病[17]。故在治疗方面,遵循六腑以通为用的原则,由大黄、芒硝、延胡、白芍、木香、柴胡、黄芩、胡黄连八种药物组成的清胰汤基础方,具有清热解毒、疏肝解郁、通里攻下的功能,用于治疗SAP及SP-ALI治疗效果较好。清胰汤能使SAP肺组织中TNF-α、AQP-1等炎症因子的表达明显下调,进而减少相关炎症细胞因子的过度分泌,减轻肺损伤,降低病死率[18]。
本研究观察了清胰汤对SP-ALI大鼠肺组织炎症反应的治疗作用,结果显示,与对照组相比,模型组肺组织有明显肺血肿、肺淤血表现,大部分肺泡间隔明显增宽,肺泡腔部分融合成肺大泡,肺泡中大量PMN、巨噬细胞浸润,而清胰汤组炎症反应明显减轻;与对照组相比,模型组肺组织中可见明显肺泡水肿,大量中性粒细胞浸润,清胰汤组病例表现较模型组明显减轻;模型组肺组织病理损伤评分高于对照组,清胰汤组肺组织病理损伤评分低于模型组。上述结果表明,清胰汤对SP-ALI有明显治疗作用,可减轻肺组织炎症反应。本研究结果还显示,模型组肺组织中FPR1、FPR2 mRNA和蛋白相对表达量高于对照组,清胰汤组肺组织中FPR1、FPR2 mRNA和蛋白相对表达量低于模型组,提示清胰汤的抗炎作用可能与调节FPR1和FPR2表达、干预腺泡细胞线粒体DAMP分子触发的MTD-FPRs炎症反应途径有关,具体机制仍有待于进一步探索。
