X线照射对NSCLC细胞株吉非替尼获得性耐药的体外逆转作用观察
2018-08-03程燕君谢波张为民
程燕君,谢波,张为民
(1广东药科大学,广州510006;2广州军区广州总医院)
以吉非替尼为代表的表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)是EGFR突变型非小细胞肺癌(NSCLC)的一线治疗药物。然而,接受EGFR-TKI治疗的患者不可避免地会产生获得性耐药,中位无进展生存期(PFS)仅为10~12个月[1~3]。目前耐药后的策略主要是换用新一代靶向药物及化疗[4~6],但靶向药物仍面临再次耐药的问题,而化疗药物缺乏靶向性,不良反应明显。因此,寻找克服EGFR-TKI耐药的策略是临床亟待解决的问题。研究[7]表明,EGFR-TKI耐药的患者在放疗后继续行EGFR-TKI治疗有助于提高PFS及OS,提示放疗可能逆转了EGFR-TKI的获得性耐药。既往基础研究[8]也显示,放射线可逆转EGFR基因第21外显子突变细胞对吉非替尼的获得性耐药,且发现伴21外显子突变的获得性耐药细胞在放射线照射后发生了间质-上皮转化(MET)。EGFR基因第19外显子突变亦为常见经典突变。对于放射线可否通过MET逆转EGFR基因第19外显子突变的NSCLC细胞对EGFR-TKI的获得性耐药目前未见报道。本研究选取EGFR基因第19外显子突变的NSCLC细胞株PC-9,用吉非替尼诱导产生获得性耐药细胞株PC-9/AB,观察X线对NSCLC细胞株吉非替尼获得性耐药的体外逆转作用,现在报告如下。
1 材料与方法
1.1 细胞与主要实验材料 PC-9细胞购于中国科学院上海细胞库。吉非替尼获得性耐药细胞株PC-9/AB为日本国立癌症中心小泉史明博士惠赠。经检测,PC-9、PC-9/AB细胞均伴EGFR基因第19外显子缺失突变,PC-9/AB细胞携带T790M突变及EMT。配置RPMI1640完全培养基(包括10%标准胎牛血清、100 U/mL的青霉素和100 U/mL的链霉素)。PC-9、PC-9/AB细胞贴壁生长于含培养基的培养瓶,置于无菌孵箱(5% CO2、37 ℃、饱和湿度)中培养。
1.2 细胞分组与X线照射方法 PC-9细胞为对照组,PC-9/AB细胞分为耐药组和实验组。实验组细胞铺于25 cm2培养瓶里,用医用直线加速器(CLINAC 600C/D,瓦里安公司)照射处于对数生长期的细胞;照射参数设置为6 mV X线、剂量率300 cGy/min、源皮距100 cm、照射角180°、照射野40 cm×40 cm、单次照射剂量6 Gy;细胞恢复稳定生长后再次进行照射,共照射4次(总剂量24 Gy);细胞稳定生长后建成放射线照射细胞株,命名为PC-9/AB IR。
1.3 三组细胞对吉非替尼的敏感性观察 取三组指数生长期细胞,胰酶消化,制成单细胞悬液并计数,将单细胞悬液按2×103/孔接种于96孔板中;细胞分别在含0、0.001、0.01、0.1、1、10 μmol/L吉非替尼的培养基中培养;72 h后在避光条件下按CCK-8细胞计数试剂盒说明书加入预先配置好的CCK-8工作液;继续孵育2 h,在全自动酶标分析仪(Biocell公司)上检测波长为450 nm时的光密度值(OD值)。根据公式计算细胞在各个药物浓度下的抑制率,并通过Graphpad Prime5软件计算吉非替尼对细胞生长的IC50值。细胞生长抑制率=[1-(加药组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.4 细胞放射敏感性观察 取三组对数生长期细胞,0.25%胰酶消化,制成单细胞悬液并计数。将细胞分别接种于60 mm的细胞培养皿中进行X线照射,照射后的细胞继续培养10~14 d。计数细胞数>50个的细胞集落数。按公式计算存活分数:贴壁率=对照组每孔克隆数/每孔细胞种植数×100%,存活分数=实验组每孔克隆数/(每孔细胞种植数×贴壁率)。
1.5 细胞基因突变观察 采用NGS法检测295基因panel,观察各组细胞突变情况。
1.6 细胞中E-cadherin、Vimentin蛋白检测 采用Western blotting法。裂解液裂解每组细胞后离心15 min,根据BCA-200蛋白浓度测定法检测蛋白浓度后加入上样缓冲液,95 ℃变性5 min。SDS-PAGE电泳完成后,按下层厚滤纸、PVDF膜、胶、上层厚滤纸的顺序进行转膜30 min。37 ℃封闭2 h,于抗体孵育盒内孵育一抗(4 ℃过夜)。用5%脱脂奶粉分别将鼠抗人单克隆抗体E-cadherin vimentin β-actin稀释,脱色摇床上孵育二抗1 h。PVDF膜避光条件下曝光后计算灰度值(Quantity One软件),代表目的蛋白表达量。
1.7 细胞凋亡率测算 胰酶消化各组细胞后,调整浓度重新接种恢复对数生长。三组细胞分别在含0、20、40、80 μmol/L吉非替尼的培养基中培养24h。根据细胞凋亡检测试剂盒(碧云天公司)说明先后加入Annexin V-FITC结合液、Annexin V-FITC、碘化丙啶染色液,室温孵育10~20 min,在流式细胞仪上观察凋亡细胞,并计算细胞凋亡率。
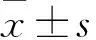
2 结果
2.1 各组细胞对吉非替尼的敏感性 不同浓度吉非替尼作用后各组细胞生长抑制率见表1。吉非替尼抑制对照组、耐药组、实验组细胞生长的IC50值分别为(0.05±0.03)、(16.01±3.42)、(0.28±0.01)μmol/L,其中实验组IC50值低于耐药组(P<0.05)。

表1 不同浓度吉非替尼作用后各组细胞生长抑制率
2.2 细胞放射敏感性 对克隆成型实验结果以2 Gy下存活率比较。2 Gy、4 Gy、6 Gy剂量X线照射后实验组细胞克隆存活率高于对照组(P均<0.05);对照组、耐药组、实验组细胞的存活分数(2 Gy)分别为0.579±0.044、0.688±0.011、0.823±0.009,实验组细胞存活分数高于耐药组(P<0.05),说明实验组细胞较耐药组细胞表现出明显的放射线抵抗。
2.3 各组细胞基因突变情况 NGS测序结果显示实验组、耐药组均为EGFR基因第19外显子缺失突变细胞,且均携带T790M二次突变,均有TP53基因第7外显子的缺失突变。各组细胞的ALK、ROS1等基因未见明确的突变、扩增、融合及拷贝数改变。
2.4 各组细胞中E-cadherin、vimentin蛋白表达比较 实验组、耐药组、对照组细胞中E-cadherin相对表达量分别为1.294±0.021、0.397±0.023、0.871±0.008,耐药组低于对照组,实验组高于耐药组(P均<0.05);实验组、耐药组、对照组细胞中vimentin相对表达量分别为(0、0.249±0.014、0),耐药组高于对照组,实验组低于耐药组(P均<0.05)。
2.5 各组细胞凋亡率比较 经吉非替尼作用,各组细胞均发生凋亡,作用呈浓度依赖性。20、40、80 μmol/L吉非替尼作用后,实验组细胞凋亡率均高于耐药组(P均<0.05)。详见表2。

表2 不同浓度吉非替尼作用后各组细胞凋亡率
3 讨论
本研究结果初步证实了X线照射可逆转伴EGFR基因第19外显子突变的PC-9/AB细胞对一代EGFR-TKI吉非替尼的耐药。EGFR-TKI获得性耐药的机制包括二次突变、下游通路及旁路异常激活、小细胞肺癌转化等[9]。其中T790M是一代EGFR-TKI继发耐药最主要的机制[10],本实验选取T790M突变所致伴EGFR基因第19外显子突变的吉非替尼获得性耐药细胞株PC-9/AB为研究对象。经2Gy 剂量下X线照射后,实验组细胞生长抑制率高于耐药组,对放射线相对抵抗。耐药组细胞T790M耐药突变并未影响细胞的放射敏感性,但吉非替尼对实验组细胞生长的IC50值较耐药组细胞显著降低,接近敏感突变的对照组细胞PC-9,表明放射线逆转了PC-9/AB对吉非替尼的获得性耐药。张星南、李静等[11,12]也发现电离辐射可逆转伴T790M突变NSCLC细胞株PC-9/GR、NCI-H1975/GR对一代EGFR-TKI的获得性耐药。Van等[13]也支持这一结论,他们发现对EGFR-TKI耐药的患者进行放疗后重新给予EGFR-TKI治疗,患者的PFS和OS得到不同程度的延长。
关于放射线逆转肿瘤细胞对EGFR-TKI获得性耐药的机制目前尚不明确。放射线可通过使肿瘤细胞DNA断裂、交联等DNA损伤而致细胞死亡[14]。肿瘤细胞对EGFR-TKI的敏感性与基因状况密切相关,携带EGFR基因第18、19、21外显子突变的细胞对EGFR-TKI敏感,而对一代EGFR-TKI耐药的NSCLC患者常携带有T790M等基因突变。放射线逆转EGFR-TKI获得性耐药是否通过改变基因状况得以实现值得探讨。为明确这一问题,本研究用二代测序法观察了各组细胞中的EGFR、ALK、ROS1等常见驱动基因突变情况,结果未见到明确的基因突变、扩增、融合及拷贝数变化。说明放射线逆转T790M突变所致的继发耐药并非源于对常见驱动基因层面的改变。这与Wang等[8]的研究结果一致,他们通过HRMA法检测亦未发现细胞在放射线照射后产生了新的突变。
研究[9]已证实NSCLC细胞对一代EGFR-TKI获得性耐药产生机制之一是细胞发生了EMT,而逆转EMT可恢复对EGFR-TKI的敏感性。Suda等[15]用厄洛替尼诱导人肺腺癌细胞系HCC4006(携带EGFR基因第19外显子缺失突变)获得性耐药过程中出现了EMT。Lee等[16]通过Snail蛋白、Slug蛋白诱导PC9、HCC827细胞发生EMT后,出现对吉非替尼耐药;而逆转EMT后,细胞对EGFR-TKI的敏感性恢复。在本研究中,耐药组细胞中E-cadherin相对表达量低于对照组,实验组E-cadherin相对表达量高于耐药组;耐药组细胞中vimentin相对表达量高于对照组,实验组vimentin相对表达量低于耐药组。上述结果表明放射线逆转PC-9/AB的耐药过程中出现了EMT的逆转。EMT逆转意味着肿瘤组织恢复了上皮组织特性,重新出现了EGFR-TKI的作用靶点,从而恢复了对吉非替尼的敏感性。这可能是放射线逆转NSCLC细胞获得性耐药的机制之一,与Wang等[8]的研究结果一致。此外,我们还发现20、40、80 μmol/L吉非替尼作用后,实验组细胞凋亡率均高于耐药组,说明细胞凋亡可能参与了放射逆转EGFR-TKI获得性耐药这一过程,具体的调控通路有待进一步的研究。
结合上述研究结果,我们认为,X线照射可以逆转NSCLC细胞株对吉非替尼的获得性耐药,增强细胞对吉非替尼的敏感性,推测其机制可能与逆转EMT及促进细胞凋亡有关。
