TNBS诱导结肠炎小鼠中细菌鞭毛蛋白的表达及其与肥大细胞脱颗粒的关系*
2018-06-30郝卉杰张目涵赵美华冯百岁
路 瑶,郝卉杰,贺 欣,张目涵,赵美华,马 娜,冯百岁
(郑州大学第二附属医院消化内科, 炎症性肠病中心, 吴阶平医学基金会, 炎症性肠病联盟河南省炎症性肠病中心, 河南 郑州 450014)
炎症性肠病(inflammatory bowel disease,IBD)是一组以腹痛、腹泻及黏液脓血便等为主要临床表现的慢性炎性疾病,其病因尚不明确。现有的研究表明IBD与肠黏膜屏障破坏以及异常免疫应答相关[1]。目前研究表明肠道炎症的发生与肠道内菌群的作用密不可分[2]。正常人肠道内即存在大量的抗原物质, 包括正常定植菌群、某些致病菌和细菌毒素等[3],这些抗原物质可诱导肠黏膜产生大量炎症细胞,同时导致免疫功能紊乱,从而在IBD的发生发展过程中发挥作用[4]。 细菌鞭毛蛋白CBir1可与Toll样受体5(Toll-like receptor 5,TLR5)等受体结合,激发相应的信号转导通路,从而参与肠道慢性炎症反应[5]。肥大细胞是黏膜免疫的重要组成部分,目前研究发现在IBD患者的肠黏膜中活化的肥大细胞增多。激活的肥大细胞发生脱颗粒作用,可分泌出肥大细胞类胰蛋白酶(mast cell tryptase,MCT)及组胺等细胞因子进一步促进炎症反应发生[6-7]。细菌脂多糖(lipopolysaccharide,LPS)能够直接损伤细胞,当其与卵清蛋白(ovalbumin,OVA)结合后可促进炎症反应[8]。酮替芬(ketotifen)是一种常见的抗过敏药物,其能够稳定肥大细胞细胞膜,从而减少炎症物质的释放。人类IBD的炎症反应过程尚不明确,通过动物实验可模拟该疾病发病过程。本实验采用2,4,6-三硝基苯磺酸(2,4,6-trinitobenzenesulfonic acid,TNBS)诱导建立小鼠慢性结肠炎模型,并对各组小鼠采取相应的干预措施。实验中采用免疫组织化学以及ELISA方法来检测各组肠黏膜组织及血清中CBir1、TLR5、组胺及MCT的表达,分析疾病进程中上述指标含量的变化,并结合分析CBir1的含量与上述肥大细胞脱颗粒相关指标之间的相关性,分析两者在TNBS诱导小鼠结肠炎中的作用,为临床IBD的研究和疾病的治疗提供新的思路。
材 料 和 方 法
1 材料
健康雄性6~8周龄SPF级BALB/c小鼠72只,体重18~22 g,购自河南省动物实验中心,实验动物质量合格证许可证号为SCXK(豫)2010—0002。LPS、TNBS、OVA、富马酸酮替芬购自Sigma;小鼠类胰蛋白酶、组胺以及抗CBir1抗体ELISA试剂盒购自R&D;过氧化物酶标记的链霉卵白素染色试剂盒及DAB显色试剂盒购自博奥森生物技术有限公司;兔抗小鼠CBir1抗体和TLR5抗体购自UCL;兔抗小鼠类胰蛋白酶β2抗体购自福州迈新生物科技公司。
2 方法
2.1实验分组和处理 实验小鼠共分为6组,每组各12只,随机分为:(1)正常对照(normal control)组:无特殊处理,正常饲养; (2)生理盐水(saline)组:禁食不禁水24 h,实验第1、8和15天给予生理盐水(100 μL)灌肠,实验后正常饮食;(3)50%乙醇(50% alcohol)组:第1、8和15天给予50%乙醇(100 μL)灌肠;(4)50%乙醇+TNBS (50% alcohol+TNBS)组:第1、8和15天分别给予由2.0 mg TNBS、2.5 mg TNBS和3.0 mg TNBS加50%乙醇配置成的100 μL溶液灌肠; (5) 50%乙醇+TNBS+酮替芬(50% alcohol+TNBS+ketotifen)组:用生理盐水加酮替芬0.5 mg配成100 μL溶液,给予该组小鼠腹腔注射,30 min后灌肠,TNBS剂量及灌肠方法同(4)组; (6) 50%乙醇+TNBS+LPS+OVA组:取OVA 20 μg和LPS 10 μg溶于100 μL 生理盐水中,于第7天给予该组小鼠腹腔注射,第9、12及15天重复上述过程,后将OVA 50 μg溶于100 μL生理盐水配成溶液,于第18、19、20和21天按每只100 μL的剂量行腹腔注射,TNBS剂量和灌肠方法同(4)组。实验第22天处死小鼠,收集血液并离心20 min(2 000~3 000 r/min)后取上清储存至-20 ℃;取小鼠结肠组织,4%甲醛固定,石蜡包埋并冻存,待后续实验使用。
2.2病理评分 根据Irving等[9]提出的疾病活动指数评分(disease activity index,DAI)标准对各组小鼠一般情况进行评估并取各组平均值为DAI分值。组织学损伤评分(histological index,HI):取小鼠结肠组织的石蜡切片,根据Ewaschuk等[10]的标准对小鼠结肠进行HI评估,读片及评分采用双盲法,结果取均值。
2.3免疫组化法检测结肠组织内CBir1、TLR5和MCT的表达 取小鼠结肠组织石蜡切片,并通过免疫组化的方法检测各组组织内TLR5、 CBir1及MCT含量,并采用定性标准进行判定。具体实验方法为:石蜡切片水化→抗原修复→3% H2O2孵育→血清封闭→加I抗过夜→复温→加II抗→加辣根酶标记链霉卵白素→避光滴加DAB显色剂→自来水冲洗终止显色→苏木素复染→70%盐酸乙醇分化→脱水→树胶封片。具体判定标准为:(1)阳性细胞≤5%计为0分,6%~25%计为l分,26%~50%计为2分,51%~75%计为3分,>75%计为4分;(2)阳性强度:无色计为0分,淡黄色计为1分,黄色计为2分,棕黄色计为3分;将(1)和(2)两者积分相乘,0分视为阴性(-),1~4分视为弱阳性(+),5~8分视为阳性(++),9~12分视为强阳性(+++)。上述结果均为在高倍镜(×400)下观察得出,每个标本观察5个不重复视野,结果取平均值。
2.4血清抗-CBir1抗体、MCT和组胺的ELISA检测 采用ELISA检测各组小鼠血清中MCT、抗-CBir1抗体及组胺的含量。根据标准物吸光度(A)值及对应的浓度,得出标准曲线回归方程式。将测得的各组的A值,代入方程式中,得各组样品的实际浓度。
3 统计学处理
数据经SPSS 21.0 统计软件处理。对称分布计量数据采用均数±标准差(mean±SD)进行描述。正态分布计量数据采用Levene检验法检验方差齐性,并采用单因素方差分析(one-way ANOVA),方差分析有意义者采用SNK-q法进行两两比较。非正态分布计量数据采用Bonferroni法进行两两比较。定性资料的两两比较采用秩和检验。变量间相关性描述采用Pearson积矩相关系数。以P<0.05为差异有统计学意义。
结 果
1 各组小鼠一般状况及DAI评分比较
分别记录各组小鼠实验开始后一般情况变化,正常对照组小鼠的饮食及饮水均正常,精神状态未见明显异常,体重增加,无死亡;生理盐水组10%~15%小鼠稀便,其余同正常对照组;50%乙醇组实验开始后约20%的小鼠饮食量减少、排稀便,约10%的小鼠出现潜血+~++,体重减轻,1周后逐渐恢复体重,死亡率为0;50%乙醇+TNBS组实验开始后出现食量减少、排软便或稀便,大便潜血+~+++,精神萎靡、体重下降,且第3周达症状高峰,灌肠开始后第1、2周出现动物死亡现象,死亡率16.67%;50%乙醇+TNBS+酮替芬组小鼠实验开始后症状较50%乙醇+TNBS组轻,第8天体重恢复90%左右,小鼠死亡率8.33%;50%乙醇+TNBS+LPS+OVA组动物上述症状严重,体重下降较为明显,死亡率25%。小鼠体重下降情况及DAI评分比较见图1。

Figure 1. The results of body weight loss and DAI score in each group of mice. Mean±SD.n=12.*P<0.05vsnormal control group;#P<0.05vs50% alcohol+TNBS group.
图1各组小鼠体重下降情况及DAI评分结果的比较
2 各组小鼠结肠黏膜组织学改变及HI评分比较
用放大镜对各组小鼠的肠道组织进行初步观察,正常对照组、生理盐水组及50%乙醇组肠黏膜较平滑、未见明显充血肿胀及明显淋巴滤泡增生;各模型组肠黏膜见颗粒状突起,部分结肠见扭曲变形、充血及少量黏膜糜烂。
光镜下组织切片可见:正常对照组和生理盐水组小鼠肠黏膜上皮细胞连续,腺体结构清晰,排列规则,未见炎症细胞浸润;50%乙醇组肠黏膜上皮细胞连续, 黏膜层见少量淋巴细胞浸润,腺体结构无明显破坏;50%乙醇+TNBS组肠黏膜欠完整,肠上皮细胞破碎,杯状细胞数量减少,淋巴滤泡数量增多,固有层炎症细胞浸润,病变较严重区域,可见肠上皮小片状坏死,黏膜下层及固有肌层均见小血管增生;50%乙醇+TNBS+酮替芬组肠黏膜缺乏完整性,肠上皮细胞破裂,杯状细胞减少,黏膜层存在淋巴细胞浸润,肌层亦可见少量炎症细胞;50%乙醇+TNBS+LPS+OVA组小鼠组织损伤程度较50%乙醇+TNBS组严重,炎症侵犯全层,大量腺体结构消失,部分见固有层增厚。各组小鼠结肠黏膜进行HI评分并比较见图2。
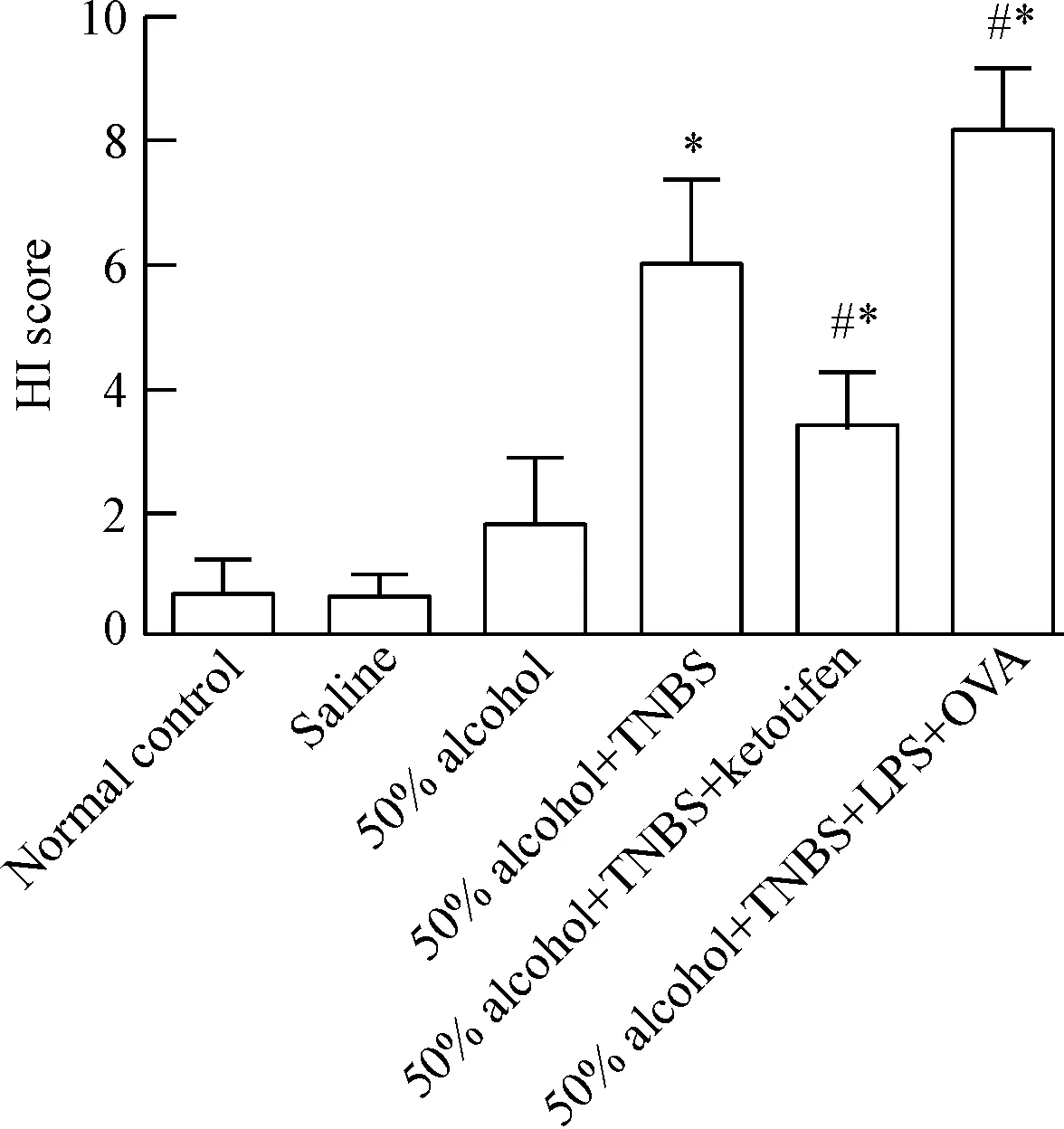
Figure 2. The results of HI soore in each group of mice. Mean±SD.n=12.*P<0.05vsnormal control group;#P<0.05vs50% alcohol+TNBS group.
图2小鼠肠黏膜组织HI评分比较
3 各组小鼠结肠黏膜CBir1、TLR5和MCT的表达
免疫组化结果显示CBir1在结肠组织分布于肠上皮细胞膜,而MCT及TLR5分布于结肠组织肠上皮细胞质中。根据阳性细胞百分比及染色程度判定结果,可见各组结肠组织的染色程度明显不同,其中,50%乙醇+TNBS组中CBir1、MCT和TLR5较正常对照组阳性数增多(P<0.05),加入酮替芬后CBir1和TLR5阳性数较50%乙醇+TNBS组减少,加入LPS和OVA后,CBir1和MCT阳性数较50%乙醇+TNBS组增多(P<0.05),见图3、表1~3。
4 各组小鼠血清抗-CBir1、MCT和组胺浓度的变化
采用Bonferroni法进行两两比较,ELISA结果提示50%乙醇+TNBS模型组中血清MCT、抗-CBir1及组胺的水平明显高于正常对照组(P<0.05);将正常对照组与生理盐水组和50%乙醇组比较,差异无统计学显著性,因而排除了机械损伤及单独乙醇的作用对本实验影响,说明50%乙醇导致的慢性炎症与灌肠所致肠黏膜机械损伤无关。与50% alcohol+TNBS组相比,50% alcohol+TNBS+ketotifen组血清抗-CBir1、MCT和组胺水平明显降低,差异有统计学意义,提示酮替芬对TNBS诱导的小鼠结肠炎具有治疗作用;50% alcohol+TNBS+LPS+OVA组与50% alcohol+TNBS组相比,上述指标浓度增高,差异有统计学意义,说明LPS和OVA可加重结肠炎的程度,见图4。
5 血清抗-CBir1浓度与MCT和组胺浓度的相关性分析
根据实验数据分别绘制血清中上述3个指标的散点图,结果呈线性趋势,表明血清中抗-CBir1的浓度与MCT及组胺的浓度相关联;观察各组资料均服从正态分布,且各观察值间相互独立,可采用Pearson积矩相关系数来描述血清抗-CBir1浓度与上述两指标之间的关系。结果分别得出血清抗-CBir1与组胺浓度相关系数r=0.751(P<0.01);血清抗-CBir1与MCT浓度相关系数r=0.648 (P<0.01)。根据统计结果可得出血清中抗-CBir1与MCT的浓度呈正相关关系,小鼠血清中抗-CBir1与组胺的浓度亦呈正相关,见图5。
讨 论
IBD是一种以腹痛、腹泻及黏液脓血便等为主要临床表现的慢性非特异性肠道炎症性疾病,其目前的发病机制尚不明确[11]。50%乙醇+TNBS诱导的鼠结肠炎模型是目前广泛应用于IBD研究的动物模型[12]。乙醇对肠道黏膜屏障有破坏作用,破坏后的肠黏膜暴露出角蛋白可与TNBS结合形成完全抗原,并通过核转录因子κB(nuclear factor-κB,NF-κB)等途径激发免疫反应[13]。
细菌的鞭毛是细菌主要的运动器官,主要作用包括侵袭、黏附及分泌毒力因子等。细菌鞭毛蛋白对细菌鞭毛的黏附能力、定植以及破坏肠黏膜屏障有重要作用[14]。CBir1是细菌鞭毛蛋白中的一种,具有许多鞭毛蛋白的共性。本实验结果发现,非模型组小鼠的肠黏膜组织及血清中可检测到少量的CBir1和抗-CBir1,明显低于TNBS诱导模型组,表明CBir1参与了小鼠TNBS诱导结肠炎的发病过程。
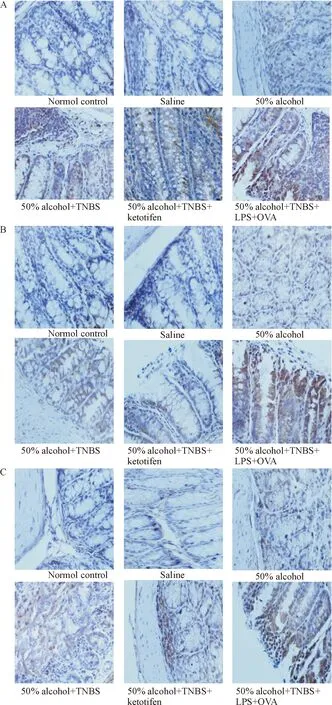
Figure 3. The expression of CBir1 (A), TLR5 (B) and MCT (C) in mouse colonic epithelial tissue (×400).
图3小鼠结肠组织中CBir1、TLR5和MCT的表达
TLRs是一类信号转导通路受体,主要在先天性免疫应答中发挥作用[15]。目前研究表明细菌鞭毛蛋白可以识别TLR5,触发机体免疫系统[16],两者结合后,可激活骨髓样分化因子88(myeloid differentiation factor 88,MyD88)转导途径,从而促进NF-κB的激活及释放[17]。激活的NF-κB促进细胞因子的转录基因上调,使肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukine,IL)-1β和IL-8等前炎症细胞因子产生增加,从而参与机体的先天性免疫应答及炎症反应[18]。上述两者结合后,亦可促使细胞的caspase-8及Fas相关死亡域蛋白表达上调,促进细胞凋亡的发生[19]。本实验表明,TNBS诱导模型组小鼠的肠黏膜组织中TLR5的表达量,明显高于非模型组。表明TLR5参与了小鼠TNBS诱导结肠炎的发病过程。
表1CBir1免疫组化结果
Table 1. Immunohistochemical expression of CBir1 in colonic epithelial tissue of mice in each group (n=12)

Group-++++++Normol control11100Saline1002050% alcohol912050% alcohol+TNBS320750% alcohol+TNBS+ketotifen632150% alcohol+TNBS+LPS+OVA00111
表2TLR5免疫组化结果
Table 2. Immunohistochemical expression of TLR5 in colonic epithelial tissue of mice in each group (n=12)

Group-++++++Normol control10200Saline1021050% alcohol921050% alcohol+TNBS311750% alcohol+TNBS+ketotifen614150% alcohol+TNBS+LPS+OVA00012
表3MCT免疫组化结果
Table 3. Immunohistochemical expression of MCT in colonic epithelial tissue of mice in each group (n=12)

Group-++++++Normol control10200Saline1011050% alcohol930050% alcohol+TNBS401750% alcohol+TNBS+ketotifen523250% alcohol+TNBS+LPS+OVA00111
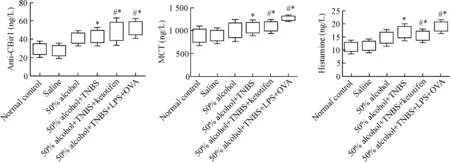
Figure 4. Comparison of serum MCT, histamine and anti-CBir1 concentrations in each group. Mean±SD.n=6.*P<0.05vsnormal control group;#P<0.05vs50% alcohol+TNBS group.
图4各组实验小鼠血清中的MCT、组胺及抗-CBir1浓度比较
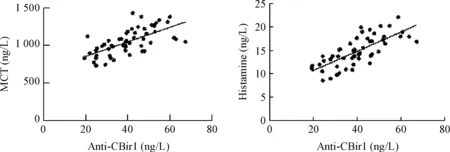
Figure 5. The scatter diagram showed the relationship between anti-CBir1 and MCT or histamine levels in each group.
图5血清抗-CBir1与MCT和组胺浓度关系的散点图
肠道免疫相关疾病发生时,肥大细胞的数量增加,同时肥大细胞脱颗粒释放的介质,如组胺、MCT、IL-5和TNF增加[20]。肥大细胞中含有大量的组胺,当肥大细胞被激活时,可释放组胺促进炎症反应发生。组胺受体HR1和HR2激活后,可通过影响血管、平滑肌及上皮细胞的功能,参与炎症反应;同时,组胺是一种高效的促类胰蛋白酶释放刺激剂。MCT能够促进炎症反应发生,其释放及储存均有高度的选择性。因此,MCT是评估肥大细胞激活以及脱颗粒的标志之一。MCT具有刺激外周血T细胞、单核细胞活化,并诱导其释放IL-6及TNF-α等众多细胞因子的作用,从而加重炎症反应。同时肥大细胞释放的MCT可反作用于肥大细胞,促使更多肥大细胞的激活,形成 “瀑布”效应[21]。本实验表明,TNBS诱导模型组小鼠的肠黏膜组织中MCT及血清中组胺的表达量,明显高于非模型组。表明TNBS诱导结肠炎小鼠的发病过程中存在肥大细胞激活。已有研究表明肥大细胞表达TLR5,而TLR5可识别CBir1并启动炎症反应[22]。因此我们推测CBir1可通过与TLR5结合而激活肥大细胞。
LPS是构成G-厌氧菌细胞壁的主要成分。研究表明其可与LPS结合蛋白结合形成复合体,并作用于细胞膜上相应的受体,例如Toll样受体。通过上述途径将信号转导至胞内,诱导巨噬细胞及肥大细胞内各种细胞因子的合成及释放,如IL-10和IL-15等。LPS通过上述途径可参与肠道的炎症反应[23-24]。OVA常与LPS使用于诱导肠黏膜的免疫反应,主要通过Toll样受体等信号转导过程来促进炎症反应的发生[25-26]。本实验中50%乙醇+TNBS+LPS+OVA组小鼠的DAI评分、HI评分均较50%乙醇+TNBS组明显升高,因此可见炎症反应加重。
酮替芬能促进肥大细胞细胞膜稳定的维持,因而减少过敏活性介质的释放。同时对H1受体具有较强的拮抗作用,因此具有抗组胺作用[27]。从本实验数据分析显示50%乙醇+TNBS+酮替芬组小鼠的各项评估指标均较50%乙醇+TNBS组明显降低,充分表明了酮替芬具有抑制小鼠TNBS结肠炎的作用。
本实验结果示50%乙醇+TNBS组、50%乙醇+TNBS+酮替芬组和50%乙醇+TNBS+LPS+OVA组疾病严重程度的差异存在统计学意义,且加入LPS+OVA组炎症最重,而TNBS模型组结肠组织中CBir1、TLR5及MCT的表达均与疾病的严重程度趋势一致,严重程度越深,表达越高。同时TNBS模型组血清中抗-CBir1、组胺及MCT的表达,亦与疾病的严重程度趋势一致。
采用Pearson积矩相关系数分析得,血清抗-CBir1与MCT浓度呈正相关,血清中组胺的浓度与抗-CBir1的浓度亦呈正相关,说明CBir1的表达量可能与肥大细胞脱颗粒作用相关。结合相关研究报道与本实验结果,推测CBir1参与肥大细胞的激活过程可能也和TLR5相关。
综上所述,通过TNBS诱导小鼠结肠炎,可以模拟动物IBD模型。本实验通过不同的干预措施,模拟不同程度的炎症反应,即LPS+OVA可加重炎症过程,酮替芬作为肥大细胞稳定剂,可一定程度减轻炎症的发生。随着干预的措施变化,各组小鼠的DAI、HI评分、MCT、CBirl、TLR5及组胺亦呈现出不同程度的表达。CBir1的表达量与肥大细胞脱颗粒作用呈正相关。
[参 考 文 献]
[1] Biasi F, Leonarduzzi G, Oteiza PI, et al. Inflammatory bowel disease: mechanisms, redox considerations, and therapeutic targets[J]. Antioxid Redox Signal, 2013, 19(14):1711-1741.
[2] 李旺林, 曹 杰, 肖焕擎, 等. 大肠埃希氏菌在葡聚糖硫酸钠诱导的结肠炎恢复中的作用[J]. 中国病理生理杂志, 2012, 28(1):163-167.
[3] Berthold-Pluta A, Pluta A, Garbowska M. The effect of selected factors on the survival of Bacillus cereus in the human gastrointestinal tract[J]. Microb Pathog, 2015, 82:7-14.
[4] Maukonen J, Kolho KL, Paasela M, et al. Altered fecal microbiota in paediatric inflammatory bowel disease[J]. J Crohns Colitis, 2015, 9(12):1088-1095.
[5] Peloquin JM, Nguyen DD. The microbiota and inflammatory bowel disease: insights from animal models[J]. Anaerobe, 2013, 24(12):102-106.
[6] Afrin LB, Khoruts A. Mast cell activation disease and microbiotic interactions[J]. Clinl Ther, 2015, 37(5):941-953.
[7] Rychter J, Ortega O, Berdun S, et al. Mast cell degranulation inhibits motor patterns of human ileum and sigmoid coloninvitro: relevance for postoperative ileus[J]. Neurogastroenterol Motil, 2015, 27(8):1098-1109.
[8] Schülke S, Flaczyk A, Vogel L, et al. MPLA shows attenuated pro-inflammatory properties and diminished capacity to activate mast cells in comparison with LPS[J]. Allergy, 2015, 70(10):1259-1268.
[9] Irving PM, Gibson PR. Infections and IBD[J]. Nat Clin Pract Gastroenterol Hepatol, 2008, 5(1):18-27.
[10] Ewaschuk JB, Tejpar QZ, Soo I, et al. The role of antibiotic and probiotic therapies in current and future management of inflammatory bowel disease[J]. Curr Gastroenterol Rep, 2006, 8(6):486-498.
[11] Siegmund B, Atreya R, Bokemeyer B, et al. Biosimilars in inflammatory bowel disease[J]. Clin Gastroenterol Hepatol, 2016, 14(12):1685-1696.
[12] Bramhall M, Flórezvargas O, Stevens R, et al. Quality of methods reporting in animal models of colitis[J]. Inflamm Bowel Dis, 2015, 21(6):1248-1259.
[13] Soubh AA, Abdallah DM, El-Abhar HS. Geraniol ameliorates TNBS-induced colitis: Involvement of Wnt/β-catenin, p38MAPK, NFκB, and PPARγ signaling pathways[J]. Life Sci, 2015, 136:142-150.
[14] Alexander KL, Targan SR, Elson CO 3rd. Microbiota activation and regulation of innate and adaptive immunity[J]. Immunol Rev, 2014, 260(1):206-220.
[15] Yu S, Gao N. Compartmentalizing intestinal epithelial cell Toll-like receptors for immune surveillance[J]. Cell Mol Life Sci, 2015, 72(17):3343-3353.
[16] Leifer CA, Mcconkey C, Li S, et al. Linking genetic variation in human Toll-like receptor 5 genes to the gut microbiome's potential to cause inflammation[J]. Immunol Lett, 2014, 162(2):3-9.
[17] Brandão I, Hörmann N, Jäckel S, et al. TLR5 expression in the small intestine depends on the adaptors MyD88 and TRIF, but is independent of the enteric microbiota[J]. Gut Microbes, 2015, 6(3):202-206.
[18] Campanholo VM, Silva RM, Silva TD, et al. Oral concentrated grape juice suppresses expression of NF-κB, TNF-α and iNOS in experimentally induced colorectal carcinogenesis in Wistar rats[J]. Asian Pac J Cancer Prev, 2015, 16(3):947-952.
[19] Murdoch TB, Xu W, Stempak JM, et al. Pattern recognition receptor and autophagy gene variants are associated with development of antimicrobial antibodies in Crohn's disease[J]. Inflamm Bowel Dis, 2012, 18(9):1743-1748.
[20] Maciorkowska E, DziecioJ, Kemona A. Evaluation of selected cytokines and mononuclear cell infiltration in gastric mucosa of children with food allergy[J]. Med Sci Monit, 2000, 6(3):567-572.
[21] Nakano S, Mishiro T, Takahara S, et al. Distinct expression of mast cell tryptase and protease activated receptor-2 in synovia of rheumatoid arthritis and osteoarthritis[J]. Clin Rheumatol, 2007, 26(8):1284-1292.
[22] Demaude J, Salvadorcartier C, Fioramonti J. Phenotypic changes in colonocytes following acute stress or activation of mast cells in mice: implications for delayed epithelial barrier dysfunction[J]. Gut, 2006, 55(5):655-661.
[23] Wyns H, Plessers E, De BP, et al.Invivoporcine lipopolysaccharide inflammation models to study immunomodulation of drugs[J]. Vet Immunol Immunopathol, 2015, 166(3-4):58-69.
[24] Jiang J, Shi D, Zhou XQ, et al. Vitamin D inhibits lipopolysaccharide-induced inflammatory response potentially through the Toll-like receptor 4 signalling pathway in the intestine and enterocytes of juvenile Jian carp (Cyprinus carpio var. Jian)[J]. Br J Nutr, 2015, 114(10):1560-1568.
[25] Zhang S, Liu Y. Therapeutic effects of mucosal tolerance on experimental colitis in rats[J]. Eur J Gastroenterol Hepatol, 2009, 21(10):1145-1152.
[26] Im JP, Ye BD, Kim JM, et al. Rectal administration of lipopolysaccharide and ovalbumin ameliorates acute murine colitis[J]. Dig Dis Sci, 2011, 56(8):2292-2298.
[27] Anoush M, Mohammad Khani MR. Evaluating the anti-nociceptive and anti-inflammatory effects of ketotifen and fexofenadine in rats[J]. Adv Pharm Bull, 2015, 5(2):217-222.
