miR-130a对大鼠脑基底动脉平滑肌细胞活力和凋亡的影响*
2018-06-30任应国张保朝贾东佩
任应国,张保朝,贾东佩, 胡 科
(南阳市中心医院神经内科, 河南 南阳 473000)
近年来,许多心血管系统疾病如高血压、中风和动脉粥样硬化等发病率呈现上升趋势,严重威胁了人类的健康[1]。这些疾病的发生发展过程中均会涉及到血管重构,而血管平滑肌细胞的增生和肥大则被认为是引起血管重构的重要因素之一[2-4],故研究血管平滑肌细胞的生物学行为可为深入认识及防治血管重构提供新的方向。
微小RNA(microRNA,miRNA,miR)是一类内源性非编码的小RNA分子,可通过转录及翻译水平调控一个或多个靶基因的表达,进而影响细胞的各种生物学功能[5]。大量研究显示,miRNA可参与调控包括细胞分化、血管发生和肿瘤形成等在内的几乎所有病理生理过程[5-6]。研究证实许多可调节血管平滑肌细胞功能,并参与血管重构的miRNA,如miR-221/222可促进血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖及迁移,而miR-145/143可抑制VSMCs的增殖[7-8]。miR-130a是近年来新发现的一个miRNA,且研究多集中在其抑癌活性上。 miR-130a也可表达于心血管系统,研究显示其可靶向第10号染色体缺失的磷酸酶-张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome 10,PTEN),抑制心功能不全及心肌梗死[9],但是关于miR-130a在脑血管平滑肌上的作用目前尚未有确切的研究。
基于以上研究背景,本研究通过miR-130a抑制物(miR-130a inhibitor, 130a-i)下调miR-130a在大鼠脑基底动脉平滑肌细胞(basilar arterial smooth muscle cells,BASMCs)上的表达,探讨miR-130a对BASMCs增殖、细胞周期及凋亡等生物学行为的影响,并进一步分析其相关作用机制。
材 料 和 方 法
1 材料与试剂
胎牛血清(fetal bovine serum,FBS)、DMEM/F12常规细胞培养基和Opti-MEM优化培养基购于Gibco;Lipofectamine 2000和相关转染试剂购于Invitrogen;血管紧张素Ⅱ(angiotension Ⅱ,AngⅡ)购自Sigma;抗细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)、p21、Bcl-2、cleaved caspase-3/caspase-3、p-Rb/Rb、生长阻滞特异性同源盒蛋白(growth arrest-specific homeobox protein,Gax)及GAPDH抗体购于CST;CCK-8细胞活力检测试剂盒购于广州奕源生物科技有限公司;细胞周期检测试剂盒及Annexin-FITC/PI细胞凋亡双染试剂盒购于南京凯基公司; 130a-i及其阴性对照miRNA(negtive control miRNA, Neg)和SYBR Green I real-time PCR kit由上海吉玛制药技术有限公司提供。
2 实验方法
2.1细胞的原代分离及培养 原代分离培养大鼠脑基底动脉平滑肌细胞,方法如下:SPF级SD大鼠[体重(100±20) g]断头处死,开颅冰上取脑基底动脉,放入预制的冰Krebs液中,去除血管周围的结缔组织后转移至DMEM/F12完全培养基(含1%青、链霉素及20% FBS)中,用眼科剪将血管反复剪碎后转入培养瓶中,使其均匀分布于培养瓶底,置于37 ℃、含5% CO2的细胞培养箱中培养2~5 d。显微镜下观察到组织块周围有细胞爬出后换液 1 次,继续培养 1 周,原瓶消化传代。抗α-平滑肌肌动蛋白免疫荧光法进行平滑肌细胞鉴定,鉴定结果如图1所示,95%以上的细胞染色呈阳性,证明所培养的细胞为大鼠脑基底动脉平滑肌细胞。第4代~第8代细胞用于实验研究。

Figure 1. Images of primarily cultured rat BASMCs. A: morphologic image of cultured rat BASMCs at primary passage under light microscope (×200); B: immunofluorescence staining for α-smooth muscle actin in the third-passage primarily cultured rat BASMCs under confocal microscope (×200).
图1原代培养的大鼠BASMCs
2.2细胞转染及分组 取对数生长期细胞常规消化后接种至6孔板,待细胞生长融合至60%~80%,更换为不含血清的培养基同步化处理12 h,而后将miRNA转染至细胞中。组别设置为空白对照(control)组、Neg组和130a-i组。转染方法如下:将miR-130a inhibitor或negtive control miRNA溶解于Opti-MEM培养基中常温孵育15 min;同时另取Lipofectamine 2000加入Opti-MEM培养基常温孵育15 min;将两者混合10 min后,分别移至于相应细胞中,37 ℃继续孵育6 h,更换10% FBS的DMEM/F12培养基继续培养48 h。Western blot检测转染效率后进行后续实验分析。
2.3CCK-8法测定细胞活力 将各组细胞以每孔2×103个的密度接种于96孔板中培养48 h,加入CCK-8试剂37 ℃孵育30 min后,酶标仪测定其450 nm波长处的吸光度(A)值。
2.4流式细胞术检测细胞周期 消化离心收集各组细胞,加PBS漂洗细胞3次后重悬,同时调整细胞浓度至1×109/L;加70%无水乙醇于4 ℃避光固定过夜。次日,离心洗去乙醇;加碘化丙啶(propidium iodide,PI)染液于37 ℃避光反应30 min,用流式细胞仪检测激发波长488 nm处的荧光强度。
2.5Annexin V/PI 双染色法检测细胞凋亡 消化并离心收集各组细胞,加PBS漂洗细胞3次后,加Binding Buffer重悬细胞,同时调整细胞密度至1×109/L;加Annexin V-FITC室温下避光孵育10 min;而后加入PI继续避光孵育5 min。流式细胞仪检测激发波长488 nm、发射波长530 nm处的荧光强度。
2.6Western blot测定蛋白水平 提取各组细胞的蛋白,经BCA蛋白定量后,每孔上样量为80 μg,加入Loading Buffer(1∶4)进行SDS-PAGE。蛋白电转至PVDF膜,加5%脱脂奶粉室温封闭45 min,然后加抗cyclin D1、CDK2、p21、Bcl-2、cleaved caspase-3、caspase-3、p-Rb、Rb、Gax及GAPDH抗体(稀释1∶2 000)室温孵育2 h;TBST漂洗3次,每次5 min,加入相应 II 抗室温孵育1 h;TBST漂洗3次,每次10 min,于暗室中显影。条带经ImageJ软件行灰度半定量分析。
2.7Real-time PCR实验 细胞中总RNA的提取依据Trizol一步法的说明书进行,纯化并定量后,取2 μg总RNA逆转录合成cDNA,而后采用SYBR Green I Real-time PCR的方法检测目的基因的相对表达量。miR-130a的上游引物为5’-GGCAGTGCAATGTTAAAAG-3’, 下游引物为5’-CAGTGCGTGTCGTGGAGT-3’;Gax的上游引物为5’-GATATGATATAGCGGTGAA-3’,下游引物为5’-CTCTGATGGAAGAAGTGTT-3’;U6的上游引物为5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’;β-actin的上游引物为5’-CACCTTCTACAATGAGCTGCGTGTG-3’,下游引物为5’-ATAGCACAGCCTGGATAGCAACGTAC-3’。PCR循环条件为:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 32 s,共40个循环。记录Ct值并采用2-ΔΔCt法分析目的基因的相对表达量。
3 统计学处理
用SPSS 17.0统计学软件进行数据处理和统计分析。实验所得结果以均数±标准差(mean±SD)表示,多组数据间的比较采用单因素方差分析,各组均数的两两比较采用Bonferroni校正的t检验进行,以P<0.05为差异有统计学意义。
结 果
1 miR-130a在大鼠脑基底动脉平滑肌细胞中的表达
众所周知,AngⅡ在高血压脑血管重构中发挥着至关重要的作用,本实验先用不同浓度的AngⅡ刺激BASMCs生长24 h,并检测此过程中miR-130a的表达。Real-time PCR的结果显示,AngⅡ可促进BASMCs中miR-130a的表达(P<0.05),提示miR-130a可能参与调控高血压脑血管重构中BASMCs的生物学行为,见图2。
2 下调miR-130a抑制AngⅡ所致的BASMCs活力增加
为进一步确定miR-130a对高血压脑血管重构中BASMCs生物学功能的影响,本实验通过转染miR-130a inhibitor下调miR-130a的表达。转染效率检测显示, 130a-i组miR-130a的表达较对照组显著降低(P<0.05),见图3A。同时CCK-8检测结果显示,下调miR-130a可显著抑制AngⅡ所致的细胞活力增加(P<0.05),见图3B。流式细胞术细胞周期检测结果显示,AngⅡ处理后G0/G1期细胞比例下降,与之对应S期细胞比例上升;下调miR-130a后G0/G1期细胞比例上升,S期细胞比例下降(P<0.05),结果表明下调miR-130a可显著抑制AngⅡ所致的细胞活力,阻滞细胞周期转换,见图3C。
3 下调miR-130a促进BASMCs凋亡
此外,本实验还进一步检测了下调miR-130a对BASMCs细胞凋亡的影响,结果显示,下调miR-130a后细胞的早期凋亡率较对照组上升(P<0.05),表明下调miR-130a可促进BASMCs的凋亡,见图4。
4 下调miR-130a对细胞周期及凋亡相关因子的影响
Western blot检测细胞中几种细胞周期及凋亡相关因子的表达情况,结果显示,相对于control组细胞,下调miR-130a后cyclin D1、CDK2、Bcl-2及p-Rb的蛋白水平均显著降低,p21及cleaved-caspase3的蛋白水平则显著升高(P<0.05),见图5。这一结果表明,下调miR-130a可通过影响细胞周期及凋亡相关因子的表达抑制BASMCs生长并促进其凋亡。
此外,实验中还发现,AngⅡ除了可以促进BASMCs中miR-130a的表达之外,还可抑制Gax的表达(图2);而下调miR-130a可促进Gax的表达(图3A)。这说明下调miR-130a影响BASMCs生物学功能可能与促进Gax的表达有关。
Figure 2. The effect of AngⅡ on the cell viability and the expression of miR-130a in the rat BASMCs. A: Ang Ⅱ (24 h) increased the cell viability in a dose-dependent manner; B: Ang Ⅱ(1 μmol/L) increased the cell viability in a time-dependent manner; C: AngⅡ (24 h) up-regulated miR-130a expression, while down-regulated Gax mRNA expression in a dose-dependent manner; D: AngⅡ(1 μmol/L) up-regulated miR-130a expression, while down-regulated Gax mRNA expression in a time-dependent manner. E: AngⅡ (24 h) down-regulated Gax protein expression in a dose-dependent manner; F: AngⅡ (1 μmol/L) down-regulated Gax protein expression in a time-dependent manner. Mean±SD.n=6.*P<0.05vscontrol group (0 μmol/L or 0 h).
图2AngⅡ对大鼠BASMCs活力和miR-130a表达的影响
讨 论
血管平滑肌细胞过度增殖在血管重构的发生发展过程中起着至关重要的作用,为系统分析miR-130a对大鼠BASMCs生物学行为的影响,本实验首先通过AngⅡ刺激大鼠BASMCs的活力,并检测该过程中miR-130a的表达情况,结果显示AngⅡ可促进BASMCs中miR-130a的表达。众所周知,AngⅡ可通过多条复杂交错的通路诱导血管平滑肌细胞增殖,并最终导致高血压和卒中等临床事件的发生[10]。本实验的检测结果表明miR-130a可能参与调控AngⅡ所致的大鼠BASMCs活力增加的过程。
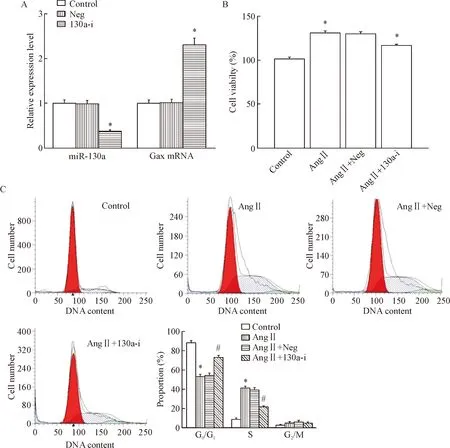
Figure 3. Down-regulation of miR-130a inhibited AngⅡ-induced increase in the viability of BASMCs. A: detection of the transfection efficacy and the Gax mRNA expression; B: down-regulation of miR-130a expression inhibited AngⅡ-induced increase in viability of BASMCs; C: down-regulation of miR-130a inhibited G1/S phase transition in AngⅡ-induced BASMCs. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAngⅡ group.
图3下调miR-130a抑制AngⅡ所致的BASMCs细胞活力增加
随后本实验室采用miR-130a inhibitor下调BASMCs中miR-130a的表达,以进一步分析miR-130a在AngⅡ所致大鼠BASMCs活力增加的影响,结果显示下调miR-130a可显著抑制AngⅡ所致的细胞活力增加,并阻滞细胞周期G1/S转换。此外,我们还通过流式细胞术分析了下调miR-130a对BASMCs凋亡的影响,结果显示,下调miR-130a可促进BASMCs的凋亡。以上结果提示miR-130a参与调控大鼠脑基底动脉平滑肌细胞活力及凋亡过程。细胞的增殖及凋亡往往是受到细胞内一系列相关信号通路及信号分子的调控。细胞周期的G1/S转换通常是调控细胞周期及细胞增殖的重要节点[11-13],该过程可由不同的细胞周期相关调节因子进行调控,包括cyclins、CDKs和CDK抑制蛋白(比如p21CIP和p27KIP)。本研究进一步分析了下调miR-130a对这些周期相关调控因子的影响,结果显示相对于对照组细胞,下调miR-130a后cyclin D1、CDK2及p-Rb的蛋白水平均显著降低,p21的蛋白表达水平则显著升高,说明下调miR-130a可通过作用于细胞周期相关调节因子,造成BASMCs的G1/S期转换受阻,进而抑制细胞生长。Bcl-2则是细胞中重要的抗凋亡因子[14-15],下调miR-130a可抑制BASMCs中Bcl-2的表达,并促进凋亡效应蛋白cleaved caspase-3的表达,这可能是其促凋亡作用的机制之一。
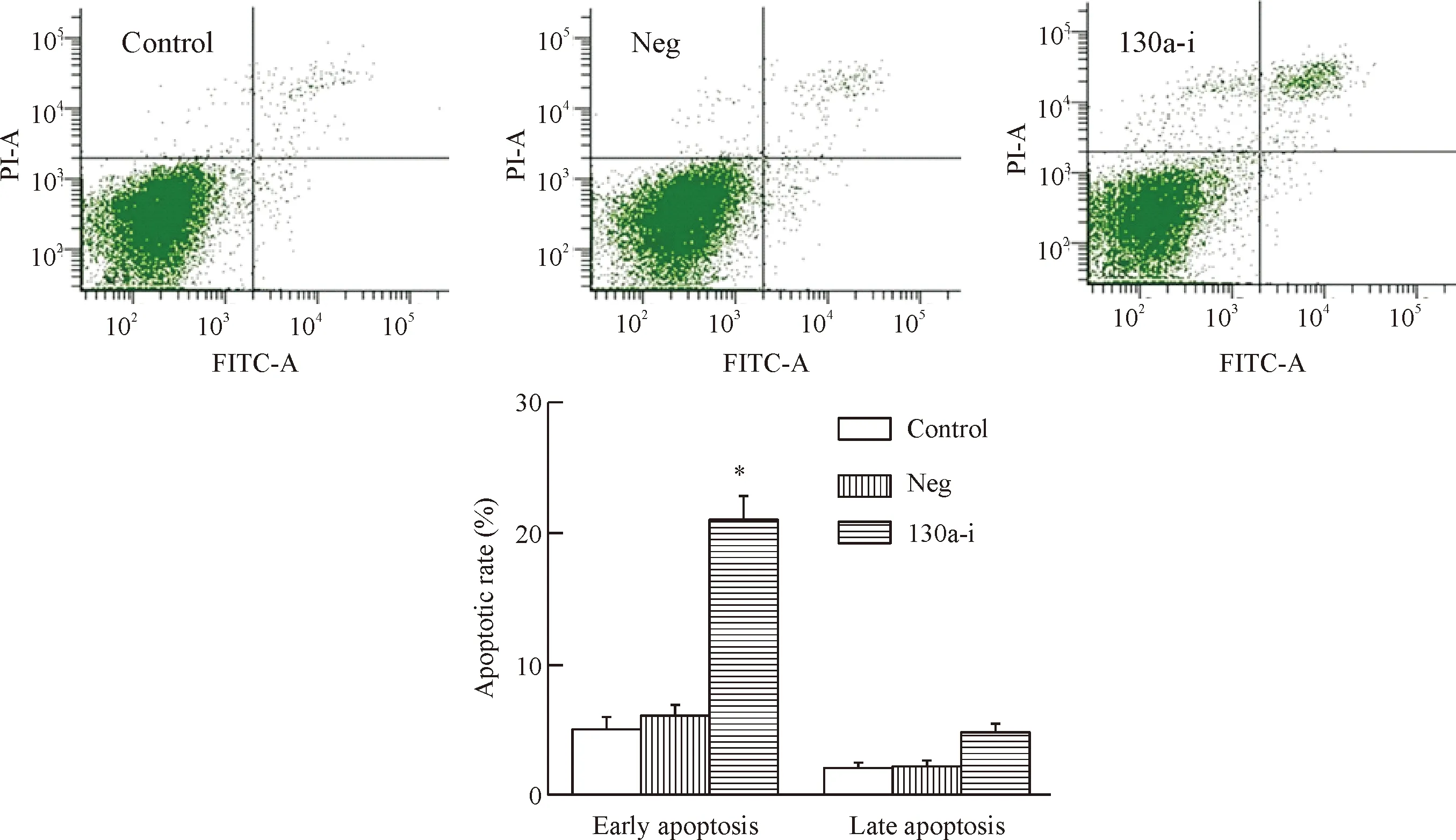
Figure 4. Down-regulation of miR-130a promoted the apoptosis of BASMCs. Mean±SD.n=6.*P<0.05vscontrol group.
图4下调miR-130a促进BASMCs凋亡

Figure 5. The changes of the protein levels of cell cycle-and apoptosis-related molecules in the BASMCs after down-regulaton of miR-130a expression. Mean±SD.n=6.*P<0.05vscontrol group.
图5下调miR-130a影响细胞周期及凋亡相关因子的表达
miRNAs作用的发挥是通过调控靶基因的表达实现的,有研究显示Gax是miR-130a的靶基因之一[16],本实验也发现AngⅡ除了可以促进BASMCs中miR-130a的表达之外,还可抑制Gax的表达;而下调miR-130a可促进Gax的表达,说明下调miR-130a影响BASMCs生物学功能可能与促进Gax的表达有关,但是两者之间具体的作用机制还有进一步的研究。
综上所述,沉默miR-130a可上调BASMCs中Gax表达,进而影响细胞周期及凋亡相关因子的表达,从而抑制细胞活力,并促进其凋亡,提示miR-130a可作为高血压脑血管重构的一个潜在诊疗靶点。
[参 考 文 献]
[1] Yang L, Li L, Lewington S, et al. Outdoor temperature, blood pressure, and cardiovascular disease mortality among 23 000 individuals with diagnosed cardiovascular diseases from China[J]. Eur Heart J, 2015, 36(19):1178-1185.
[2] Sakao S, TatsumiK. Vascular remodeling in pulmonary arterial hypertension: multiple cancer-like pathways and possible treatment modalities[J]. Int J Cardiol, 2011, 147(1):4-12.
[3] Poittevin M, Lozeron P, Hilal R, et al. Smooth muscle cell phenotypic switching in stroke[J]. Transl Stroke Res, 2014, 5(3):377-384.
[4] Thompson AA, Lawrie A. Targeting vascular remodeling to treat pulmonary arterial hypertension[J]. Trends Mol Med, 2017, 23(1):31-45.
[5] Mohr AM, Mott JL. Overview of microRNA biology[J]. Semin Liver Dis, 2015, 35(1):3-11.
[6] Salmanidis M, Pillman K, Goodall G, et al. Direct transcriptional regulation by nuclear microRNAs[J]. Int J Biochem Cell Biol, 2014, 54:304-311.
[7] Fang YC, Yeh CH. Role of microRNAs in vascular remodeling[J]. Curr Mol Med, 2015, 15(8):684-696.
[8] Yu X, Li Z. microRNAs regulate vascular smooth muscle cell functions in atherosclerosis (review)[J]. Int J Mol Med, 2014, 34(4):923-933.
[9] Lu C, Wang X, Ha T, et al. Attenuation of cardiac dysfunction and remodeling of myocardial infarction by microRNA-130a are mediated by suppression of PTEN and activation of PI3K dependent signaling[J]. J Mol Cell Cardiol, 2015, 89(Pt A):87-97.
[10] 庞东卫, 韩 莉, 刘 洁, 等.HO通过减少ROS生成抑制AngⅡ的致血管平滑肌细胞增殖肥大[J]. 中国病理生理杂志, 2009, 25(3):476-479.
[11] Erdmann K, Kaulke K, Rieger C, et al. MiR-26a and miR-138 block the G1/S transition by targeting the cell cycle regulating network in prostate cancer cells[J]. J Can-cer Res Clin Oncol, 2016, 142(11):2249-2261.
[12] Bendris N, Lemmers B, Blanchard JM. Cell cycle, cytoskeleton dynamics and beyond: the many functions of cyclins and CDK inhibitors[J]. Cell Cycle, 2015, 14(12):1786-1798.
[13] Yoo SH, Lim Y, Kim SJ, et al. Sulforaphane inhibits PDGF-induced proliferation of rat aortic vascular smooth muscle cell by up-regulation of p53 leading to G1/S cell cycle arrest[J]. Vascul Pharmacol, 2013, 59(1-2):44-51.
[14] Xu Q, Wu X, Li Y, et al. Iptakalim induces mitochon-dria-dependent apoptosis in hypoxic rat pulmonary arterial smoothmuscle cells[J]. Biomed Pharmacother, 2016, 84:773-779.
[15] Laulier C, Lopez BS. The secret life of Bcl-2: apoptosis-independent inhibition of DNA repair by Bcl-2 family members[J]. Mutat Res, 2012, 751(2):247-257.
[16] Chen Y, Gorski DH. Regulation of angiogenesis through a microRNA (miR-130a) that down-regulates antiangiogenic homeobox genes GAX and HOXA5[J]. Blood, 2008, 111(3):1217-1226.
