结直肠癌细胞通过IL-33/ST2轴招募肥大细胞的研究
2018-09-10马孙强李济宇
马孙强, 马 成, 李济宇
(1. 同济大学附属第十人民医院普外科,上海 200072; 2. 安徽医科大学上海临床学院,上海 200072)
结直肠癌作为最常见的消化道恶性肿瘤之一,2012年全世界新增结直肠癌患者140万,约70万患者死于结直肠癌[1-2]。在我国,结直肠癌发病率逐年升高,在男性和女性中分别成为发病率居第3位和第2位的恶性肿瘤[3]。以往的研究[4-5]表明,结直肠癌组织中肥大细胞的数目较多,且与肿瘤的分期和预后有关。但是结直肠癌组织中肥大细胞数目增多的机制还不是很清楚,因此探索被募集至肿瘤组织的肥大细胞数目增多的机制对进一步理解结直肠癌的发生发展具有重要意义。Fang等[6]研究表明,结直肠癌组织中IL-33的表达增加。同时之前的研究[7-8]发现,骨髓来源肥大细胞(bone marrow-derived mast cell, BMMC)表面表达IL-33的受体ST2。由此,本研究旨在探讨被募集至结直肠癌组织的肥大细胞是否是通过肿瘤组织高表达的IL-33作用于肥大细胞表面的ST2受体这一IL-33/ST2轴来实现的,以及是否被活化产生多种细胞因子,从而促进了结直肠癌的发展。
1 材料与方法
1.1 一般资料
15组结直肠癌及其相应的癌旁组织切片和患者信息由同济大学附属第十人民医院病理科提供,已获得患者的知情同意。以上病例均无其他恶性肿瘤病史,临床资料和病理资料完整。
1.2 细胞及主要试剂
肥大细胞株HMC-1、LAD2和人结肠癌细胞株DLD-1、LoVo均购自中国科学院上海生命科学研究院细胞资源中心。Boyden迁移小室购自美国Costar公司(货号: 3422);TRIzol购自美国Invitrogen公司;反转录试剂盒(货号: RR037A)、PCR试剂盒(货号: AA4701A)购自日本TaKaRa公司;抗ST2抗体(货号: ab25877)、抗IL-33抗体(货号: ab54385)和sST2(货号: ab219662)购自美国Abcam公司,TPSAB1抗体(货号: 13343-1-AP)购自美国Proteintech公司。
1.3 方法
1.3.1 组织免疫荧光染色检测肿瘤标本中肥大细胞以及IL-33的表达 每组肿瘤组和癌旁组内每张切片随机截取3个200倍视野。尽量让组织充满整个视野,保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件(Media Cybernetics, Inc., Rockville, MD, USA),选取相同的绿色作为判断所有照片阳性的统一标准,对每张照片进行分析得出每张照片阳性的累积光密度值(integral optical density, IOD)。
1.3.2 细胞免疫荧光检测ST2的表达 用含有10%的胎牛血清(FBS)的RPMI 1640培养基将肥大细胞均匀铺在共聚焦皿上,放入37℃、5%CO2细胞培养箱中,以备第2天使用。将前1天铺有肥大细胞的共聚焦皿从细胞培养箱中取出,用PBS轻轻冲洗2次,经4%甲醛固定,BSA封闭,一抗二抗孵育后,滴加抗猝灭剂后荧光显微镜下观察。
1.3.3 条件培养基(conditioned media)的制备 人结肠癌细胞株用含10%FBS的DMEM培养基培养,待正常培养的结肠癌细胞长满培养皿,去除培养液,换成无血清DMEM培养基,培养48h,收集上清液离心过滤即得条件培养基。
1.3.4 Transwell细胞迁移实验 实验采用8μm孔径24孔Boyden迁移小室,将3×104LAD2细胞重悬于200μL无血清RPMI 1640加入上室,下室分别加入500μL各实验组别培养基(IL-33组、DLD-1-CM组和LoVo-CM组)。放入37℃恒温细胞培养箱,14h后取出小室,通过固定,结晶紫染色,显微镜下拍照,计数并统计穿膜细胞数目。
1.3.5 细胞总RNA的提取以及RT-qPCR检测 按照TRIzol试剂说明书提取细胞总RNA,按照反转录试剂盒的操作步骤将总RNA反转录为cDNA,根据PCR试剂盒说明书进行RT-qPCR检测,在ABI Prism 7500系统上进行扩增。以GAPDH为内参,采用相对定量法(2-ΔΔCt)进行定量分析。反应体系为20μL,扩增条件: 95℃ 5min变性,95℃ 30s,55℃ 30s,72℃ 30s,30个循环,72℃ 5min。所用引物序列见表1。
1.3.6 Western印迹法检测 收集待检测细胞,提取细胞蛋白。按照BCA蛋白定量试剂盒测定蛋白浓度。100℃,10min高温变性,加入6×蛋白上样缓冲液。经过10% SDS-PAGE电泳,PVDF膜转膜,10%脱脂牛奶室温封闭1h,一抗孵育过夜,TBST清洗5min,共6次,二抗37℃孵育1h,TBST清洗5min,共3次,然后暗室曝光显影。

表1 引物序列Tab.1 Sequence for primers
1.4 统计学处理
2 结 果
2.1 结直肠癌组织中,肥大细胞数目和IL-33含量增加
研究[9]发现,分布在皮肤、肠黏膜的肥大细胞表达类胰蛋白酶(tryptase),可以作为肥大细胞的标记蛋白。免疫荧光结果显示,结直肠癌旁组织和癌组织的肥大细胞数量分别为(26.26±15.35)和(73.29±33.44)个,与癌旁组织相比,结直肠癌组织的肥大细胞数量明显多于癌旁组织(P<0.001),见图1A、B;肿瘤组织中的IL-33含量显著高于癌旁组织(P<0.001),见图1C、D。

图1 组织免疫荧光检测结肠癌组织和癌旁组织的肥大细胞数目和IL-33表达情况Fig.1 Immunofluorescence staining was performed to determine the number of MCs infiltrated in CRC or adjacent tissues and the expression of IL-33A: 免疫荧光检测结直肠癌组织和癌旁组织的肥大细胞表达情况;B: 统计分析结直肠癌组织及癌旁组织肥大细胞数目;C: 免疫荧光检测结直肠癌组织和癌旁组织的IL-33表达情况;D: 统计分析结直肠癌组织及癌旁组织IL-33的表达量;与癌旁组织相比,*P<0.001
2.2 肥大细胞表达IL-33的受体ST2
为了验证结肠癌组织中浸润的肥大细胞可能是通过IL-33/ST2轴被募集过来的,本研究通过细胞免疫荧光和Western印迹法检测肥大细胞株HMC-1和LAD-2的ST2的表达情况。细胞免疫荧光显示,ST2在胞膜和胞质中呈现绿色荧光,提示ST2表达于肥大细胞胞膜和胞质,见图2A、B。Western印迹法结果显示,HMC-1和LAD-2均表达ST2,见图2C。
2.3 IL-33/ST2轴在肥大细胞招募中的作用
为了验证IL-33在肿瘤组织招募肥大细胞的过程起作用,本次研究做了Transwell细胞迁移实验。结果显示,添加IL-33、DLD-1-CM和LoVo-CM的肥大细胞相比空白对照组迁移能力显著增强(P<0.05),而上述3组在添加IL-33抑制剂sST2后,肥大细胞的迁移能力又明显减弱(P<0.01),见图3。上述结果提示加入IL-33抑制剂sST2后,肥大细胞的迁移能力相比对照组减弱,说明IL-33可能在肿瘤组织招募肥大细胞的过程中起着重要的作用,并且是通过IL-33/ST2轴来实现的。
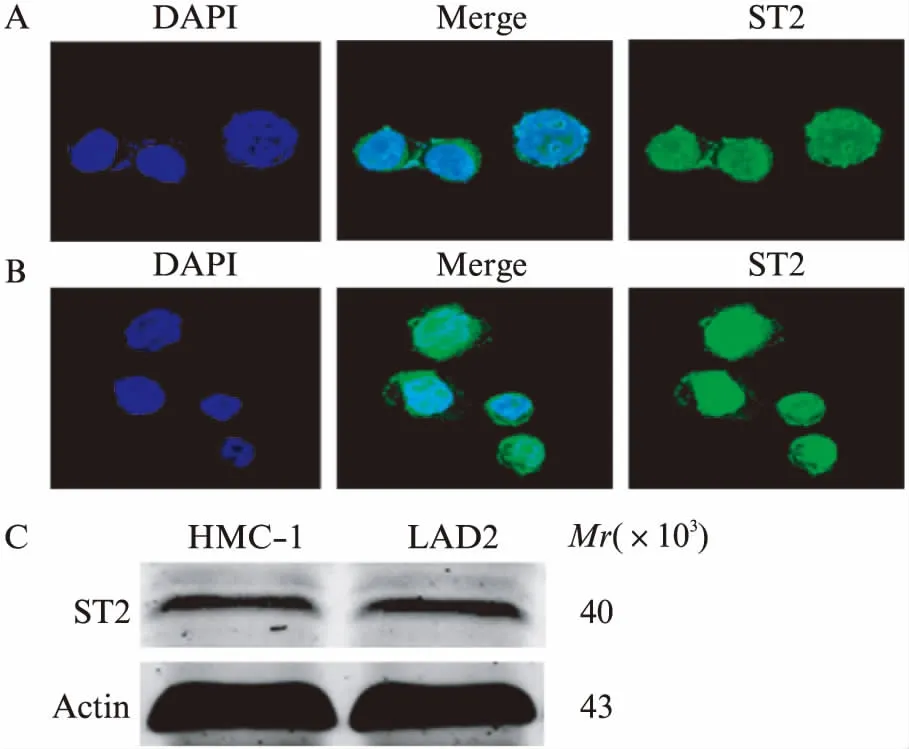
图2 细胞免疫荧光和Western印迹法检测肥大细胞表面ST2的表达Fig.2 Immunofluorescence and Western blotting were performed to detect ST2 expression on mast cellsA: HMC-1细胞;B: LAD2细胞;C: Western 印迹法检测
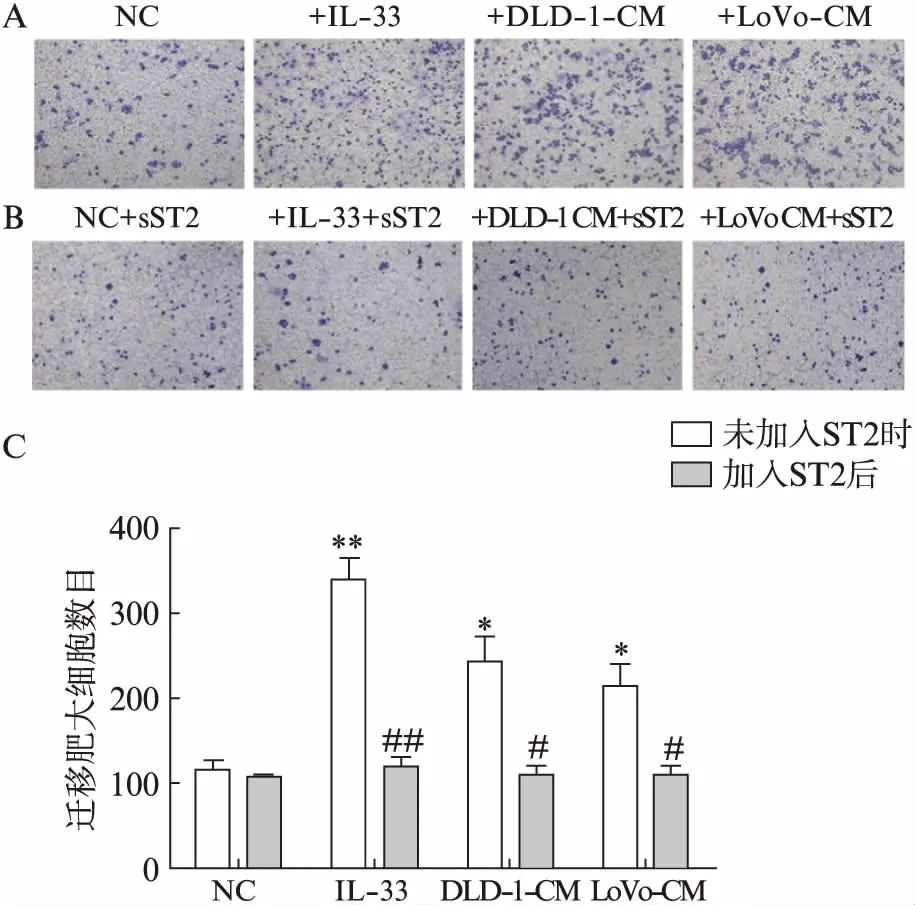
图3 Transwell细胞迁移实验检测肥大细胞迁移能力的变化Fig.3 Transwell assay was performed in MCsA: 从左到右的下层小室培养基分别是: 无血清RPMI 1640,无血清RPMI 1640+IL-33(10ng/mL),DLD-1-CM,LoVo-CM;B: 分别将A图四组中加入IL-33抑制剂sST2(10ng/mL); C: 迁移能力比较;与NC组相比,*P<0.05,**P<0.01,与末加入sST2时相比,#P<0.05,##P<0.01
2.4 肿瘤细胞对招募的肥大细胞的影响
为了进一步研究肥大细胞在通过IL-33/ST2轴被募集至肿瘤组织后是否被活化,将肥大细胞与肿瘤细胞共培养,利用细胞的贴壁能力的差异将肥大细胞分离出后,分别于第0、2、4、8、12、24小时在mRNA水平检测肥大细胞细胞因子IL-4、IL-6、IL-10和GM-CSF的表达。结果显示,与对照组相比,与结肠癌细胞共培养后的肥大细胞表达IL-4、IL-6、IL-10和GM-CSF转录水平明显增加,其中IL-4和GM-CSF转录水平在8h上升最显著,IL-4是对照组的(13.71±1.57)倍(P=0.012),GM-CSF是对照组的(6.46±1.25)倍(P<0.01);IL-6在24h表达水平最高,是对照组的(4.55±0.06)倍(P<0.01);IL-10在4h表达水平上升最显著,是对照组的(6.44±0.65)倍(P<0.01),见图4。
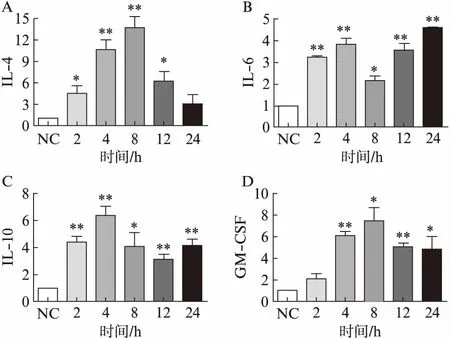
图4 与结肠癌细胞共培养的肥大细胞活化产生多种细胞因子Fig.4 Mast cells co-cultured with colon cancer cells activated to produce multiple cytokinesA: IL-4; B: IL-6; C: IL-10; D: GM-CSF;与NC组相比,*P<0.05,**P<0.01
3 讨 论
结直肠癌肿瘤微环境免疫细胞与肿瘤发生发展密切相关,也被认为是其免疫治疗成败的关键[10]。本研究发现,结直肠癌在发生发展过程中能够大量表达IL-33,并能够通过该途径募集肥大细胞至肿瘤组织中。肥大细胞作为组织驻留的岗哨细胞,广泛存在于与外界相通的结直肠中。本次研究进一步发现,肥大细胞与CRC细胞共培养后,MC表达IL-4、IL-6、IL-10和GM-CSF等多种与其生长相关的细胞因子,这为肥大细胞在肿瘤进展过程中发挥其免疫学作用提供了重要的支撑。
肥大细胞起源于CD34+、CD13+、c-kit+的造血干细胞,并迁移到周围组织中完成其分化成熟过程,此后依据特定免疫刺激而发挥相应功能[11]。近年研究[12]发现,肥大细胞并不仅仅局限于在抗寄生虫和过敏反应中的主导作用,其与肿瘤关系也日益受到重视[9,12-14]。肿瘤浸润骨髓细胞在肿瘤的生长中发挥积极作用,肥大细胞是一个最早的浸润肿瘤的细胞类型[15]。肥大细胞通常积聚在正常组织和恶性肿瘤的连接区,在肿瘤微环境血管生成,细胞毒性作用介导以及组织重塑中均发挥重要作用[16]。本实验通过利用15组结直肠癌及其相应的癌旁组织标本,证实肥大细胞在肿瘤组织中广泛浸润。既往研究中,Strouch等[9]通过对53组人胰腺癌组织及其相应的癌旁组织标本进行免疫组织化学染色发现,胰腺癌组织中的肥大细胞数目显著高于邻近癌旁组织,并且肥大细胞的浸润与患者的不良预后存在着关联;Melillo等[13]对96例甲状腺癌组织和14例正常甲状腺组织进行免疫组织化学染色发现,肥大细胞仅存在于癌组织中,13例正常甲状腺组织中仅有1例少量浸润,并且高表达肥大细胞的甲状腺癌患者发生肿瘤远处转移的风险较高。这些均和本次研究结果一致,然而肥大细胞是如何浸润于肿瘤组织中还有待进一步明确。
发展中的肿瘤细胞可以释放出多种促进免疫细胞募集的细胞因子[17],而IL-33是一种多功能细胞因子,在介导2型辅助性T细胞(helper T cell 2, Th2) 型和固有淋巴细胞2(innate lymphoid cell 2, ILC2)免疫反应中发挥关键作用[18]。本研究发现IL-33同样在结直肠癌肿瘤组织中高表达,且与肥大细胞的分布和丰度高度一致。肥大细胞作为介导Th2型免疫反应的重要细胞类型,并高表达IL-33的受体ST2,通过体外细胞迁移实验发现,以添加IL-33为阳性对照组,在含DLD-1-CM和LoVo-CM的肥大细胞中,相比空白对照组其迁移能力显著增强,提示结肠癌细胞可通过产生特定细胞因子促进肥大细胞迁移;进一步加入IL-33受体抑制剂sST2后,肥大细胞的迁移能力有显著下降,证明结肠癌细胞产生的IL-33在肥大细胞迁移中起着重要的作用。值得一提的是,之前有研究[19]表明,IL-33在介导中性粒细胞迁移进而加重类风湿关节炎中同样发挥重要作用。Fang等[6]也证实IL-33通过招募巨噬细胞促进结直肠癌细胞干细胞干性的表达。
IL-33/ST2轴不仅能够触发Th2型免疫,研究表明它还能通过上调抗凋亡分子(B-cell lymphoma-X large, BCLXL)维持人皮肤来源和小鼠骨髓来源肥大细胞的生长[20]。本研究将肥大细胞与结肠癌细胞共培养发现,共培养后的肥大细胞中IL-4、IL-6、IL-10和GM-CSF转录水平明显增加,这些细胞因子可以促进肥大细胞的生存生长[8,21-22]。
综上,本研究证明了结直肠癌组织通过产生IL-33作用于肥大细胞表面的ST2受体将其募集至肿瘤部位,为结直肠癌中肥大细胞的浸润机制提供了重要的思路,为完善结直肠癌的治疗提供了新的理论基础。
