枸杞多糖减轻过氧化氢诱导的人内皮样细胞EA.hy926氧化损伤*
2018-06-30王玉林吕林林高永清刘革修王林静
王玉林,吕林林,王 霞,高永清,周 兆,刘革修△,王林静△
(1广东药学院公共卫生学院, 广东 广州 510006; 2暨南大学基础医学院血液学研究所, 广东 广州 510632)
心脑血管疾病是我国发病率与致残率较高的疾病之一,严重影响着人们的生活质量。心脑血管疾病的发生机制极其复杂,其可能受到同型半胱氨酸[1]、炎症[2]、高血脂、高血糖[3]和高血压等不良刺激的影响,致机体氧化与抗氧化失衡,从而不同程度地损伤血管内皮细胞,发生多种心脑血管疾病和严重的并发症。在正常生理条件下,血管内皮细胞不仅维持血管的完整性还具有内分泌功能,分泌内皮素和一氧化氮(nitric oxide,NO)等血管活性物质,进而调节血管的舒缩功能,与机体的生理活动相协调。因此,保护和预防血管内皮细胞损伤在心脑血管疾病的防治中起着重要性的作用。
经研究发现枸杞多糖(Lyciumbarbarumpolysaccharides,LBP)是从枸杞子中提取的一种多聚糖与多肽和蛋白质结合的可溶性复合物, 主要由阿拉伯糖、葡萄糖、半乳糖、甘露糖、木糖和鼠李糖 6 种单糖组成,有抗氧化、抗衰老、抗肿瘤、降血糖和增强免疫功能等多种广泛重要的生物活性作用[4],比如其能减轻过氧化氢(hydrogen peroxide,H2O2)诱导的子宫内膜基质细胞的损伤[5]。但枸杞多糖防治血管内皮细胞损伤的作用机制尚未阐明。因此,本研究将探讨LBP对过氧化氢损伤的EA.hy926细胞活力、迁移和凋亡等生物学特性的影响以及参与调控的潜在信号通路,为开发LBP及其类似物治疗和治疗心脑血管损伤性疾病提供依据。
材 料 和 方 法
1 材料与试剂
人内皮样细胞EA.hy926购自中国医学科学院基础医学研究所细胞资源中心;枸杞多糖由暨南大学药学院叶文才教授课组提供;30% H2O2购自广州化学试剂厂;高糖DMEM培养基(HyClone); CCK-8试剂(日本同仁公司);胎牛血清(fetal bovine serum,FBS)和0.25%胰酶(Sigma-Aldrich);吖啶橙(acridine orange,AO)和溴乙啶(ethidium bromide,EB)购自MYM Technologies Limited;血管内皮生长因子(vascular endothelial growth factor,VEGF) ELISA试剂盒和NO检测试剂盒(南京建成生物工程研究所);细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司);磷脂酰肌醇3-激酶(phosphatidylinsitol 3-kinase,PI3K)抑制剂LY294002(Selleck);ECL化学发光试剂盒(Thermo);兔抗人cleaved caspase-3单克隆抗体、鼠抗人Bcl-2单克隆抗体、兔抗人Akt单克隆抗体、鼠抗人p-Akt单克隆抗体、兔抗人内皮型NO合酶(endothelial NO synthase,eNOS)单克隆抗体、兔抗人p-eNOS(Ser1177)单克隆抗体和鼠抗人β-actin单克隆抗体(CST)。
2 主要方法
2.1细胞培养 将冻存的EA.hy926细胞复苏,转移到25 cm2细胞培养瓶,加入含1%青链霉素和10% FBS的高糖DMEM培养基,置于37 ℃、5% CO2、饱和湿度的CO2培养箱中培养,取对数期细胞进行实验。
2.2实验分组 实验分为5个组:对照(control)组,损伤模型(damage)组(50 mmol/L H2O2)、LBP组(100 mg/L LBP)、抗损伤(anti-damage)组[分为3个亚组,分别用50 mg/L(low dose)、100 mg/L(medium dose)和200 mg/L(high dose)枸杞多糖预处理1 h后加入50 mmol/L H2O2,之后共处理24 h]和LY294002组(在抗损伤组的基础上加入PI3K抑制剂LY294002,浓度为20 μmol/L)。
2.3CCK-8法检测细胞活力 取对数期细胞制成细胞悬液,调整密度为5×107/L,每孔100 μL细胞悬液接种到96孔板,在5% CO2、37 ℃和湿度培养箱中培养12 h,更换成新鲜的含10% FBS高糖DMEM培养基后,按分组加入相应药物处理,于培养箱中培养24 h后,收集上清液,换上新的培养基并每孔加入10 μL CCK-8溶液,培养箱中避光孵育2 h,于酶标仪450 nm(参比波长为630 nm)处检测各组的吸光度,实验设4个复孔,重复4次。
2.4划痕法测定细胞迁移能力 取对数期生长的EA.hy926细胞制成细胞悬液,按每孔1×106的密度接种于6孔板,待细胞生长至80%融合,使用无菌的200 μL枪头垂直于6孔板均匀地划4条互相垂直的横线,PBS洗去脱落的细胞,然后加入新鲜含10% FBS的高糖DMEM培养基,并加入LBP使其终浓度为100 mg/L,处理1 h;然后,damage组和anti-damage组分别加入H2O2使其终浓度均为50 mmol/L继续培养,分别于0 h、12 h、24 h和48 h,在带有拍照系统的倒置显微镜(Leica)下观察拍照,然后使用ImageJ软件对各组在不同时间点的划痕宽度进行相对测量。
2.5流式细胞术检测细胞凋亡 取对数生长期的EA.hy926细胞制成细胞悬液,按每孔1×106个接种于6孔板中,培养12 h后,加入LBP使其终浓度为100 mg/L,预处理1 h;然后对damage组和anti-damage组加入H2O2使其终浓度为50 mmol/L,培养24 h后,胰酶消化后,用1 000 r/min离心机离心5 min收集细胞进行Annexin V-FITC+PI染色,染色方法参照试剂盒,然后在流式细胞仪(BD)上检测。
2.6AO/EB染色检测细胞凋亡 取对数生长期的EA.hy926细胞制成细胞悬液,按每孔50 000的密度接种于25T培养瓶中,10% FBS的高糖DMEM培养基中培养,当细胞长至70%~80%融合时,加入LBP使其终浓度为100 mg/L,预处理1 h后加入H2O2使其终浓度为50 mmol/L;在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养24 h后,收集所有细胞(包括细胞培养液中的)进行AO/EB染色,将收集的细胞用适量的PBS重悬混匀,并吸取50~100 μL的细胞混悬液于载玻片上进行涂片,接着滴加50 μL的AO/EB混合液(浓度均为10 mg/L)并盖上盖玻片,然后立即在正立荧光显微镜(Leica)下拍照观察。
2.7Griess法检测细胞上清NO水平 取对数生长期的EA.hy926细胞制成细胞悬液,按每孔1×106个接种于6孔板中,培养12 h后,加入LBP使其终浓度为100 mg/L,预处理1 h后加入H2O2使其终浓度为50 mmol/L;培养30 min后收集细胞上清液,按照试剂盒操作测定 NO 水平。首先制作标准曲线,采用分光光度计在 450 nm 波长处检测各组的吸光度。
2.8ELISA法检测细胞培养上清VEGF的水平 取对数生长期的EA.hy926细胞制成细胞悬液,按每孔1×106个接种于6孔板中,培养12 h后,加入LBP使其终浓度为100 mg/L,预处理1 h后加入H2O2使其终浓度为50 mmol/L;培养30 min后收集细胞培养上清,按照试剂盒操作测定VEGF水平。采用分光光度计在 450 nm 波长处检测各组的吸光度。
2.9Western blot检测蛋白水平 取对数生长期的EA.hy926细胞制成细胞悬液,置于10% FBS的高糖DMEM培养基中培养,当细胞长至70%~80%融合时,加入LBP使其终浓度为100 mg/L,预处理1 h后加入H2O2使其终浓50 mmol/L;在37 ℃、5% CO2且饱和湿度的细胞培养箱中培养24 h,RIPA法提取细胞总蛋白,BCA试剂盒定量,100 ℃变性5 min后上样,SDS-PAGE 60 V,30 min后,改为110 V,60 min,转至PVDF膜上,TBST漂洗后,5%脱脂奶粉封闭 1 h,孵育 I 抗过夜,TBST漂洗3次,II 抗摇床孵育1 h,TBST漂洗3次,ECL试剂盒显色,最后在全自动化学发光和荧光凝胶成像系统(UVITEC)中显影拍照观察,并用Gel-Pro Analyzer 6.0 软件对照片进行分析。
3 统计学处理
用SPSS 13.0进行数据的统计学分析,用Graph-Pad Prism 7.00进行统计绘图。所有实验均重复4次,实验数据以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,两两比较各组方差齐时用Student-Newman-Keuls (SNK)检验,方差不齐时采用Tamhane’s T2法。以P<0.05为差异有统计学意义。
结 果
1 LBP对H2O2损伤的EA.hy926细胞活力的影响
与control组相比,damage组EA.hy926细胞的活力明显降低(P<0.05);与damage组比较,LBP预处理能明显提高细胞活力(P<0.05);LBP的me-dium dose(100 mg/L)组提高细胞活力最明显(P<0.05),但low dose组和high dose组之间的差异无统计学显著性,故选LBP浓度为100 mg/L用于后续实验,见图1。

Figure 1. The effects ofLyceumbarbarumpolysaccharides (LBP) on the viability of EA. hy926 cells induced by H2O2. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsdamage group;△P<0.05vsmedium dose group.
图1枸杞多糖对H2O2损伤的EA.hy926细胞活力的影响
2 LBP对H2O2诱导的EA.hy926细胞凋亡及其形态学的影响
2.1LBP对H2O2诱导的EA.hy926细胞凋亡的影响 经100 mg/L的LBP预处理1 h后,加入H2O2(50 mmol/L)处理24 h,EA.hy926细胞的凋亡情况所示,与control组相比,damage组的细胞凋亡率明显升高(P<0.05);与damage组相比,anti-damage的凋亡率显著下降(P<0.05);LBP组的凋亡率与control组的凋亡率比较差异无统计学显著性,见图2。

Figure 2. The effect of LBP on the apoptosis of EA.hy926 cells induced by H2O2. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsdamage group.
图2LBP对H2O2诱导的EA.hy926细胞凋亡的影响
2.2LBP对H2O2诱导的EA.hy926细胞形态学的影响 AO能透过所有的细胞膜,并将其染成绿色,只有细胞膜不完整的细胞可以吸收EB,将核染成红色。因此,活细胞拥有正常的绿色;早期凋亡细胞的核绿色更明显,并且核内染色体出现片段状;晚期凋亡细胞出现聚缩的片段化橙色染色体;坏死细胞则显示橙色核。经H2O2(50 mmol/L)处理24 h后收集细胞,经AO/EB染色,细胞的形态发生明显改变;control组的细胞呈正常的圆形且拥有绿色的细胞核,而damage组的细胞呈现大量的红色细胞核;anti-damage组的细胞有少部分细胞核呈现红色;LBP组的细胞形态和control组比较无明显区别,见图3。
3 LBP对H2O2诱导的EA.hy926细胞培养上清中NO和VEGF水平的影响
与control组相比,damage组的NO浓度显著降低(P<0.05);与damage组比较,anti-damage组的NO浓度明显升高(P<0.05);与anti-damage组比较,LY294002组的NO浓度显著降低(P<0.05),提示LBP通过提高NO水平减轻H2O2对EA.hy926细胞的损伤作用,见图4A。与control组比较,damage组的VEGF浓度显著降低;与damage组比较,anti-damage组的VEGF浓度明显升高(P<0.05);与anti-damage组比较,LBP组的VEGF浓度显著升高,差异有统计学意义(P<0.05),见图4B。
4 LBP对H2O2诱导的EA.hy926细胞迁移能力的影响
划痕实验中,随着时间的延长(0 h、12 h、24 h和48 h)各实验组的划痕相对距离在逐渐减小,见表1。12 h后damage组与control组划痕间的相对距离比较明显增加(P<0.05)。与damage组比较,anti-damage组的划痕相对距离明显缩短(P<0.05)。LBP组与control组比较差异无统计学显著性,提示枸杞多糖对EA.hy926细胞的迁移有促进作用,见图5及表1。
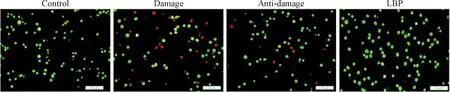
Figure 3. The influence of LBP on the morphlogical changes of H2O2-induced EA.hy926 cells. The scale bar=100 μm.
图3LBP对H2O2诱导的EA.hy926细胞形态学的改变
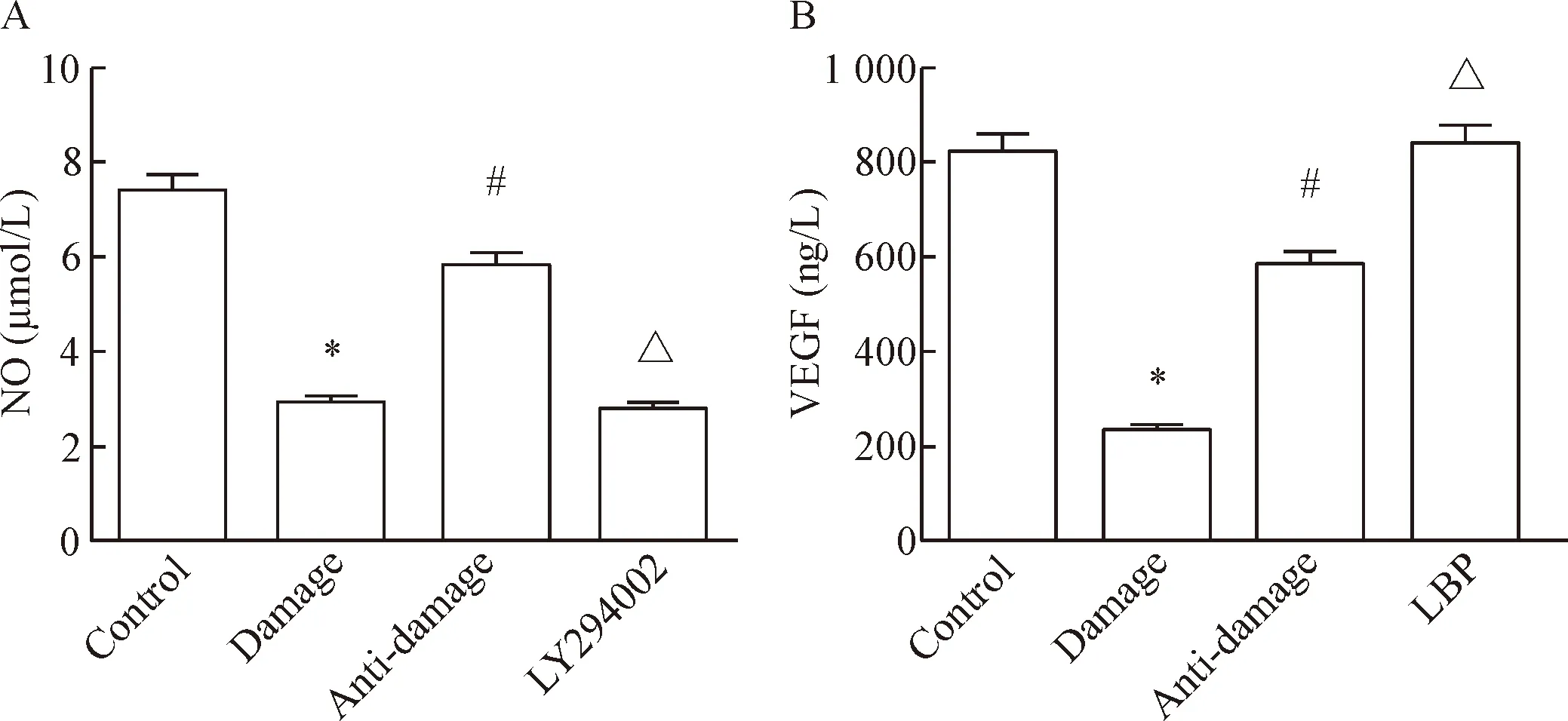
Figure 4. The effects of LBP on the contents of NO (A) and VEGF (B) in H2O2-induced EA.hy926 cells. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsdamage group;△P<0.05vsanti-damage group.
图4LBP对H2O2诱导的EA.hy926细胞培养上清中NO和VEGF含量的影响

Figure 5. The effects of LBP on the migration ability of EA.hy926 cells induced by H2O2(×100).
图5LBP对H2O2诱导的EA.hy926细胞迁移的影响
表1不同时点LBP对H2O2诱导的EA.hy926细胞相对迁移距离的影响
Table 1. The migration distances of the EA.hy926 cells pretreated with LBP under H2O2induction at different time points (μm. Mean±SD.n=4)

Group0 h12 h24 h48 hControl574±23316±12136±2653±17Damage571±16447±11∗351±45∗195±15∗Anti-damage562±18383±48∗#328±32#105±14∗#LBP568±10376±28185±35#△93±24#
*P<0.05vscontrol group;#P<0.05vsdamage group;△P<0.05vsanti-damage group.
5 LBP 对受H2O2损伤的EA.hy926细胞p-Akt、cleaved caspase-3、eNOS、p-eNOS、Bax和Bcl-2蛋白水平的影响
Western blot实验结果显示,与control组相比,damage组的Bcl-2/Bax比值及eNOS和p-eNOS蛋白水平降低,cleaved caspase-3蛋白水平升高(P<0.05);与damage组比较,anti-damage组的Bcl-2/Bax比值升高,cleaved caspase-3蛋白水平降低,eNOS和p-eNOS蛋白水平显著升高(P<0.05);与anti-damage组比较,LY294002组的p-Akt蛋白水平显著降低(P<0.05),见图6。这一结果提示LBP对EA.hy926细胞的保护作用与PI3K/Akt信号通路有关。
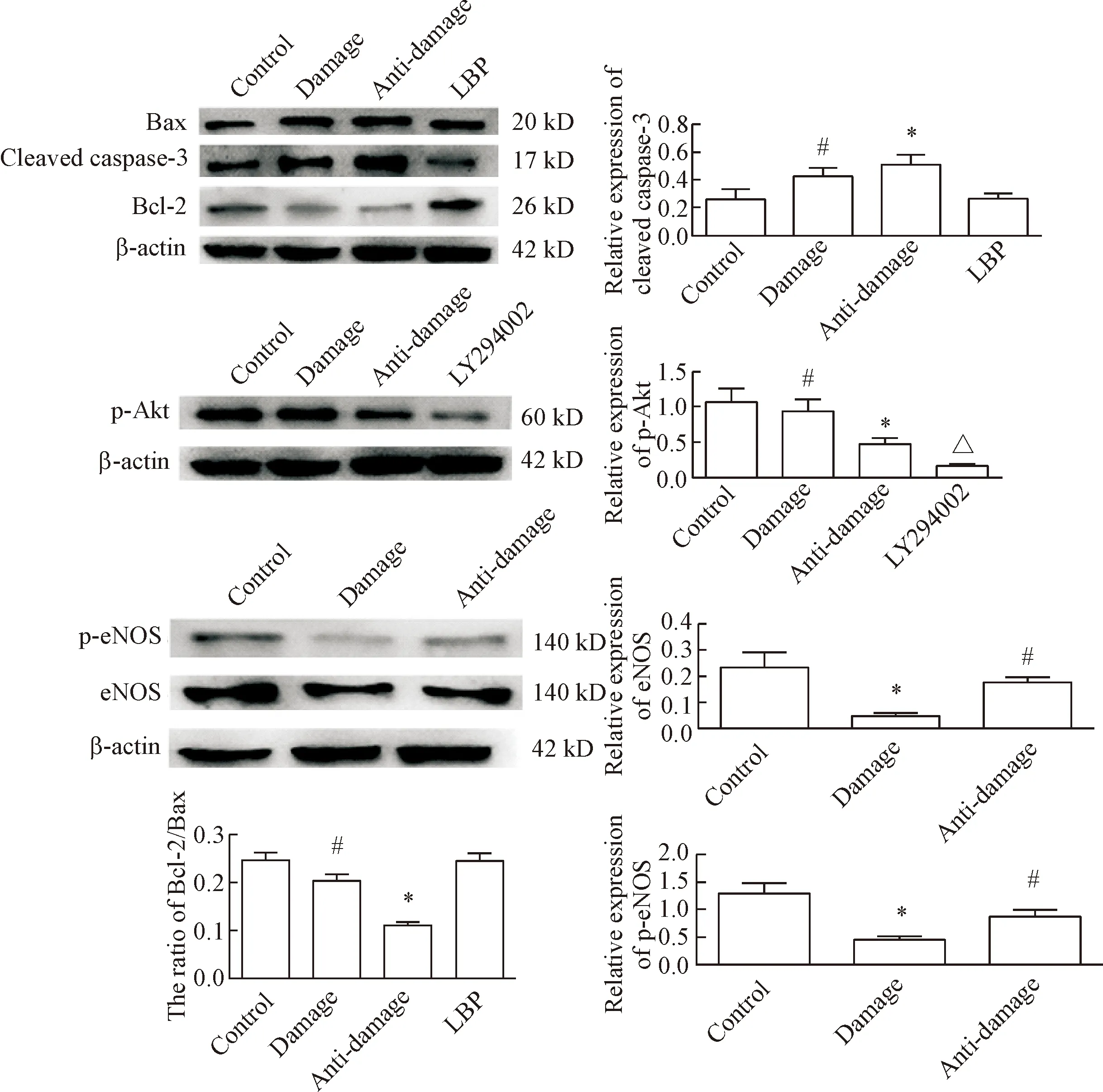
Figure 6. The effects of LBP on the protein levels of Bax, Bcl-2, p-Akt, eNOS, p-eNOS and cleaved casepase-3 in the EA.hy926 cells. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsdamage group;△P<0.05vsanti-damage group.
图6EA.hy926细胞Bax、Bcl-2、eNOS、p-eNOS、p-Akt和cleavedcaspase-3蛋白水平的变化
讨 论
动脉粥样硬化是心脑血管疾病的主要发病因素,而血管内皮氧化应激反应则是动脉粥样硬化重要发病机制之一[6]。一方面,氧化应激产生的氧自由基可以增加内皮细胞通透性,有利于脂质成分进入内皮下,引起炎症反应,导致LDL转变形成ox-LDL、诱发动脉粥样硬化的发生;另一方面,氧化应激中的氧自由基不仅刺激内皮细胞分泌促进血管收缩的物质,影响内皮依赖性血管舒张功能缺陷,进而加速血管管壁的重构,而且过度的氧化应激可以促进内皮细胞的凋亡[7]。本研究结果发现,LBP预处理减轻H2O2对EA.hy926细胞的损伤,提高其细胞活力,改善其迁移能力,提高了分泌VEGF的水平; LBP通过上调Bcl-2蛋白表达,下调Bax蛋白表达,增加Bcl-2/Bax比值,降低cleaved caspase-3蛋白水平,从而抑制H2O2诱导的内皮细胞凋亡。细胞凋亡通常涉及到2种信号通路,包括线粒体通路和细胞死亡受体通路。氧化应激发生时,线粒体膜电位降低,并释放大量的氧化应激产物。线粒体通路的特征是线粒体释放细胞色素C,随后形成一种细胞色素C/Apaf-1复合物,进一步激活caspase。细胞死亡受体通路的特征是细胞死亡受体与其配体结合,然后激活caspase-3,最终诱导细胞凋亡[8-9]。本研究中,H2O2处理后上调cleaved caspase-3蛋白表达,LBP预处理下调cleaved caspase-3蛋白表达,表明LBP通过抑制caspase信号通路的激活,从而抑制了H2O2对EA.hy926细胞的损伤。为探究预处理的药物对细胞形态的变化情况,本实验采用AO/EB染色在荧光显微镜下观察到,H2O2处理的EA.hy926细胞的核染色质呈明显的红色;LBP预处理的核染色质大部分呈现正常的绿色,少部分呈红色;结果显示LBP对H2O2诱导的细胞凋亡具有明显的抑制作用。
研究表明,eNOS对血管活性具有重要调节作用,多种刺激因子通过激活PI3K/Akt信号通路调节其表达[10-11]。为了进一步研究LBP对H2O2损伤的EA.hy926细胞的保护作用机制是否与PI3K/Akt/eNOS信号通路有关,本研究中,与damage组比较,LBP预处理提高细胞上清液中NO水平和上调p-Akt、eNOS和p-eNOS蛋白水平。加入PI3K抑制剂后,发现细胞上清液NO水平和p-Akt蛋白水平明显下降且有统计学意义,说明LBP改善血管内皮细胞损伤的作用消失。可以得出结论的是LBP对H2O2损伤的EA.hy926细胞保护作用机制是激活PI3K/Akt/eNOS信号通路有关。
综上所述,LBP对H2O2诱导EA.hy926细胞损伤有保护作用,其机制是激活PI3K/Akt/eNOS信号通路,上调p-Akt、eNOS、p-eNOS和Bcl-2的蛋白水平,下调cleaved caspase-3和Bax的蛋白水平,提高内皮细胞的活力及NO和VEGF水平。本研究为体外实验,还需要做体内实验进一步研究LBP对H2O2损伤的机体的整体调节作用,为其在以后的临床应用中提供更多的价值。LBP作为中国的一种传统的中草药,其对机体有较少的副作用,可以有效的预防和治疗心脑血管疾病及其并发症的发生,在临床上长期使用具有潜在的前景。
[参 考 文 献]
[1] Moselhy SS, Demerdash SH. Plasma homocysteine and oxidative stress in cardiovascular disease[J]. Dis Mar-kers, 2003, 19(1):27-31.
[2] García N, Zazueta C, Aguilera-Aguirre L. Oxidative stress and inflammation in cardiovascular disease[J]. Oxid Med Cell Longev, 2017, 27(5):1942-1994.
[3] Kayama Y, Raaz U, Jagger A, et al. Diabetic cardiovascular disease induced by oxidative stress[J]. Int J Mol Sci, 2015, 16(10):25234-25263.
[4] 马倩倩, 李 骏, 张松杰, 等. 枸杞多糖生物活性的研究进展[J]. 农产品加工, 2017, 14(7): 59-61, 66.
[5] Shan T, Shan T, Liu F, et al. Effects of Lycium barbarum polysaccharides on the damage to human endometrial stromal cells induced by hydrogen peroxide[J]. Mol Med Rep, 2017, 15(2):879-884.
[6] Liu L, Lao W, Ji QS, et al. Lycium barbarum polysaccharides protected human retinal pigment epithelial cells against oxidative stress-induced apoptosis[J]. Int J Ophthalmol, 2015, 8(1):11-16.
[7] 骆莹莹, 陈 述, 王大新. 氧化应激对动脉粥样硬化内皮细胞损伤作用的研究进展[J]. 医学综述, 2015, 21(5):772-775.
[8] Park WH. Anti-apoptotic effect of caspase inhibitors on H2O2-treated HeLa cells through early suppression of its oxidative stress[J]. Oncol Rep, 2014, 31(5):2413-2421.
[9] Park WH. Antiapoptotic effects of caspase inhibitors on H2O2-treated lung cancer cells concerning oxidative stress and GSH [J]. Mol Cell Biochem, 2017, 441(1-2):125-134.
[10] Xu L, Zhu J, Yin W, et al. Astaxanthin improves cognitive deficits from oxidative stress, nitric oxide synthase and inflammation through upregulation of PI3K/Akt in diabetes rat[J]. Int J Clin Exp Pathol, 2015, 8(6):6083-6094.
[11] Chang CM, Su YF, Chang CZ, et al. Progesterone attenuates experimental subarachnoid hemorrhage-induced vasospasm by upregulation of endothelial nitric oxide synthase via akt signaling pathway[J]. Biomed Res Int, 2014, 13(6):2314-6141.
