活化素受体样激酶1及其在血管生成中的作用*
2018-06-30林比霖徐方云黄永红
林比霖,徐方云,黄永红△
(南昌大学 1第二临床医学院, 2基础医学院病理生理学教研室, 江西 南昌 330006)
血管生成是指新的血管从已存在的毛细血管网生成的过程,受血管生成促进因子和抑制因子的严格调控。通常,血管生成发生于胚胎和出生后早期血管的发育过程中,除女性生理周期和伤口愈合等过程外,在成年阶段血管生成已处于静息状态。但是,在发生某些疾病如肿瘤、糖尿病视网膜病变、心血管疾病及类风湿性关节炎[1-2]时,血管生成过程被异常激活。活化素受体样激酶1(activin receptor-like kinase 1,ALK1)是转化生长因子-β(transforming growth factor-β,TGF-β)/骨形态发生蛋白(bone morphogenetic proteins,BMPs)超家族I型受体,属于丝氨酸/苏氨酸激酶受体。研究表明,ALK1基因特异性地高表达于活化的血管内皮细胞,是血管发育及血管生成的重要调节因子。近年来随着对ALK1研究的不断深入,其在血管发育和病理性血管生成中的作用引起了科研人员的广泛关注,ALK1已成为血管生成相关性疾病研究的重要靶标。
1 ALK1的结构与表达
1.1ALK1的结构[3]编码人ALK1的基因ACVRL1定位于12q13.13,其cDNA长度约1 512 bp,由11个外显子组成。ALK1蛋白是一种存在于细胞膜上的跨膜丝氨酸/苏氨酸激酶受体,其前体由5个部分组成,包括氨基端(N端)信号肽、富含半胱氨酸的胞外结构域、近膜区富含甘氨酸/丝氨酸的胞内结构域、丝氨酸/苏氨酸激酶结构域及跨膜结构域,见图1。其中,N端信号肽在其加工成熟后被水解;富含半胱氨酸的胞外结构域负责与胞外配体结合;近膜区富含甘氨酸/丝氨酸的胞内结构域存在特征性的高度保守的TTSGSGSG基序,称为GS区域;TGF-β/BMPs超家族I型受体的丝氨酸/苏氨酸激酶结构域具有一个重要特点即具有由9个氨基酸形成的激酶域L45环。ALK1上的L45环、磷酸化GS序列和受体活性型Smad(receptor activated-drosophila mother against decapentaplegic protein,R-Smad)上的MH2结构域的L3环决定了ALK1和Smad结合的特异性。
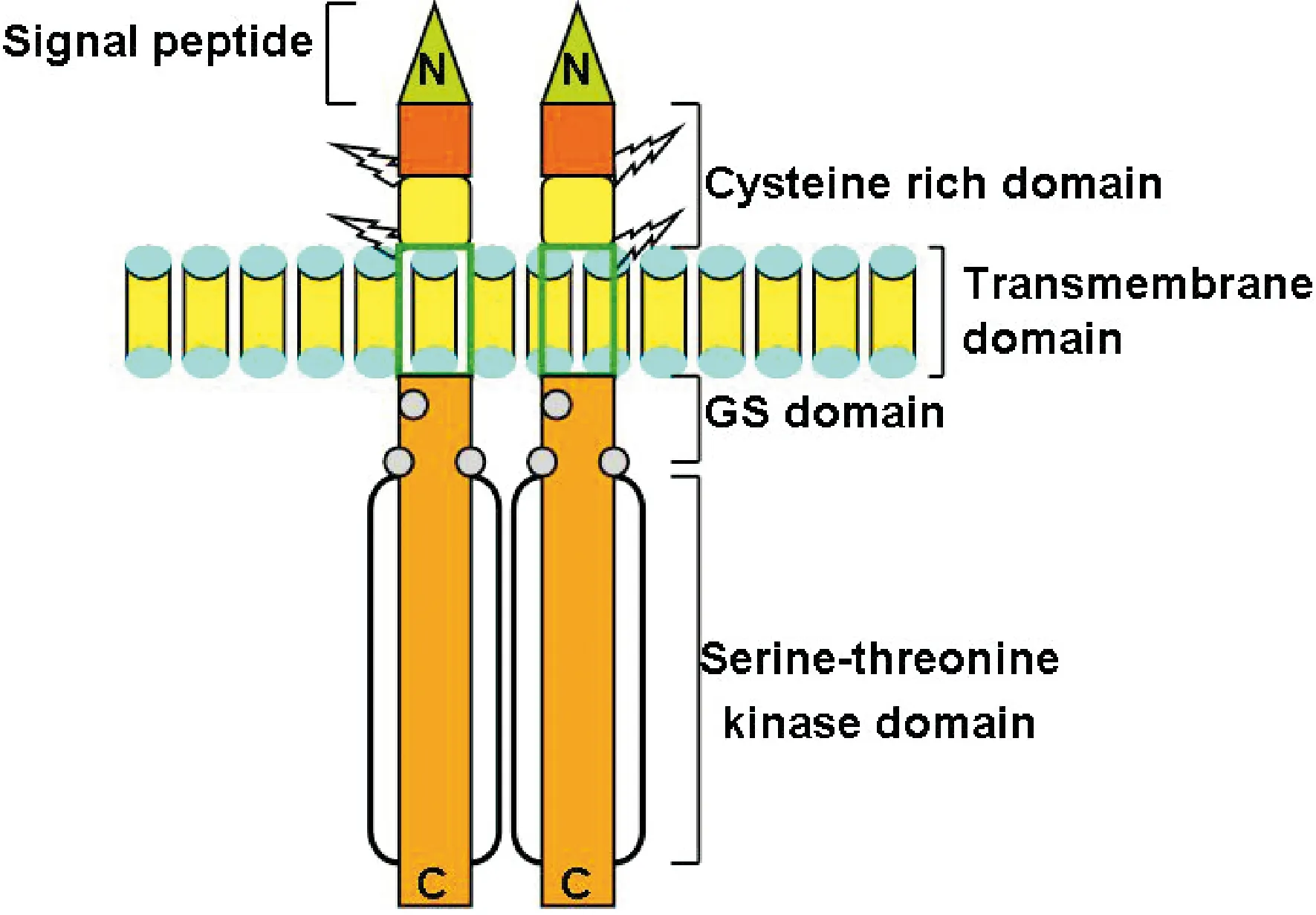
Figure 1. Structural diagram of activin receptor-like kinase 1 (modified from reference [3]).
图1活化素受体样激酶1的结构示意图
1.2ALK1的表达 最初ALK1被发现表达于受孕后6.5 d的小鼠胚胎,在受孕后7.5~8.5 d ALK1的表达达到峰值,而且ALK1的表达与血管发生的部位相重叠[4],提示ALK1的表达可能与血管发生有关。迄今已发现ALK1表达于多个物种的不同组织细胞。视网膜、骨髓、脾脏、肾脏和脑等多种组织均存在ALK1的表达。在大鼠,ALK1除在肺脏中表达丰度较高外,还表达于肾脏、大脑、心脏、肠道、胸腺、胃、脾脏及大鼠胚胎的尿生殖嵴等多个器官。在成人,ALK1表达于胎盘、脂肪组织、骨骼肌、肺和眼睛等组织中。除内皮细胞外,在单核细胞、软骨细胞、皮肤成纤维细胞、肝脏星形细胞、神经嵴干细胞、硬皮病成纤维细胞、成肌细胞和平滑肌细胞均有ALK1表达的报道[3]。
有研究认为ALK1的表达在胚胎发育时呈活跃状态,出生后血管ALK1的表达则受到抑制,但在某些疾病状态下ALK1的表达重新被激活,呈现异常表达。在一些纤维化疾病如硬皮病和肝纤维化中均发现存在ALK1蛋白的活化。Pannu等[5]发现ALK1下游转录因子p-Smad1过度表达于硬皮病病人的皮肤组织;Wiercinska等[6]报道ALK1下游靶分子分化抑制因子(inhibitor of differentiation,Id)1在大鼠肝星形细胞转分化中发挥关键性作用。许多肿瘤组织包括淋巴瘤、前列腺癌、皮肤癌、甲状腺癌、肾癌、卵巢癌、肺癌、胰腺癌和肝癌组织中均存在ALK1的高表达,且与肿瘤血管生成密切相关[7],表明ALK1介导的血管生成在肿瘤发生发展过程中起着重要作用。
2 ALK1信号通路
2.1BMP9/BMP10-ALK1信号通路 ALK1曾被认为是一种孤儿受体,但现已证实ALK1是TGF-β/BMPs 超家族I型受体,其上游至少包括4种配体,即TGF-β1、TGF-β3、BMP9和BMP10,其中BMP9和BMP10被认为是ALK1特异性高亲和力配体[8]。BMP9主要表达于肝脏,包括肝细胞、肝血窦内皮细胞、肝星状细胞和肝内胆管上皮细胞;BMP10主要局限于心房和心室的肌小梁,可能在胚胎心肌小梁的形成中具有重要作用。成体心脏中BMP10仍有高表达,但主要局限在右心房。小鼠BMP10的表达常常早于BMP9的表达,两者均存在于循环血液中。由于血浆BMP9敲除的小鼠不能活化BMP-Smad信号,故BMP9被认为是循环血液中具有生物学活性的BMP。
目前认为,BMP9/BMP10信号可通过靶细胞膜上特异的BMP I型受体(BMP type I receptor,BMPRI)和BMP II型受体(BMPRII)复合物激活下游Smad通路和非Smad通路,从而产生不同的生物学效应[9],见图2。大多数情况下,循环BMP9/BMP10结合内皮细胞膜上的BMPRII,招募并磷酸化BMPRI-ALK1,活化的ALK1磷酸化下游转录因子Smad1/5/8,活化的R-Smads与公共Smad(Smad4)形成二聚体复合物,转位至细胞核调节下游靶基因,如Id1、Id3、跨膜蛋白100(transmembrane protein 100,TMEM100)、EphrinB2、血管内皮生长因子(vascular endothelial growth factor,VEGF)及发状分裂相关增强子(hairy and enhancer of split,HES)和HES相关YRPW基序(HES-related with YRPW motif,HEY)等的表达,而抑制性Smads包括Smad6和Smad7则可以阻断上述信号转导过程。BMP9/BMP10-ALK1信号也可以通过非Smad通路如有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)和蛋白激酶C(protein kinase C,PKC)通路来传递。此外,内皮中BMP9/BMP10-ALK1信号还受辅助性受体endoglin的调节。
2.2ALK1信号与ALK5信号之间的关系 在内皮细胞中,ALK1和ALK5同属TGF-β家族I型受体,协同调节血管生成。TGF-β结合并活化ALK5,磷酸化下游转录因子Smad2/3来调节血管生成;而ALK1主要受配体BMP9/BMP10调节,磷酸化Smad1/5。有研究认为ALK1信号与ALK5信号之间存在相互作用[10]。首先,ALK1的激活往往需要ALK5的作用,同时活化的ALK1也是ALK5表达所必需;其次,TGF-β1能活化ALK1,进而抑制ALK5及其下游Smad2/3的活化。因此,ALK1和ALK5以TGF-β1作为直接的共同配体,可能是一个平衡的整体,彼此相互拮抗,相互补充,从而使得TGF-β1在功能上往往表现出不同的倾向,抑制或促进内皮细胞增殖和迁移,这可能也是TGF-β因子功能呈双向性的原因之一。最近有研究发现,Smad转录共抑制因子Ski相关新颖N蛋白(Ski-related novel protein N,SnoN)是连接ALK1信号与ALK5信号的核心因子[11],一方面,SnoN通过与Smad2/3结合并抑制其活化而负向调控ALK5信号;另一方面,SnoN能直接结合质膜上的ALK1,促进Smad1/5活化。然而,有研究小组对ALK1信号依赖于ALK5信号的观点持有异议[12-13]。Shao等[12]研究证实抑制牛大动脉内皮细胞ALK5并不会妨碍BMP9/ALK1诱导的Smad1/5/8磷酸化。特异性敲除小鼠内皮ALK5并不会导致血管畸形,类似现象也存在于斑马鱼模型中。另外,有研究者发现ALK5在内皮细胞的表达水平很低,主要表达于血管周细胞,以一种旁分泌的方式来调节血管生成。因此,从目前研究来看,虽然ALK5信号与血管的稳态相关,但ALK1信号是否依赖于ALK5信号,其与ALK5在内皮细胞中确切的关系仍需进一步明确。
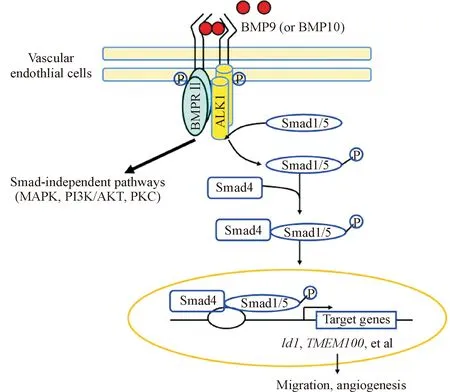
Figure 2. BMP9/BMP10-ALK1 signaling pathway.
图2BMP9/BMP10-ALK1信号通路
2.3ALK1信号与VEGF信号之间的关系 VEGF是一种特异性地作用于血管内皮细胞的多功能生长因子,是重要的促进血管生成的信号分子。目前研究认为,VEGF信号与ALK1信号分别在血管生成的不同阶段发挥作用。VEGF信号主要在血管生成的初始阶段起作用,参与促进内皮细胞的增殖与迁移、基底膜的重塑和血管的出芽;ALK1信号主要在血管的成熟与稳定期起作用。体外研究发现,ALK1信号活化能抑制VEGF诱导的血管出芽[14]。另有研究发现,VEGF信号缺失能减轻因ALK1基因敲除导致的小鼠脑血管异常及II型遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia,HHT2)病人的出血[15-16]。VEGF信号与ALK1信号协同调节血管生成的现象亦存在于肿瘤血管生成过程中。在黑色素瘤模型中,靶向ALK1的治疗能降低肿瘤微血管密度,延缓肿瘤的生长,提高VEGF受体贝伐单抗的治疗效果。同样,在VEGF受体单抗药物耐药的肾细胞癌小鼠移植瘤模型中,VEGF受体抑制剂联用ALK1抑制剂能明显抑制促血管相关分子的表达,延长小鼠的生存期。这些研究提示,在抗血管生成方面,ALK1信号与VEGF信号存在互补关系,同时靶向ALK1和VEGF两条通路抑制血管生成可能是治疗血管生成异常相关性疾病的重要策略。
2.4ALK1信号与Notch信号之间的关系 Notch是一个高度保守的跨膜受体蛋白家族,通过细胞表面Notch受体与其配体Delta样配体 (Delta-like ligand,DLL)和Jagged配体介导细胞-细胞之间的直接接触而传递信号,在血管发育及血管生成中具有重要作用。通常,Notch信号通过调节内皮端-柄细胞表型间的平衡来影响出芽式血管新生。新近研究发现,ALK1信号与Notch信号之间存在交互作用。体外实验观察到BMP9诱导人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)Smad1/5/8磷酸化的同时,还能上调Notch下游转录因子HEY1、HEY2、HES1及其配体JAG1的表达,从而影响血管出芽时端细胞和柄细胞分化[17]。而且有研究证实Smad1/5与HEY1、HEY2和Jagged1启动子有着直接的结合,且活化的Smads与Notch胞内结构域之间存在直接的相互作用[18]。另有研究发现ALK1信号下游靶蛋白Id与Notch信号下游靶蛋白HES之间也存在相互作用。Id与HES1相互作用能解除HES1的自身负反馈调节,促进HES1表达的上调,而HEY2能竞争性抑制HES1-Id的结合[19]。近年来Aspalter等[20]研究发现,neuropilin-1(Nrp1)是连接Notch信号与ALK1信号的轴心,Notch活化能下调Nrp1表达,分别通过ALK1和ALK5活化Smad1/5/8 和Smad2/3,调节端-柄细胞的分化,促进血管出芽。但也有人在斑马鱼模型研究中发现,ALK1和Notch对HEY2和DLL4的调节起着相反的作用,同时ALK1突变所致的动静脉血管畸形并不受Notch信号活化或抑制的影响。这些研究表明,ALK1信号与Notch信号之间存在着更为复杂的关系,这种关系可能是环境依赖性和基因依赖性的。
3 ALK1信号在血管发育中的研究
可以肯定的是,ALK1在胚胎及出生后早期的血管发育中起着关键性作用[21]。在小鼠,不仅发现胎鼠ALK1基因的表达部位与血管发生和血管化部位相重叠,而且ALK1基因敲除的小鼠均可出现严重的血管发育异常,包括动静脉畸形、血管过度扩张和血管平滑肌细胞分化和募集障碍。在胚胎发育晚期敲除内皮细胞ALK1基因,新生小鼠出现全身性的动静脉短路及广泛的动静脉分流。ALK1基因突变的人常常发生HHT2[22]。另外,ALK1影响血管发育的现象在斑马鱼模型中也观察到。ALK1基因即斑马鱼violet beauregarde(vbg)基因突变能导致斑马鱼出现血管过度扩张及形成异常的血流循环[23]。这些研究表明ALK1调节血管发育的功能在进化上是高度保守的,ALK1是血管发育所必需的。
尽管体内实验结果表明ALK1在血管发育中具有重要作用,但ALK1对血管内皮细胞的确切作用仍存在争议。有研究认为,ALK1信号活化可抑制多种内皮细胞的增殖、迁移和黏附过程,负向调节血管生成,可能主要在血管生成的成熟期起作用[24]。另有相反的研究结果,认为ALK1激活可促进内皮细胞的增殖、迁移和管腔形成。还有研究者认为,ALK1并不影响内皮细胞的增殖和迁移,仅影响VEGF诱导的内皮细胞出芽。造成ALK1对内皮细胞功能调节的差异可能与ALK1信号激活的方式、药物的剂量、细胞类型及细胞培养环境等有关。
4 ALK1在血管生成相关性疾病中的研究
4.1ALK1在心血管疾病中的研究 遗传学证据显示,BMP9/BMP10-ALK1信号通路与2种血管发育异常疾病,即肺动脉高压(pulmonary arterial hypertension,PAH)和HHT2直接相关。PAH是一种以肺动脉狭窄和右心功能障碍为特征的血管性疾病。除BMPRII和Smad8突变与PAH有关外,ALK1基因突变也是造成PAH的重要原因[25-26]。最近发现一个5岁的PAH患者存在BMP9纯合子无义突变[27]。在大鼠PAH模型中证实体内注射BMP9可以预防或逆转肺动脉高压,提示BMP9可能成为临床PAH患者治疗的靶标。HHT2是一种常染色体显性遗传性血管发育异常疾病,也称为Osler-Rendu-Weber综合征,主要表现为全身毛细血管异常扩张,动静脉畸形。目前认为,ALK1杂合子功能缺失突变是导致HHT2的主要原因,而其辅助性受体endoglin突变则是导致HHT1的主要原因。
4.2ALK1在肿瘤血管生成中的研究 尽管ALK1在血管发育中起着关键性作用,但BMP9/BMP10-ALK1信号在肿瘤血管生成中的作用仍存在争议,其确切作用可能是环境依赖性的。有研究报道BMP9在卵巢癌和肝癌细胞中表达增强[28],而BMP9和BMP10在乳腺癌组织中表达却下降[29]。尽管如此,抗BMP9/BMP10-ALK1的策略仍广泛用于抗肿瘤研究领域,并且已取得令人可喜的成果。目前用于抗肿瘤治疗的ALK1抑制剂主要有两类,一类是可溶性重组ALK1融合蛋白dalantercept[30],另一类是靶向ALK1胞外结构域的抗体PF-03446962[31]。理论上来说,这2类抑制ALK1信号的药物会产生不同的后果。因为delantercept只阻断高亲和力配体BMP9/BMP10与ALK1的直接结合,不影响ALK1与其它配体如TGF-β的结合;而PF-03446962是受体ALK1特异性抗体,能阻断所有ALK1配体与之结合,包括BMP9/BMP10和TGF-β。
现有研究显示,PF-03446962和dalantercept在体外实验和啮齿类动物的临床前试验中具有良好的抗肿瘤血管生成作用[32]。例如,PF-03446962不仅能抑制血清诱导的Smad1磷酸化,而且还能降低HUVECs的迁移、管型形成和内皮出芽[33],甚至在某些对VEGF抑制剂具有耐药性的肿瘤,PF-03446962治疗后亦显示出明显的抑制肿瘤血管生成及减轻肿瘤负荷的作用[34]。Dalantercept能减轻人肾细胞癌小鼠移植肿瘤血管的过度扩张,增加肿瘤细胞的缺氧,诱导肿瘤细胞的坏死,延缓肿瘤生长[35]。但是,在一项包括黑色素瘤、乳腺癌和头颈肿瘤的3种不同肿瘤的研究中发现,dalantercept单一治疗并不能使肿瘤变小[36]。在临床试验中dalantercept显示出有别于抗VEGF治疗的不良反应,且其不良反应能被病人更好地耐受[37],表明ALK1与VEGF通过不同的机制发挥抗瘤作用。最近,dalantercept或PF-03446962单一治疗已用于包括头颈鳞癌、子宫内膜癌、卵巢癌、泌尿上皮癌、肝癌和胸膜间皮瘤等恶性肿瘤的临床II期试验中。一些已完成的临床II期研究结果显示,靶向ALK1的这2种抑制剂单一治疗对复发或转移性头颈鳞癌和子宫内膜癌有着较好的安全性,但并未达到预期的疗效[38-39],提示靶向ALK1的抗肿瘤治疗联合其它肿瘤靶向药物仍然是未来靶向ALK1的抗肿瘤治疗的方向。
5 展望
ALK1已成为治疗血管生成异常性疾病的新靶点,与其相关的抑制剂正用于不同肿瘤患者的临床I期和II期研究中。从公开报道的临床I期和II期研究结果可以看出:ALK1抑制剂用于肿瘤患者具有较好的安全性,副作用小,但单一治疗的有效性在某些患者中并不理想。鉴于ALK1信号与诸多血管生成信号之间存在相互作用,ALK1抑制剂联合其它靶向血管生成的药物应用于血管生成异常性疾病如肿瘤、糖尿病视网膜病变和类风湿性关节炎等的治疗以及阐明ALK1信号与其它血管生成信号之间的关系将是未来研究的方向。
[参 考 文 献]
[1] 唐琼兰, 陈 瑞, 刘卫平, 等. HIF-1α在结外鼻型NK/T细胞淋巴瘤血管生成中的作用及意义[J]. 中国病理生理杂志, 2011, 27(3):518-522.
[2] 查丁胜, 吴 昊, 林宏生, 等. S100A4在类风湿关节炎滑膜中的表达及其对成纤维样滑膜细胞分泌VEGF促进血管生成的影响[J]. 中国病理生理杂志, 2017, 33(6):1119-1124.
[4] Roelen BA, van Rooijen MA, Mummery CL. Expression of ALK-1, a type 1 serine/threonine kinase receptor, coincides with sites of vasculogenesis and angiogenesis in early mouse development[J]. Dev Dyn, 1997, 209(4):418-430.
[5] Pannu J, Nakerakanti S, Smith E, et al. Transforming growth factor-β receptor type I-dependent fibrogenic gene program is mediated via activation of Smad1 and ERK1/2 pathways[J]. J Biol Chem, 2007, 282(14):10405-10413.
[6] Wiercinska E, Wickert L, Denecke B, et al. Id1 is a critical mediator in TGF-beta-induced transdifferentiation of rat hepatic stellate cells[J]. Hepatology (Baltimore, Md), 2006, 43(5):1032-1041.
[7] Hawinkels LJ, Garcia de Vinuesa A, Ten Dijke P. Activin receptor-like kinase 1 as a target for anti-angiogenesis therapy [J]. Expert Opin Investig Drugs, 2013, 22(11):1371-1383.
[8] Chen H, Brady Ridgway J, Sai T, et al. Context-dependent signaling defines roles of BMP9 and BMP10 in embryonic and postnatal development [J]. Proc Natl Acad Sci U S A, 2013, 110(29):11887-11892.
[9] García de Vinuesa A, Abdelilah-Seyfried S, Knaus P, et al. BMP signaling in vascular biology and dysfunction [J]. Cytokine Growth Factor Rev, 2016, 27:65-79.
[10] Oh SP, Seki T, Goss KA, et al. Activin receptor-like kinase 1 modulates transforming growth factor-β 1 signaling in the regulation of angiogenesis [J]. Proc Natl Acad Sci U S A, 2000, 97(6):2626-2631.
[11] Zhu Q, Kim YH, Wang D, et al. SnoN facilitates ALK1-Smad1/5 signaling during embryonic angiogenesis[J]. J Cell Biol, 2013, 202(6):937-950.
[12] Shao ES, Lin L, Yao Y, et al. Expression of vascular endothelial growth factor is coordinately regulated by the activin-like kinase receptors 1 and 5 in endothelial cells[J]. Blood, 2009, 114(10):2197-2206.
[13] Park SO, Lee YJ, Seki T, et al. ALK5-and TGFBR2-independent role of ALK1 in the pathogenesis of hereditary hemorrhagic telangiectasia type 2[J]. Blood, 2008, 111(2):633-642.
[14] Scharpfenecker M, van Dinther M, Liu Z, et al. BMP-9 signals via ALK1 and inhibits bFGF-induced endothelial cell proliferation and VEGF-stimulated angiogenesis[J]. J Cell Sci, 2007, 120(Pt 6):964-972.
[15] Hao Q, Zhu Y, Su H, et al. VEGF induces more severe cerebrovascular dysplasia in endoglin than in Alk1 mice[J]. Transl Stroke Res, 2010, 1(3): 197-201.
[16] Ardelean DS, Letarte M. Anti-angiogenic therapeutic strategies in hereditary hemorrhagic telangiectasia[J]. Front Genet, 2015, 6:35-41.
[17] Larrivée B, Prahst C, Gordon E, et al. ALK1 signaling inhibits angiogenesis by cooperating with the Notch pathway[J]. Dev Cell, 2012, 22(3):489-500.
[18] Kerr G, Sheldon H, Chaikuad A, et al. A small molecule targeting ALK1 prevents Notch cooperativity and inhibits functional angiogenesis[J]. Angiogenesis, 2015, 18(2):209-217.
[19] Itoh F, Itoh S, Goumans MJ, et al. Synergy and antagonism between Notch and BMP receptor signaling pathways in endothelial cells[J]. EMBO J, 2004, 23(3): 541-551.
[20] Aspalter IM, Gordon E, Dubrac A. Alk1 and Alk5 inhibition by Nrp1 controls vascular sprouting downstream of Notch[J]. Nat Commun, 2015, 6:7264-7276.
[21] Jonker L. TGF-β & BMP receptors endoglin and ALK1: overview of their functional role and status as antiangiogenic targets[J]. Microcirculation, 2014, 21(2):93-103.
[22] Johnson DW, Berg JN, Baldwin MA, et al. Mutations in the activin receptor-like kinase 1 gene in hereditaryhaemorrhagic telangiectasia type 2[J]. Nat Genet, 1996, 13:189-195.
[23] Morrell NW, Bloch DB, Ten Dijke P, et al. Targeting BMP signalling in cardiovascular disease and anaemia[J]. Nat Rev Cardiol, 2016, 13(2):106-120.
[24] Lamouille S, Mallet C, Feige JJ, et al. Activin receptor-like kinase 1 is implicated in the maturation phase of angiogenesis[J]. Blood, 2002, 100(13): 4495-4501.
[25] Ormiston L, Upton PD, Li W, et al. The promise of recombinant BMP ligands and other approaches targeting BMPR-II in the treatment of pulmonary arterial hypertension[J]. Glob Cardiol Sci Pract, 2015, 2015(4):47-61.
[26] Harrison RE, Flanagan JA, Sankelo M, et al. Molecular and functional analysis identifies ALK-1 as the predominant cause of pulmonary hypertension related to hereditary haemorrhagic telangiectasia[J]. J Med Genet, 2003, 40(12): 865-871.
[27] Wang G, Fan R, Ji R, et al. Novel homozygous BMP9 nonsense mutation causes pulmonary arterial hypertension: a case report[J]. BMC Pulm Med, 2016, 16:17-20.
[28] Herrera B, Garcia-Alvaro M, Cruz S, et al. BMP9 is a proliferative and survival factor for human hepatocellular carcinoma cells[J]. PLoS One, 2013, 8(7): e69535.
[29] Ye L, Bokobza S, Li J, et al. Bone morphogenetic protein-10 (BMP-10) inhibits aggressiveness of breast cancer cells and correlates with poor prognosis in breast cancer[J]. Cancer Sci, 2010, 101(10):2137-2144.
[30] Bendell JC, Gordon MS, Hurwitz HI, et al. Safety, pharmacokinetics, pharmacodynamics, and antitumor activity of dalantercept, an activin receptor-like kinase-1 ligand trap, in patients with advanced cancer[J]. Clin cancer Res, 2014, 20(2):480-489.
[31] Goff LW, Cohen RB, Berlin JD, et al. A phase I study of the anti-activin receptor-like kinase 1 (ALK-1) monoclonal antibody PF-03446962 in patients with advanced solid tumors[J]. Clin Cancer Res, 2016, 22(9):2146-2154.
[32] de Vinuesa AG, Bocci M, Pietras K, et al. Targeting tumour vasculature by inhibiting activin receptor-like kinase (ALK)1 function[J]. Biochem Soc Trans, 2016, 44(4):1142-1149.
[33] van Meeteren LA, Thorikay M, Bergqvist S, et al. Anti-human activin receptor-like kinase 1 (ALK1) antibody attenuates bone morphogenetic protein 9 (BMP9)-induced ALK1 signaling and interferes with endothelial cell sprouting[J]. J Biol Chem, 2012, 287(22):18551-18561.
[34] Hu-Lowe DD, Chen E, Zhang L, et al. Targeting activin receptor-like kinase 1 inhibits angiogenesis and tumorigenesis through a mechanism of action complementary to anti-VEGF therapies[J]. Cancer Res, 2011, 71(4):1362-1373.
[35] Wang X, Solban N, Khanna P, et al. Inhibition of ALK1 signaling with dalantercept combined with VEGFR TKI leads to tumor stasis in renal cell carcinoma[J]. Oncotarget, 2016, 7(27):41857-41869.
[36] Hawinkels LJ, de Vinuesa AG, Paauwe M, et al. Activin receptor-like kinase 1 ligand trap reduces microvascular density and improves chemotherapy efficiency to various solid tumors[J]. Clin Cancer Res, 2016, 22(1):96-106.
[37] Voss MH, Bhatt S, Plimack ER, et al. The DART study: results from the dose-escalation and expansion cohorts evaluating the combination of Dalantercept plus axitinib in advanced renal cell carcinoma[J]. Clin Cancer Res, 2017, 23(14):3557-3565.
[38] Makker V, Filiaci VL, Chen LM, et al. Phase II evaluation of dalantercept, a soluble recombinant activin receptor-like kinase 1 (ALK1) receptor fusion protein, for the treatment of recurrent or persistent endometrial cancer: an NRG Oncology/Gynecologic Oncology Group Study 0229N[J]. Gynecol Oncol, 2015, 138(1):24-29.
[39] Jimeno A, Posner MR, Wirth LJ, et al. A phase 2 study of dalantercept, an activin receptor-like kinase-1 ligand trap, in patients with recurrent or metastatic squamous cell carcinoma of the head and neck[J]. Cancer, 2016, 122(23): 3641-3649.
