空肠弯曲菌脂多糖对大鼠脊髓髓鞘损伤的实验研究
2018-06-21,,,,
,,,,
空肠弯曲菌(Campylobacterjejuni,Cj)是常见的人兽共患细菌性肠道病原菌,临床约90%的急性细菌性肠炎均与该菌相关。同时,Cj感染是导致格兰-巴利综合征(Guillain-Barré syndrome,GBS)的主要病因之一。大量的临床和动物实验研究证实,Cj感染后血清中出现被激发抗GM1和抗GDla等抗神经节苷脂自身抗体,从而导致周围神经损伤,认为自身免疫性炎症是GBS病变机制之一[1]。目前尚不清楚空肠弯曲菌脂多糖(Cj-LPS)是否会引起髓鞘损伤。本研究中,我们分别用Cj-LPS和特异性LPS抗体免疫大鼠,观察大鼠脊髓形态学变化,神经营养因子-3(NT-3)及其受体TrkC和神经生长抑制因子NogoA及其受体NgR mRNA的表达,探讨Cj-LPS对大鼠脊髓髓鞘损伤的影响。
1 材料与方法
1.1实验动物及分组 60只SPF级雄性Wistar大鼠,体重200~300 g,由浙江大学实验动物中心提供,许可证号:SYXK(浙)2012-0178。将大鼠随机分为对照组(NC组),脂多糖组(Cj-LPS组),及LPS抗体组(Anti-LPS组)。每组各20只大鼠。
1.2Cj-LPS,抗LPS试剂的制备及动物免疫 Pennor O∶19型空肠弯曲菌菌种购于美国菌种保藏中心(ATCC),厌氧培养。使用Westphal热酚水法提取LPS,其纯度通过考马斯亮蓝染色鉴定达到99%。通过亲和层析法制备LPS抗体。称取2 g环氧树脂活化的琼脂糖凝胶6B和8 mg LPS填充制备层析柱,将硫酸铵处理的Cj特异性免疫血清上柱层析,收集洗脱液并立即透析,浓缩储存待用。
Cj-LPS组以LPS、完全弗氏佐剂、生理盐水溶液混匀充分乳化后,腹股沟、背部皮下多点注射。对照组以等容的完全弗氏佐剂、生理盐水和生理盐水皮下注射。分别在初次免疫后1周、2周时,同样方法加强免疫。LPS抗体组分别于实验2、3周,取大鼠特异性抗CjLPS IgG加等量不完全弗氏佐剂,乳化后,于小脑延髓池注射。
1.3样品采集 随机抽取每组大鼠中的10只,在第4周即免疫诱导后的急性期进行处死,另外10只则在第6周通过腹腔注射水合氯醛进行麻醉,打开胸腔暴露心脏,由左心室插入导管致主动脉,快速注入200 mL生理盐水,然后缓慢注入200 mL多聚甲醛(40 g/L)。之后取脊髓组织,固定,常规脱水,石蜡包埋切片。进行苏木精-伊红(HE)染色并在光学显微镜下观察其组织形态变化。
1.4实时定量PCR 根据标准程序进行RNA提取及cDNA合成(表1)。如文献[2]所述进行定量逆转录-聚合酶链反应(qRT-PCR)来检测分析NT-3/TrkC和NogoA/NgR mRNA的表达。
使用RNA提取试剂盒从大鼠脊髓中提取总RNA,并通过市售试剂盒逆转录生成cDNA,操作方法遵循试剂盒说明书(北京天根生化科技限公司)。使用ABI 7300 PCR仪(美国Applied Biosystems)及SYBR Green PCR Master Mix(北京天根生化科技限公司)进行qRT-PCR测定。20 μL实时反应混合液中含有:实时PCR SYBR混合液(2×)10 μL,上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,模板0.5 μL,以及DEPC水。反应条件如下:NT-3/TrkC:95 ℃初始变性10 min;95 ℃变性15 s,60 ℃退火60 s,每两个循环降温1 ℃,共40个循环,然后72 ℃延伸10 min,最后4 ℃保存。NogoA/NgR:95 ℃初始变性5 min;95 ℃变性30 s,56 ℃退火10 s,72 ℃延伸10 s,共40循环;然后4 ℃保存。使用△△Ct分析法对数据进行分析。使用delta循环时间法进行定量分析。使用比较(2-△△Ct)法对每个样品中的目标基因相对于β-actin基因进行标准化处理[3]。
表1 qRT-PCR引物序列
Tab.1 Primer sequences used for qRT-PCR

基因引物序列产物大小/bpβ-actin上游5′CATCCGTAAAGACCTCTATGC-CAAC3′171下游5′ATGGAGCCACCGATCCACA3′NT-3上游5′CATGTCGACGTCCCTGGAA-AT-AG3′124下游5′GGATGCCACGGAGATAAG-CAA3′TrkC上游5′ATCACTGTGACCCACAAAC-CAGAG3′124下游5′ACCGGCGACCATACTTGTTGA3′NogoA上游5′CTTGGTCATGTGAACAGCA-CAATAA3′124下游5′CATTGAACAAGGCACCAAC-GTAA3′NgR上游5′TCCAGTCATGCCGAAATCT-CAC3′144下游5′TGGTAGGGTCCACGACATG-AAG3′
2 结 果
2.1大鼠脊髓HE染色结果 NC组大鼠脊髓无可见异常变化(图1A和D)。而Cj-LPS组则在第4周和第6周时发现病理变化,主要表现为小静脉及毛细血管周围不同程度的炎性细胞浸润,呈套袖状变化;并出现脱髓鞘改变,神经细胞核固缩、变性及坏死(图1B和E)。与Cj-LPS相比,LPS抗体组的病理变化有不同程度缓解,例如浸润细胞数量较少,套袖状变化程度较低,神经元损伤有所恢复(图1C和F)。
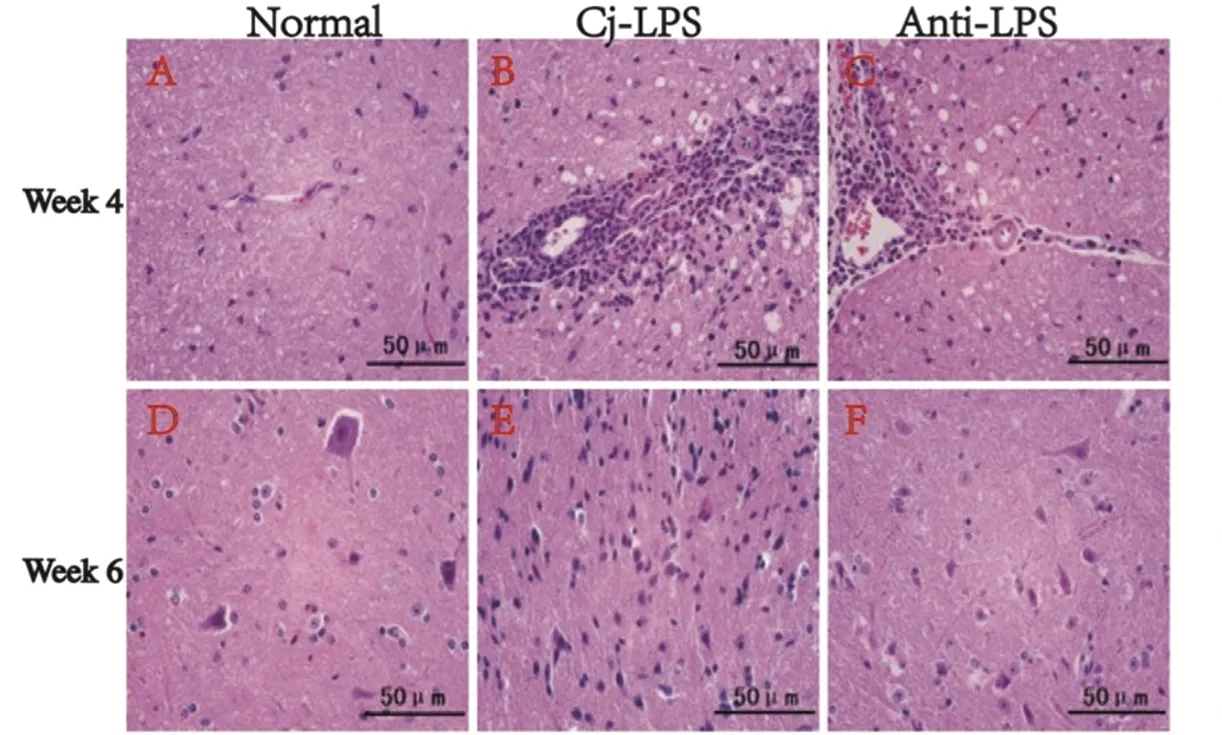
图1 大鼠脊髓组织病理学图(HE染色,×200)Fig.1 Histopathologic of the spinal cord in rats (HE staining, ×200)
2.2NT-3/TrkC mRNA的表达 与NC组相比,第4周时Cj-LPS组和Anti-LPS组NT-3 mRNA的表达均明显下调(P<0.01)。与Cj-LPS组比较,第4周时Anti-LPS组NT-3 mRNA的表达无统计学差异(P>0.05),但第6周时Anti-LPS组NT-3 mRNA的表达明显上调(P<0.05)(图2A)。
第4周及第6周时,Cj-LPS组大鼠脊髓TrkC mRNA的表达均低于NC组,有统计学差异(P<0.05),而第6周时Anti-LPS组TrkC mRNA的表达显著增加有统计学意义(P<0.01)(图2B)。

A:大鼠脊髓中NT3 mRNA的表达;B:大鼠脊髓中TrkC mRNA的表达。数据表示为与NC组比较。#P<0.05,##P<0.01,与Cj-LPS组比较。图2 第4周和6周时大鼠脊髓中NT-3 mRNA和TrkC mRNA的表达Fig.2 Expressions of NT-3 mRNA and TrkC mRNA in rat spina cord after 4 weeks and 6 weeks
2.3NogoA/NgR mRNA的表达 与NC组相比,Cj-LPS组大鼠脊髓NogoA mRNA的表达在第4周和第6周均有所增加。第6周时Anti-LPS组NogoA mRNA的表达则明显低于Cj-LPS组(图3A)。
与NC组相比,Cj-LPS组NgR mRNA的表达在第4周和第6周均有有统计学差异(P<0.01)。第6周时Anti-LPS组与NC组间NgR mRNA的表达也有统计学差异(P<0.01)。但第4周和第6周时,Cj-LPS组与Anti-LPS组间NgR mRNA的表达并无统计学差异(图3B)。

A:大鼠脊髓中NogoA mRNA的表达;B:大鼠脊髓中NgR mRNA的表达。数据表示为与NC组比较。#P<0.05,##P<0.01,与Cj-LPS组比较。图3 第4周和6周后大鼠脊髓中NogoA mRNA和NgR mRNA的表达(RT-PCR)Fig.3 Expressions of NogoA mRNA and NgR mRNA in rat spinal cord after 4 weeks and 6 weeks
3 讨 论
空肠弯曲菌的细胞壁主要由LPS组成,即多糖O抗原、核心多糖及类脂A,具有内毒素特性。多糖O抗原是空肠弯曲菌的主要表面抗原,国际上空肠弯曲菌penner血清学分型方法就是来源于此。研究发现,penner O∶19型空肠弯曲菌的LPS成分与人类周围神经的神经节苷脂间存在分子模拟现象,由各种类型的神经节苷脂抗体特异性地出现在相应的GBS亚型中[4]。
P2碱性蛋白为中枢和周围神经髓鞘的共有成分,用P2碱性蛋白免疫动物可同时诱发实验性变态反应性神经炎(EAN)和实验性变态反应性脑脊髓炎(EAE),有研究发现可能是针对P2碱性蛋白产生的自身免疫性T细胞和自身抗体会在周围神经和中枢神经系统均引起免疫应答,导致周围和中枢的共同脱髓鞘,并在局部产生细胞因子,破坏血脑屏障,引起脑水肿及脑脊髓损害[5]。本研究首先表明Cj-LPS可诱导实验大鼠脊髓的病理组织学变化,并发现抗LPS抗体可改善这一病理组织学变化。至今已有众多基础研究结果表明Cj-LPS是一种最常见的感染试剂,Cj-LPS也被归类为致神经病变试剂[6]。本研究中,我们检测了神经营养因子NT-3及其受体TrkC mRNA的表达及神经过度生长抑制因子NogoA/NgR mRNA的表达,发现Cj-LPS可降低NT-3/TrkC mRNA的表达并增加NogoA/NgR mRNA的表达。
神经营养因子(NTFs)和神经生长抑制剂都可影响神经再生。NTFs属于分泌性多肽生长因子家族,其具有神经系统的各种生理功能。它们可参与神经的可塑性调节及神经传递,促进受伤髓鞘的修复和再生,以此减轻脊髓损伤后的继发性损伤程度。NT-3在神经元髓鞘发育中起着非常重要的作用。NT-3可促进神经损伤之后髓鞘磷脂的分化和延伸,并在髓鞘生长中发挥引导性作用[7]。NT-3可与位于靶细胞表面并具有酪氨酸激酶活性高亲和力受体TrkC相结合,建立具有生物作用的信号转导途径[8]。我们的实验结果表明,Cj-LPS可降低NT-3/TrkC mRNA的表达,这一作用从第4周到第6周表现尤为显著,可见Cj-LPS诱导大鼠发生了不可逆髓鞘损伤。
NogoA是与髓鞘相关的神经突增生抑制剂,其家族包含3种亚型[9]。有研究表明,31%的感染性疾病归均由Cj-LPS所致,而它也可能是GBS的病因之一[10]。近一个世纪来学者们公认GBS与急性多发性神经炎相关。急性多发性神经炎是一种涉及外周神经和神经根的脱髓鞘病,具有小血管的炎性细胞浸润这种自身免疫性外周神经病变的病理特征之一。它被称为急性炎症性脱髓鞘性多发性神经病。通过文献检索我们发现NogoA与中枢神经系统自身免疫性脱髓鞘性疾病密切相关[11]。由NgR介导的信号转导取决于其与低亲和力神经生长因子受体p75NTR的关联,该受体p75NTR也是神经营养因子受体Trk家族的共受体。最近的研究表明,髓鞘相关糖蛋白(MAG)和髓鞘少突胶质细胞糖蛋白(OMgp)和Nogo-66一样,都可结合NgR并激活RhoA,通过p75NTR来转导神经突生长抑制信号[12]。通过中和抗NogoA抗体,使用NgR竞争性拮抗肽或截短的可溶性NgR,均可在体内阻断NgR与其受体之间的相互作用,因而诱导远距离轴突再生、补偿性生长、及上调生长相关基因;同时也可加强损伤后中枢神经系统功能的恢复[13]。
综上所述,我们发现Cj-LPS可减少神经营养因子的表达、增加神经抑制因子的表达,以此诱导髓鞘损伤;而特异性抗LPS抗体可改善脊髓髓鞘病理变化。
[1] Ogawa G, Kaida K, Kuwahara M, et al. An antibody to the GM1/GalNAc-GD1a complex correlates with development of pure motor Guillain-Barré syndrome with reversible conduction failure[J]. J Neuroimmunol, 2013, 254(1-2): 141-145. DOI: 10. 1016 / j. jneuroim. 2012. 09. 005
[2] Wang Y, Kilic E, Kilic U, et al. VEGF overexpression induces post-ischaemic neuroprotection, but facilitates haemodynamic steal phenomena[J]. Brain, 2005, 128 (Pt 1): 52-63. DOI: 10. 1093 / brain / awh325
[3] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2012, 25(4): 402-408. DOI: 10.1006 / meth. 2001. 1262
[4] Poropatich KO, Walker CL, Black RE. Quantifying the association betweenCampylobacterinfection and Guillain-Barré syndrome: a systematic review[J]. J Health Popul Nutr, 2010, 28(6): 545-552. DOI: 10. 3329 / jhpn. v28i6. 6602
[5] Brambilla R, Morton PD, Ashbaugh JJ, et al. Astrocytes play a key role in EAE pathophysiology by orchestrating in the CNS the inflammatory response of resident and peripheral immune cells and by suppressing remyelination[J]. Glia, 2014, 62(3): 452-467. DOI: 10. 1002 / glia. 22616
[6] Zhang M, Li Q, He L, et al. Association study between an outbreak of Guillain-Barre syndrome in Jilin, China, and precedingCampylobacterjejuniinfection[J]. Foodborne Pathog Dis, 2010, 7(7): 913-919. DOI: 10. 1089 / fpd. 2009. 0493
[7] Kamei N, Tanaka N, Oishi Y, et al. BDNF, NT-3, and NGF released from transplanted neural progenitor cells promote corticospinal axon growth in organotypic cocultures[J]. Spine, 2007, 32(12): 1272-1278. DOI: 10.1097 / BRS. 0b013e318059afab
[8] Duprey-Díaz MV, Blagburn JM, Blanco RE. Neurotrophin-3 and TrkC in the frog visual system: changes after axotomy[J]. Brain Res, 2003, 982(1): 54-63. DOI: 10. 1016 / S0006-8993 (03) 02948-2
[9] Chen MS, Huber AB, Haar ME, et al. Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1[J]. Nature, 2000, 403(6768): 434-439. DOI: 10. 1038 / 35000219
[10] Israeli E, Agmon-Levin N, Blank M,et al. Guillain-Barré Syndrome-a classical autoimmune disease triggered by infection or vaccination[J]. Clinical Rev Allergy Immunol, 2012, 42(2): 121-130. DOI: 10. 1007 / s12016-010-8213-3
[11] Mao YS, Lu CZ, Wang X, et al. Induction of experimental autoimmune encephalomyelitis in Lewis rats by a viral peptide with limited homology to myelin basic protein[J]. Exper Neurol, 2007, 206(2): 231-239. DOI: 10.1016 / j. expneurol. 2007. 04. 015
[12] Wang KC, Kim JA, Sivasankaran R, et al. p75 interacts with the Nogo receptor as a co-receptor for Nogo, MAG and OMgp[J]. Nature, 2002, 420(6911): 74-78. DOI: 10. 1038 / nature01176
[13] Fournier AE, Gould GC, Liu BP, et al. Truncated soluble Nogo receptor binds Nogo-66 and blocks inhibition of Axon growth by myelin[J]. J Neurosci, 2002, 22 (20): 8876-8883.
