30株水禽沙门菌的分离鉴定与血清型分析
2018-06-21,,,,,
,,,,,
水禽沙门氏菌病(Waterfowl Salmonellosis)是由沙门氏菌引起水禽以腹泻、生长受阻、生产性能下降、内脏器官(尤其是肝脏和脾脏)不同程度地变性与坏死等为主要临床特征的细菌性传染病。沙门菌为革兰氏阴性菌,依据沙门菌O抗原、H抗原和K抗原组成不同,可以将沙门菌分为不同的血清型,是肠杆菌科中引起胃肠炎、菌血症和肠外感染等急性或慢性疾病的人兽共患病重要病原菌之一[1-3]。随着养殖规模不断扩大,细菌性疾病发病率与死亡率呈上升趋势,沙门菌病是现今严重危害水禽的细菌病之一,主要危害3周龄以内的雏鹅,使之出现伤寒、副伤寒等急性或慢性败血性疾病,严重影响了我国水禽养殖业的发展[4]。畜禽呈现慢性感染时不易发现,使其常成为沙门菌的携带者,致使畜禽产品被污染,从而使得沙门菌通过动物产品进入食物链,最终导致人类感染沙门菌病,表现为急性肠胃炎,尤以鼠伤寒沙门菌感染为典型,常以腹泻、高热为主,脓血便多见[5]。本试验主要是对分离自水禽的30株沙门菌鉴定血清型,实时跟踪本区域患病水禽沙门菌的血清型分型及了解污染来源和危害评估,为水禽沙门菌病的防控提供一定的参考资料;并探讨禽源沙门菌、人源沙门菌及食源性沙门菌三者间血清型分布的相关性,为公共卫生安全提供帮助。
1 材料与方法
1.1 材料
1.1.1菌株来源 于2015 -2017年自佛山市及周边地区的30例疑似患病水禽中分离纯化所得。
1.1.2主要仪器 超净工作台,ZHJH-C1209C(苏净安泰空气技术有限公司);生化培养箱,SPX-250B-Z(上海博远实业有限公司医疗设备厂);电热恒温水槽,DK-8D型(上海一恒科技有限公司);T-cycles PCR仪、凝胶成像系统(Bio-Rad公司产品)。
1.1.3主要试剂原材料 丹麦SSI沙门菌诊断血清、丹麦SSI相诱导血清、软琼脂、科玛嘉显色培养基购自广州迪景生物有限公司;LB肉汤、RVS增菌肉汤、麦康凯培养基、XLD培养基、MH培养基、沙门菌生化鉴定盒购自广东环凯生物技术有限公司。
1.1.4引物设计与合成 根据GenBank的沙门菌ivnE基因序列,使用oligo 7.0软件设计引物,ivnE-F: 5′-TCGCACCGTCACGAAGGCCGTAGAGC-3′,ivnE-R:5′-GCATTATCGACGAGTACCAGCCGTCT-3′,预期片段大小为279 bp,由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1菌株的分离纯化 无菌条件下,挑取疑似感染沙门菌的患病水禽少许肝、胆、脾于RVS增殖肉汤中,37 ℃振荡培养12~24 h,以接种环取少许增菌液分别划线于麦康凯培养基、XLD培养基和显色培养基等选择或鉴别培养基,置于37 ℃的培养箱培养16~18 h,观察各培养基上菌落生长情况,钓取单个典型菌落作纯培养,待进一步鉴定。
1.2.2生化特性鉴定 将纯培养物用灭菌生理盐水制成0.5个麦氏比浊单位细菌悬液,接种于沙门氏菌生化鉴定盒,35 ℃培养 24~72 h,观察并记录结果。
1.2.3PCR鉴定 按照rTaq酶说明书对热裂解法制备的沙门菌总DNA进行ivnE基因的PCR扩增,扩增条件为:95 ℃预变性2 min;94 ℃变性30 s,58℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃再延伸10 min后4 ℃保存,同时设阴性对照。采用1.2%琼脂糖凝胶电泳检测扩增产物,在凝胶成像分析仪上观察电泳结果。
1.2.4血清型鉴定 根据丹麦国家血清研究院沙门菌血清分型方法,采用玻片凝集法鉴定水禽沙门菌血清型。根据考夫曼-坏特表(Kauffmann-White-scheme,简称K-W表)对测定的O抗原、H抗原结果确定具体的血清型[6]。
2 结 果
2.1细菌分离纯化 从30例疑似水禽沙门菌感染病例分离获得30株疑似沙门菌分离株;将30株疑似水禽沙门菌分离株的纯培养物,经过选择和鉴别培养,初步鉴定为沙门菌分离株。30株分离株的生化试验结果符合沙门菌的生化特性,其中鸭源沙门菌有7株分离株,鹅源有23株分离株,具体情况如表1。
表1 分离菌株情况
Tab.1 Thirty isolates of Salmonella
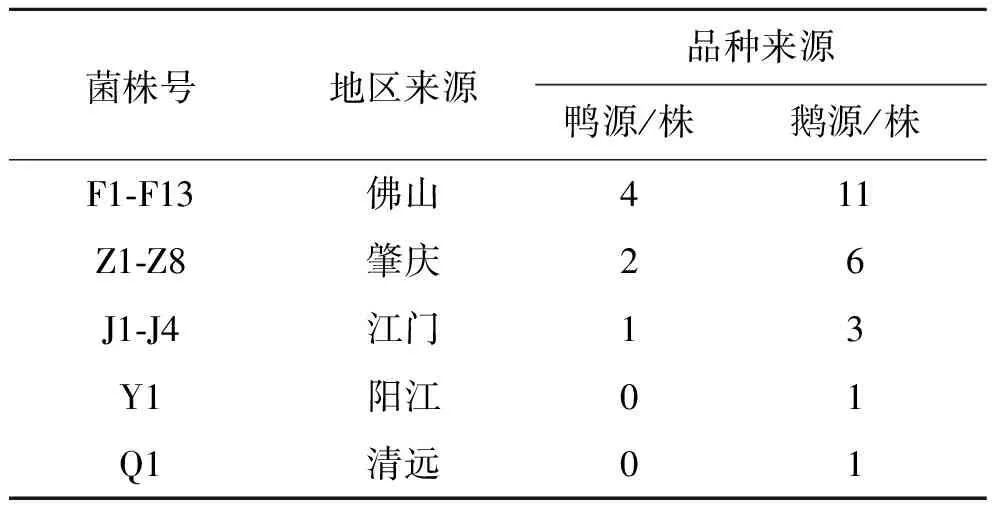
菌株号地区来源品种来源鸭源/株鹅源/株F1-F13佛山411Z1-Z8肇庆26J1-J4江门13Y1阳江01Q1清远01
2.2PCR鉴定 对30株分离菌株进行PCR特异基因的扩增,PCR产物经1.2%琼脂糖凝胶电泳分析,扩增目的条带大小与预期片段一致。部分菌株PCR扩增结果见图1。
2.3血清型鉴定结果 30株水禽沙门菌分离株的血清型分属B、D、C1、E14个群7种血清型,其中B群为优势血清群,包括19株鼠伤寒沙门菌、3株乙型副伤寒沙门菌、2株印第安纳沙门菌、1株斯坦利沙门菌;D群有肠炎沙门菌1株分离株;C1群有2株波茨坦沙门菌,E1群有2株明斯特沙门菌。结果见表 2。
表2 30株沙门菌的血清型分型情况
Tab.2 Serotype typing of 30 isolates of Salmonella

血清群名称血清型抗原式动物来源百分比(%)B鼠伤寒沙门菌S.Typhimurium1,4,[5],12∶i∶1,2鸭源5株,鹅源14株63.33乙型副伤寒沙门菌S.Paratyhi1,4,[5],12∶b∶1,2鹅源3株10.00印第安纳沙门菌S.Indiana1,4,12∶z∶1,7鹅源2株6.67斯坦利沙门菌S.Stanley1,4,[5],1,[27]∶d∶1,2鹅源1株3.33D肠炎沙门菌S.Enteritidis1,9,12∶g,m∶-鸭源1株3.33C1波茨坦沙门菌S.Potsdam6,7;14∶l,v∶e,n,z15鸭源1株,鹅源1株6.67E1明斯特沙门菌S.Muenster3,10,[15][15,34]∶e,h∶1,5鹅源2株6.67
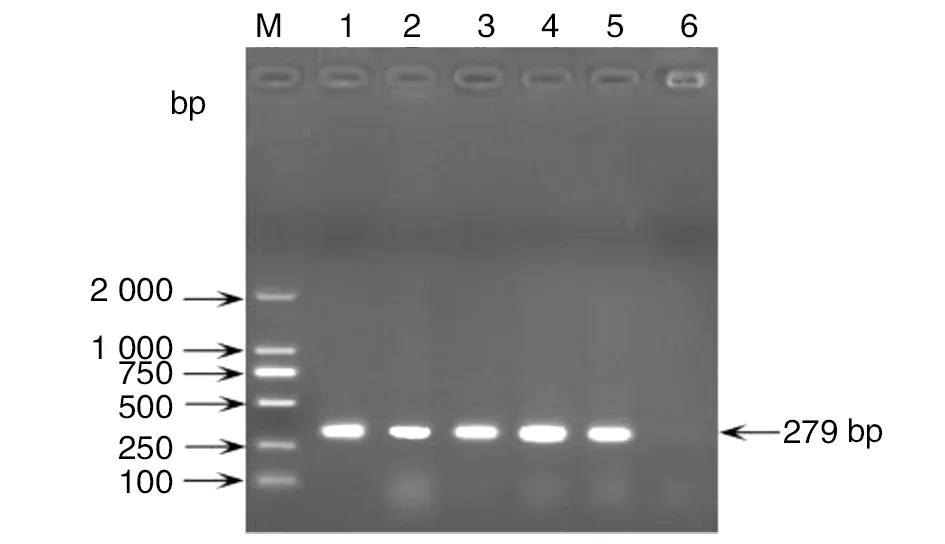
M:DL2000DNA Marker;1-4:待测菌株;5:阳性对照;6:阴性对照图1 部分沙门菌ivnE基因PCR扩增结果Fig.1 PCR amplification of invE gene from some Salmonella isolates
3 讨 论
沙门菌病是严重危害畜禽与公共卫生安全的细菌性疾病,血清型众多,其O抗原和H抗原种类多而复杂,且常常存在交叉凝集,鉴定其血清型时极易出错,因此沙门菌诊断血清的选用非常关键。通过比对国产与进口沙门菌诊断血清间的结果差异,丹麦 SSI对沙门菌的分型率准确性可达97%,优于国产血清[7],因此本试验选用特异、灵敏、简便的丹麦SSI沙门菌诊断血清。
本试验从30例水禽患病病例中均分离到沙门菌,患禽主要症状为精神沉郁、消瘦下痢、生产性能下降及内脏器官不同程度的变性坏死,部分患禽呈败血症死亡,具有较高的发病率与死亡率,严重制约水禽养殖业的发展。30株水禽沙门分离株均来自佛山及其周边城市,分离株以B群(83.33%)占优势,其次为E群(6.67%)和C1(6.67%)群,与佛山市48株食源性和人源沙门菌血清型分布研究中血清型以B群(食源性占21.7%、人源占40%)为主[8]的结果相一致,表明水禽源、食源性、人源沙门菌均存在B群沙门菌高比例感染的现象,三者之间是否存在传染源、传播途径等的相关关系,值得继续深入研究。
本试验中,鼠伤寒沙门菌(63.33%)为优势血清型,乙型副伤寒沙门菌(10.00%)、波茨坦沙门菌(6.67%)、明斯特沙门菌(6.67%)、印第安纳(6.67%)次之,肠炎沙门菌(3.33%)与斯坦利沙门菌(3.33%)少量存在。从中国各地区分离出的鸭源沙门菌中鼠伤寒沙门菌、肠炎型沙门菌分别占31.9 %和 61.8%[9];四川地区分离到鸭源鼠伤寒沙门菌和肠炎型沙门菌占37.5%和14.6%[10];华东地区禽源沙门菌以鸡白痢沙门菌为主,鼠伤寒沙门菌次之[11];表明禽源沙门菌优势血清型在不同地区有不同的比例差异。据调查,广州市2013 年腹泻病人中的沙门菌血清分型中,常见的沙门血清型以鼠伤寒沙门菌(42.6%)、肠炎沙门菌(15.8%)、斯坦利沙门菌(8.0%)为主[12];东莞地区2岁以下婴幼儿沙门菌感染血清型排名前三位的为鼠伤寒沙门菌、斯坦利沙门菌和肠炎沙门菌,共占68.7%[13];表明鼠伤寒沙门菌、肠炎沙门菌与斯坦利沙门菌血清型都属于引起人群感染率高的血清型,其比例与本研究的结果基本相同。大量数据表明,明斯特沙门菌、印第安纳沙门菌及波茨坦沙门菌在患病水禽中分离率极低,但佛山市食源性沙门菌血清型的研究中,明斯特沙门菌的感染率最高[8],并且在佛山市高明区农贸市场生禽肉中,印第安纳沙门菌与明斯特沙门菌的分离率排名前四[14],为禽源与食源性沙门菌在区域分布中建立了联系。
综上所述,本研究的沙门氏菌分离株血清型均在禽源、人源及食源样品上可分离得到,三者间的流行病学关系与血清型分布具有相关性,其中鼠伤寒沙门菌与肠炎沙门菌具有广泛感染的宿主谱,尤其鼠伤寒沙门致病性最强,能引起人和各种动物的沙门氏菌感染,具有重要的公共卫生学意义。
[1] 陈溥言.兽医传染病学[M].北京:中国农业出版社, 2006: 119-120.
[2] Severi E, Booth L, Johnson S, et al. Large outbreak ofSalmonellaEnteritidisPT8 in Ports-mouth, UK, associated with a restaurant[J]. Epidemiol Infect, 2012, 140(10): 1748-1756. DOI: 10.1017/S0950268811002615
[3] Voetsch AC, Van Gilder TJ, Angulo FJ, et al. FoodNet estimate of the burden of illness caused by nontyphoidalSalmonellainfections in the United States[J]. Clin Infect Dis, 2004, 38(3): S127-S134. DOI: 10.1086/381578
[4] Bucher O, Holley RA, Ahmed R. Occurrence and characterization ofSalmonellafrom chicken nuggets, strips, and pelleted broiler feed[J]. J Food Prot, 2007, 70(10): 2251-2258. DOI: 10.4315/0362-028X-70.10.2251
[5] 柴同杰,王海荣,林海,等.畜禽传染病病原在环境中的传播途径[J].畜牧与兽医, 2000, 32(S1): 121-125. DOI: 10.3969/j.issn.0529-5130.2000.z1.028
[6] Patrick AD. Grimont & Francois-Xavier Weill. Antigenic formulae of the salmonella serovars[M]. WHO Collaborating Centre for Reference and Research onSalmonella, 2007: 9.
[7] 许学斌,冉陆.沙门菌分型血清对比研究[J].检验医学,2010,25(1):21-25.DOI: 10.3969/j.issn.1673-8640.2010.01.011
[8] 陈耀能,梁景涛,陈爱贞,等.佛山市食源性和人源沙门氏菌血清型分布与耐药性研究[J].热带医学杂志, 2012,12(8): 955-958.
[9] 钟传德.我国部分省市雏鸭致病性沙门氏菌分离鉴定、耐药谱调查及携带质粒特性的初步研究[D]. 雅安:四川农业大学, 2006.
[10] 余晓龙.四川地区鸭源沙门氏菌分离与血清型分析及其药敏性与耐药基因相关性研究[D].雅安: 四川农业大学, 2012.
[11] 查华,石火英,吉贞颖,等.华东地区禽源沙门菌的分布及血清型分析[J].畜牧兽医学报, 2013, 44(2): 329-332.
[12] 黄冰,周勇,龙佳丽,等. 2013年广州市腹泻病人沙门菌血清分型及耐药性分析[J].热带医学杂志, 2015, 15(7): 975-977
[13] 修宁宁,潘俊均,邓沛汶,等.东莞地区2岁以下婴幼儿沙门菌感染血清型分布特征研究[J].国际检验医学杂志, 2017, 38(11): 1502-1504. DOI: 10.3969/j.issn.1673-4130.2017.11.022.
[14] 黄志广,莫嘉延,李凤贞.佛山市高明区农贸市场中食源性沙门氏菌血清型与耐药性现状[J].公共卫生与预防医学, 2012, 23(6): 6-9.
