人用狂犬病疫苗和被动免疫制剂研发进展
2018-06-21,
,
狂犬病是由狂犬病毒引起的人兽共患疾病(由动物传播到人类的疾病)。狂犬病毒感染家畜和野生动物,发病的动物通过咬伤或抓伤,将唾液中的病毒传播至人。除南极洲外,其他各洲都存在狂犬病,但95%以上的人类死亡病例发生在亚洲和非洲。欧美发达国家以野生动物狂犬病为主。近30年来我国狂犬病例发病数最低的一年是1996年(159例),此后逐年上升至2007年的3 300例,而后逐年下降,2015年病例数为801例[1]。我国计划于2025年消灭人狂犬病。目前,主动与被动免疫接种仍是控制狂犬病的最有效手段,本文就两类免疫制剂的研究现状与进展进行了综述。
1 狂犬病毒简介和狂犬病主动被动预防措施
狂犬病毒(Rabies virus, RV)属于弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus)。外形呈弹状,核衣壳呈螺旋对称,表面具有包膜,内含有单链RNA。
狂犬病毒含有5种主要蛋白(L、N、G、P和M),L蛋白(Large protein)具有转录作用;N蛋白(Nucleoprotein)是核衣壳蛋白,为组成病毒粒子的主要核蛋白,其包裹着狂犬病毒的RNA基因组;P蛋白(Phosphoprotein)和病毒复制、包装及逃逸机体免疫反应有关;G蛋白(Glycoprotein)是构成病毒表面刺突的糖蛋白,是狂犬病病毒与细胞受体结合的结构,在狂犬病毒致病与免疫中起着关键作用;M(Matrix protein)蛋白是病毒的基质蛋白。
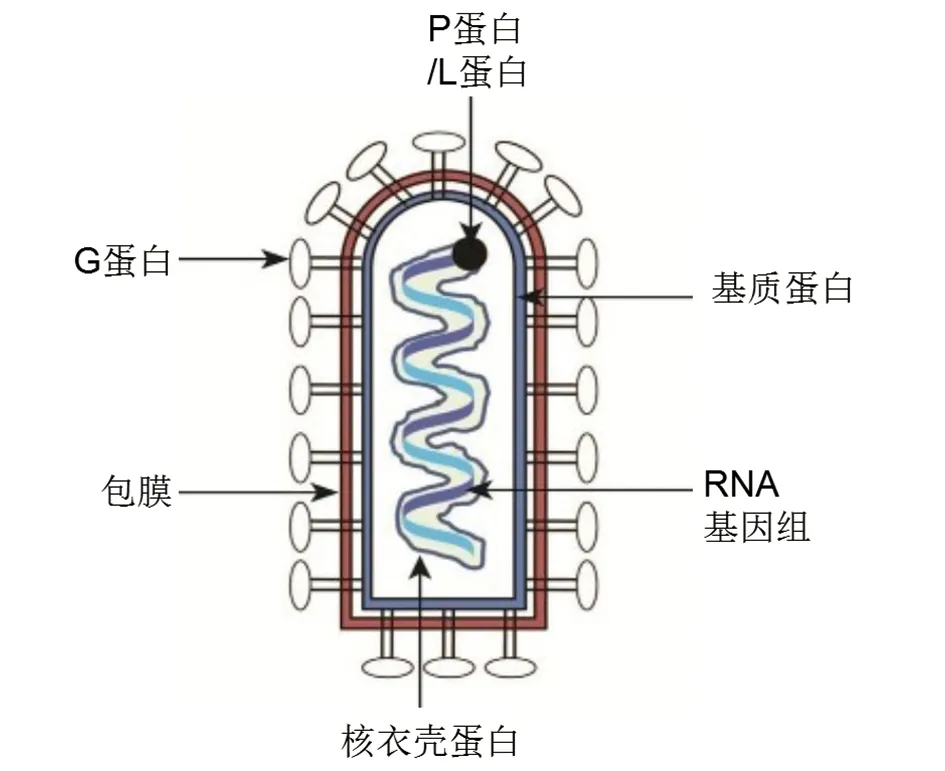
图1 狂犬病毒基本结构Fig.1 Structure of rabies virus
狂犬病毒暴露前可以预防性接种狂犬病疫苗,通过主动免疫机制刺激机体产生抗狂犬病毒抗体。狂犬病毒暴露等级根据世界卫生组织(World Health Organization, WHO) 动物接触分类标准可分为:Ⅰ类接触(触摸或饲养动物,或被动物舔舐完整的皮肤),Ⅱ类接触(造成轻微破损或无出血的轻微擦伤皮肤),Ⅲ类接触(穿透性的皮肤咬伤或抓伤,或粘膜污染)。
疑似狂犬病动物抓伤或咬伤(Ⅱ类和Ⅲ类接触)后的正确处理为:肥皂水彻底清洗伤口并及时注射狂犬病疫苗(Ⅱ类接触)或同时注射狂犬病疫苗和狂犬病免疫球蛋白(Ⅲ类接触)。
2 人用狂犬病疫苗现状和研发进展
狂犬病疫苗免疫后可以刺激机体产生抗病毒中和抗体,激活T淋巴辅助细胞及细胞毒性T细胞,保护动物免受病毒感染。我国每年接种1200-1500万剂次的狂犬病疫苗,为全世界接种狂犬病疫苗最多的国家。最早期的狂犬病疫苗是在动物的神经组织中生产,采用的是干燥法灭活病毒法。后来的Semple疫苗采用化学灭活法(酚灭活),需要连续接种14-21针[2]。虽然价格相对于细胞培养法生产的疫苗便宜,但接种次数太多且副作用大,WHO不推荐使用,我国已于1991年开始禁用神经组织疫苗。1955年左右开始由鸟类动物胚胎生产狂犬病疫苗(如鸭胚胎)。通过多轮的密度梯度离心去除非病毒脂质成分,并以β丙内酯灭活病毒。1967年开发了人类二倍体细胞(The human diploid cell vaccine, HDCV)。1970年代末开始又逐步开发了不同细胞培养系统生产的疫苗,如地鼠肾细胞、狗肾细胞、鸡胚细胞和Vero细胞等[3]。目前国内生产的疫苗主要来源于Vero细胞培养,其次为人二倍体细胞和地鼠肾细胞。
细胞中生产病毒的成本高,生产过程中有风险,贮存和运输需要低温。目前的狂犬病疫苗接种次数仍然偏多,尤其是对于暴露后的接种,需要尽可能少的接种次数且能充分诱导机体产生足量保护性抗体。基于减少狂犬病疫苗接种次数,价格及提高疫苗接种普及率和接种者依从性等方面的考虑,目前仍然有必要研发更为廉价、免疫原性更强和注射次数少的下一代狂犬病疫苗。
天然G蛋白在狂犬病毒包膜上为三聚体结构。G蛋白需要胞外区、跨膜区和胞内区同时表达方能形成具有正确空间结构的三聚体。正确折叠和糖基化修饰后,G蛋白具有充分的免疫原性,可诱发机体的体液免疫和细胞免疫。G蛋白也可以在感染细胞内表达并被转运至细胞膜上。有效的抗体不但可以中和并清除狂犬病毒,其还可以通过抗体依赖性细胞毒作用(antibody-dependent cellular cytotoxicity, ADCC)和补体依赖的细胞毒作用(complement-dependent cytotoxicity, CDC)清除被感染的细胞[4-5]。因此以G蛋白为抗原的疫苗是下一代疫苗研发的方向。但膜蛋白纯化困难,纯化过程中很难保持正确空间结构,一旦空间结构破坏即失去部分空间表位,免疫原性降低。

包括一个跨膜区,一个胞外区,一个胞内区,其中五个免疫原性区域(Ⅰ、Ⅱ、Ⅲ、Ⅳ和a)位于胞外区。图2 狂犬病毒G蛋白的结构示意图Fig.2 Structure of rabies virus glycoprotein (G protein)
以下几种系统曾经被尝试用于表达和纯化G蛋白。
2.1大肠杆菌表达系统 大肠杆菌表达系统技术成熟且重组蛋白产量高,但表达的G蛋白非可溶性,没有翻译后修饰如糖基化修饰。因此G蛋白不能正确折叠形成正确的空间结构,蛋白免疫原性差,不能作为抗原激发机体产生足够强度中和抗体[6]。
2.2直接从培养的狂犬病毒中纯化 狂犬病毒培养生产工艺繁琐,对生物安全要求高,相对于减毒疫苗和灭活疫苗多了一步G蛋白纯化步骤,大幅增加成本。尽管纯化的G蛋白具有较好的免疫原性,但因为成本过高而没有推广应用价值[7-8]。
2.3昆虫细胞表达系统 昆虫细胞Sf9表达的G蛋白会被分泌到细胞膜上,一般会形成正确的三维结构并具有类似的生物学活性。可能由于翻译后修饰机制不同,Sf9细胞表达的G蛋白分子量较哺乳动物细胞表达的小。通过将表达G蛋白的细胞或细胞裂解物作为免疫原免疫小鼠,可以产生中和抗体。但G蛋白纯化提取工作繁琐,成本高,限制了其推广应用[9-11]。黑腹果蝇S2细胞也被用来作为宿主细胞表达G蛋白,表达G蛋白的S2细胞裂解物免疫小鼠可以诱导产生保护性抗体[12]。有学者应用生物反应器培养S2细胞来表达G蛋白,并就生物反应器的S2细胞培养工艺进行了多方面优化,但依然面临免G蛋白的提取纯化问题,期待后续能够在蛋白提取工艺上有所突破[13-15]。
2.4酵母细胞表达系统 酵母细胞是一种经济高效的真核蛋白表达系统,可以成功实现胞内表达或分泌表达,成本低廉,培养条件要求不高,适宜工业放大。尽管酵母系统有以上诸多优点,但表达的G蛋白不能正确折叠,并有可能形成异常多聚体,此外酵母的高甘露糖糖基化修饰不利于G蛋白的稳定并对蛋白免疫原性有影响,动物实验显示酵母细胞表达的G蛋白能够在被免疫的小鼠中产生中和抗体,但仅仅能保护肌肉内注射的毒株攻击,不能保护大脑内注射的毒株攻击[16-17]。基于以上原因,酵母不适合作为G蛋白表达系统。
2.5转基因植物表达 在植物如西红柿中、烟叶和玉米中表达抗原蛋白具有生产成本低、物流成本低、给药方便等优势。植物中的G蛋白可经过进食在小鼠体内产生保护性免疫反应。植物表达系统的以下缺点限制了其大规模推广应用: 1)剂量不好衡量,尤其是对于暴露后的免疫; 2)烹饪方式差异、进食咀嚼方式差异、消化道微环境和pH值差异影响了抗原蛋白的降解和接触免疫系统的机会; 3)该类型抗原蛋白在人体中是否能够引起有效的免疫反应尚无实验结论[18-20]。
2.6哺乳动物细胞表达 哺乳动物细胞表达的G蛋白具有正确的翻译后修饰和折叠,免疫原性好。但G蛋白提取时常用的去污剂是Triton X-100,这会造成G蛋白变性。从细胞膜上提取G蛋白比从病毒中提取过程要繁琐许多。此外,和可溶性蛋白相比较,膜蛋白的产量低。有报道称在MDBK细胞中表达了可溶性的G蛋白的胞外区,但因为没有跨膜区域协助蛋白正确折叠,所表达的蛋白免疫原性弱,其表达的可溶性蛋白仅可用于诊断研究[21]。
悬浮培养的中国仓鼠卵巢细胞(Chinese hamster ovary cells, CHO)可达到很高的细胞密度(1-3×107/mL),培养体系可达到2 000-10 000 L,蛋白产量高,且翻译后修饰如糖基化类似于人体细胞,蛋白活性好,被广泛用于表达各种治疗性蛋白如单克隆抗体等。有研究采用CHO表达了可溶性的G蛋白胞外区,但仅表达可溶性的胞外区不能形成有强免疫原性的三聚体结构[22]。CHO细胞表达G蛋白目前主要用于G蛋白糖基化研究[23-26]。
除了利用上述不同系统表达和纯化G蛋白外,将G蛋白基因导入接种者体内使其在接种者体内表达G蛋白也是狂犬疫苗的一个发展方向。
2.7核酸疫苗
2.7.1DNA疫苗 将含有G蛋白基因的质粒DNA通过鼻腔灌注、肌肉注射、皮下注射及基因枪等途径导入实验动物细胞内,表达的G蛋白可在兔子、猫、狗、小鼠和猕猴体内诱导免疫反应,产生中和抗体[27-30]。
2.7.2RNA疫苗 用含有狂犬病毒G蛋白基因的RNA作为疫苗免疫小鼠,小鼠产生的体液免疫和细胞免疫反应类似于DNA疫苗[31]。
虽然核酸疫苗具有生产成本低、易于运输和保存等优点,但有整合入接种者基因组的风险(DNA疫苗)及产生免疫反应所需时间长、免疫反应较弱等缺点,不能用于狂犬病毒暴露后免疫,暴露前预防性接种的优势也不大,以上诸多原因限制了其应用。
2.8利用病毒载体在被免疫动物体内表达G蛋白 利用病毒载体在动物体内表达G蛋白以激发机体的细胞和体液免疫是具有前景的方法[32]。病毒载体疫苗已在欧美发达国家野生动物狂犬病控制中得到广泛应用且效果显著。病毒载体基因组中含有G蛋白基因,可在接种者体内表达G蛋白,但病毒载体疫苗的一个缺点是:接种者体内如业已存在抗病毒载体抗体会抑制病毒载体的感染复制和G蛋白抗原的表达。
2.8.1痘病毒载体(Poxvirus)疫苗 痘苗病毒(Vaccinia)是痘病毒的一种。减毒痘病毒狂犬病疫苗已经被欧洲和美国用于免疫动物如红狐狸、浣熊、郊狼、臭鼬等,有效地降低了狂犬病在上述野生动物中的发病率。减毒的痘苗病毒安卡拉株(Modified vaccinia virus Ankara, MVA)在大部分细胞中不能复制,人体对其免疫耐受性好于普通痘苗病毒。但以MVA为载体的G蛋白疫苗在小鼠中的免疫原性不及普通痘苗病毒疫苗强[33]。痘苗病毒载体疫苗因为不能完全减毒且在诱导T细胞免疫方面的能力较弱因而人群中应用的前景不大。
2.8.2腺病毒(Adenovirus, Ad)载体疫苗 腺病毒能感染人的呼吸道、消化道、尿道、膀胱和眼等组织和器官,其基因不能整合入人体基因组,没有潜在的致癌能力,安全性也已经得到认证[34-35]。
其中人腺病毒5型(Adenovirus human serotype 5, AdHu5)载体疫苗使用的AdHu5删除了E1基因,是一种复制缺陷型病毒。AdHu5诱导的体液免疫和细胞免疫水平远远高于痘苗病毒和DNA病毒。因病毒不能复制,减少了其在免疫缺陷人群中应用的风险。但因普通人群AdHu5抗体阳性率较高,限制了其应用[36-37]。
采用黑猩猩腺病毒(Adenovirus Chimpanzee-Derived Serotypes, AdC)载体构建的疫苗因人群中普遍不含抗AdC抗体,表达G蛋白的AdC在经肌肉注射、口腔或鼻腔免疫小鼠一次后可产生持久保护性抗体[38-39]。目前,基于AdC3的Ebola疫苗已经完成一期临床试验,受试者肌肉注射疫苗一次,耐受性良好且产生的抗体可以持续到接种后48周,二期临床试验在进行中[40-41]。鉴于Ebola AdC病毒疫苗的临床研究结果,狂犬病AdC疫苗前景乐观。
综上所述,G蛋白提取困难导致其成本居高不下,G蛋白亚单位疫苗目前不具备大规模推广应用条件。病毒载体疫苗尤其腺病毒载体安全、有效、经济、使用方便,是下一代人狂犬病疫苗的发展方向。
3 狂犬病被动免疫制剂现状和研发进展
3.1狂犬病免疫球蛋白 狂犬病疫苗注射到产生有效抗体需要14 d左右时间,在产生有效抗体前的约2周的窗口期需要狂犬病被动免疫制剂如狂犬病免疫球蛋白来中和伤口附近可能存在的狂犬病毒。狂犬病免疫球蛋白注射后能够立即中和伤口局部的大部分病毒,阻止病毒扩散并侵入神经系统。狂犬病免疫球蛋白的半衰期为14~21 d,可为疫苗诱发主动免疫赢得时间。狂犬病被动免疫制剂和疫苗联合应用,可以最大限度地预防狂犬病发生。
目前市场上的狂犬病免疫球蛋白有两种。
3.1.1马源狂犬病免疫球蛋白(Equine rabies immunoglobulin, ERIG) 狂犬病毒免疫马匹采集血浆,经胃酶消化后,用硫酸胺盐析法制得的液体或冻干的免疫球蛋白制剂。因属于异源性蛋白,注射后过敏反应多见,程度轻重不一,严重者可致人死亡。
3.1.2人源狂犬病免疫球蛋白(Human rabies immunoglobulin, HRIG) 先用乙型肝炎疫苗免疫健康人后再经人用狂犬病疫苗免疫获得血浆,经提取、灭活病毒制成人抗狂犬病毒免疫球蛋白。缺点是来源有限,价格昂贵。一般无不良反应,少数人有红肿、疼痛感,无需特殊处理,可自行恢复。
ERIG和HRIG供应量有限,价格偏高,在狂犬病呈地方性流行的不发达地区难以普及。且疫苗联合HRIG或ERIG应用并不能保护所有狂犬病毒属血清型的感染[42-43]。
3.2狂犬病毒单克隆中和抗体(monoclonal antibody, mAb) 特异性的单克隆抗体相较于狂犬病免疫球蛋白,具有安全性好,特异性强,用量小,成本低,可大量生产等优点。效果与HRIG近似,适用于暴露后治疗,临床应用前景广阔。 一个单克隆抗体只能识别一个抗原表位,因此一般将数个单克隆抗体混合使用[44]。WHO推荐开发抗狂犬病G蛋白的单克隆抗体并且使用多个抗体的混合制剂以替代现有的HRIG或ERIG[45]。
国内外目前处于开发阶段的抗狂犬病毒单克隆抗体有:
3.2.1MassBiologics和印度血清研究所(Serum of Institute of India)共同开发的RAB1(I7C7),该单克隆抗体的表达细胞是CHO,结合的抗原表位在胞外区免疫原性区域III[46-47]。该单抗虽不能结合狂犬病毒所有血清型的G蛋白[48],但对绝大多数已知的狂犬病毒血清型中和效果良好,目前印度正在进行二期与三期临床试验。
3.2.2Crucell Holland BV开发的CL184(CR57和CR4098两个单抗的混合制剂,两个单抗结合表位分别位于免疫原性区域I和III),表达细胞为Per.C6。虽然两种抗体联合使用可以结合绝大部分狂犬病毒株,但因抗体不能结合中和所有狂犬病毒毒株而暂时终止二期临床试验[49-51]。考虑到不同区域狂犬病毒流行株的差异,该单克隆抗体混合制剂依然有巨大的开发价值。
3.2.3RVC20和RVC58(分别结合位于免疫原性区域I和III的表位)为新报道的抗狂犬病毒G蛋白单克隆抗体,表达细胞为Per.C6,可以中和所有35种狂犬病毒,效果优于CR57,CR4098和RAB1,目前处于临床研究前期[52]。
3.2.4SYN023(CTB011和CTB012两个单抗的混合制剂)是另一组新报道的人源化抗狂犬病毒G蛋白单抗混合物,和HRIG在动物中的保护效果相当。表达细胞为CHO-DG44,动物试验中接种剂量0.03 mg/kg即可达到保护效果。CTB011结合表位为免疫原性区域III和其附近区域,CTB011结合表位为多个不连续的保守的氨基酸形成的空间表位,不属于已经报道的G蛋白免疫原性区域。初步研究表明SYN023可以中和中国流行的15株狂犬病毒毒株和北美地区流行的12株狂犬病毒株,目前处于临床研究前期[53]。
3.2.5我国目前在人源抗狂犬病毒G蛋白单克隆抗体(mAb)的研究已处于世界前列。国内多家学术科研机构报道了抗狂犬病毒G蛋白单克隆抗体的制备、鉴定及中和作用效果[54-56]。其中,华北制药集团从2003年开始进行人源化抗狂犬病毒单克隆抗体(NM57)的研发工作,已得到了高水平表达工程细胞株,对制备得到的HuMAbs纯品进行了充分鉴定,用狂犬病毒标准攻击毒株(CVS)以及中国有代表性的街毒株进行了中和试验,结果显示NM57对狂犬病毒有明确的中和作用。同时,在街毒株的攻击实验中,显示了优于市售HRIG的保护率[57-58]。NM57为CHO细胞表达的单克隆抗体,与Crucell Holland BV开发的CR57(表达系统为Per.C6细胞)一样源于单克隆抗体SO57株(表达系统为BSR细胞),NM57的中和靶位为狂犬病毒G蛋白高度保守的免疫原性区域I[58-60], NM57已于2013年完成一期临床试验,安全性良好[61]。2016年底已完成二期临床试验,抗体特异性好,注射所需量约为1mg/人份,用量约为血源抗狂犬病免疫球蛋白的千分之一,预计可以显著压缩价格至传统HRIG的1/3。虽然其不能保护所有的狂犬病毒株感染,但针对中国的狂犬病毒流行株,是可以起到有效保护作用的。该单克隆抗体的上市后必定会对我国狂犬病防治产生重大正面促进作用。
4 结 语
发达国家已基本消除人和家养宠物的狂犬病,将狂犬病预防重心转移到野生动物上,并取得了显著成果。尽管现有的狂犬病毒灭活疫苗需要暴露前注射3针,暴露后需要注射4~5针,但在发达国家狂犬病极其罕见,市场需求少,疫苗公司缺乏动力研发新型疫苗。对于经济落后国家,更为简便经济的疫苗仍存在很大需求。
对于暴露前的大规模预防接种尤其需要这种疫苗具有绝对的安全性、经济性以及免疫的持久性,腺病毒载体疫苗尤其是黑猩猩腺病毒载体疫苗可以满足这方面的要求。对于暴露后接种,需要疫苗能够在尽量短的时间内诱发机体的免疫反应。这种情况下DNA疫苗因为诱导免疫反应所需时间长,不是好的选择。可以选择已有的灭活病毒疫苗或病毒载体疫苗结合狂犬病毒免疫球蛋白或单克隆中和抗体。相信随着研发的进展,基于狂犬病毒G蛋白的更为廉价方便的疫苗会在不久的将来会问世。
对于可能替代狂犬病毒抗血清的单克隆抗体,虽然其对生产技术要求高,但其优点不言而喻,可大规模生产降低成本,批次间效价的差异小,可以做成干粉,方便运输和贮存,提高保存期且更容易在偏远地区运用。狂犬病毒抗血清不能提供100%的保护,狂犬病毒单克隆抗体也存在同样问题。目前在研的单克隆抗体,其结合的表位均位于相对保守的区域。单个抗体不能中和所有毒株,会有免疫逃逸株出现[49-51]。WHO推荐使用混合制剂,将两种或两种以上识别不同表位的抗体联合使用。混合制剂具有以下特点:高效价,识别G蛋白上不同的无重合区域的表位,能中和尽可能多的毒株,可以显著减少或消除免疫逃逸毒株。
对于在中国和印度进行临床试验的单个单克隆抗体制剂,无疑存在免疫逃逸株的问题,但考虑到中印两国狂犬病毒流行株的流行情况,其使用是可以达到中和当地流行的毒株目的。单一抗体制剂的生产工艺和成本较两种或两种以上抗体混合制剂要低。相对于HRIG或ERIG的昂贵及短缺,其在中印这两个狂犬病高发国家控制和减低暴露后风险还是有意义的。当然以后的发展方向还是混合制剂。
随着时间的推进仍有可能会产生由基因突变和基因交换而来的新免疫逃逸株。就此问题需要结合狂犬病毒流行株分子流行病学上的监控数据,针对狂犬病毒流行株的变异情况,不断更新单克隆抗体混合制剂,提高抗体的保护范围,减少免疫逃逸株的出现。
随着新一代狂犬病疫苗以及狂犬病毒单克隆抗体的研发和应用,有信心期待2025在中国消灭人狂犬病,进而消灭家养宠物狂犬病并有效控制野生食肉动物狂犬病。
[1] 刘淑清, 陶晓燕,于鹏程, 等. 中国2015年狂犬病流行特征分析[J]. 中华实验和临床病毒学杂志,2016, 30(6): 537-540.DOI: 10.3760/cma.j.issn.1003-9279.2016.06.009
[2] Piyasirisilp S, Schmeckpeper BJ, Chandanayingyong D, et al. Association of HLA and T-cell receptor gene polymorphisms with semple rabies vaccine-induced autoimmune encephalomyelitis[J]. Ann Neurol, 1999, 45(5): 595-600. DOI: 10.1128/JVI.79.8.4672-4678.2005
[3] World Health Organization. Weekly epidemiological record on rabies[EB/OL][2017-09-21].https://foxrabiesblueprint.org/IMG/pdf/HumanProphylaxis_wer8532_WHO.pdf
[4] Pereira CA, Nozaki-Renard JN, Schwartz J, et al. Cytotoxicity reactions against target cells infected with rabies virus[J]. J Virol Methods,1982, 5(2): 75-83. DOI: 10.1016/0166-0934(82)90084-2
[5] Craig Hooper D, Morimoto K, Bette M, et al. Collaboration of antibody and inflammation in clearance of rabies virus from the central nervous system[J]. J Virol. 1998, 72(5): 3711-3719.
[6] Yelverton E, Norton S, Obijeski JF, et al. Rabies virus glycoprotein analogs: biosynthesis inEscherichiacoli[J]. Science, 1983, 219(4585): 614-620. DOI: 10.1126/science.6297004
[7] Ertl HC. Novel vaccines to human rabies[J]. PLoS Negl Trop Dis, 2009, 3(9): e515. DOI: 10.1371/journal.pntd.0000515
[8] Sureau P, Perrin P. The use of immunosome technology for vaccines against rabies and other viral diseases[J]. Eur J Epidemiol, 1989, 5(3): 275-278. DOI: 10.1007/BF00144826
[9] Prehaud C, Takehara K, Flamand A, et al. Immunogenic and protective properties of rabies virus glycoprotein expressed by baculovirus vectors[J]. Virology, 1989, 173(2): 390-399. DOI: 10.1016/0042-6822(89)90551-5
[10] Fu ZF, Rupprecht CE, Dietzschold B, et al. Oral vaccination of racoons (Procyon lotor) with baculovirus-expressed rabies virus glycoprotein[J]. Vaccine, 1993, 11(9): 925-928. DOI: 10.1016/0264-410X(93)90379-C
[11] Ramya R, Mohana Subramanian B, Sivakumar V, et al. Expression and solubilization of insect cell-based rabies virus glycoprotein and assessment of its immunogenicity and protective efficacy in mice[J]. Clin Vaccine Immunol, 2011, 18(10):1673-1679. DOI: 10.1128/CVI.05258-11
[12] Yokomizo AY, Jorge SA, Astray RM, et al. Rabies virus glycoprotein expression in Drosophila S2 cells.I. Functional recombinant protein in stable co-transfected cell line[J]. Biotechnol J, 2007, 2(1): 102-109. DOI: 10.1002/biot.200600211
[13] Swiech K, Rossi N, Silva BG, et al. Bioreactor culture of recombinantDrosophilamelanogasterS2 cells: characterization of metabolic features related to cell growth and production of the rabies virus glycoprotein[J]. Cytotechnology, 2008, 57(1): 61-66. DOI: 10.1007/s10616-008-9130-7
[14] Galesi ALL, Aguiar MA, Astray RM. Growth of recombinant Drosophila melanogaster Schneider 2 cells producing rabies virus glycoprotein in bioreactor employing serum-free medium[J]. Cytotechnology, 2008, 57(1): 73-81. DOI: 10.1007/s10616-008-9139-y
[15] Ventini-Monteiro DC, Astray RM, Pereira CA. Production of recombinant rabies virus glycoprotein by insect cells in a single-use fixed-bed bioreactor[J]. Methods Mol Biol, 2018, 1674: 87-94. DOI: 10.1007/978-1-4939-7312-5_7
[16] Sakamoto S, Ide T, Tokiyoshi S, et al. Studies on the structures and antigenic properties of rabies virus glycoprotein analogues produced in yeast cells[J]. Vaccine, 1999, 17(3): 205-218. DOI: 10.1016/S0264-410X(98)00196-0
[17] Klepfer SR, Debouck C, Uffelman J, et al. Characterization of rabies glycoprotein expressed in yeast[J]. Arch Virol, 1993, 128(3/4): 269-286. DOI: 10.1007/BF01309439
[18] McGarvey PB, Hammond J, Dienelt MM, et al. Expression of the rabies virus glycoprotein in transgenic tomatoes[J]. Biotechnology (NY), 1995, 3(13): 1484-1487. DOI: 10.1038/nbt1295-1484
[19] Ashraf S, Singh PK, Yadav DK, et al. High level expression of surface glycoprotein of rabies virus in tobacco leaves and its immunoprotective activity in mice[J]. J Biotechnol, 2005, 119(1): 1-14. DOI: 10.1016/j.jbiotec.2005.06.009
[20] Loza-Rubio E, Rojas E, Gomez L, et al. Development of an edible rabies vaccine in maize using the Vnukovo strain[J]. Dev Biol (Basel), 2008, 131: 477-482.
[21] Gupta PK, Sharma S, Walunj SS, et al. Immunogenic and antigenic properties of recombinant soluble glycoprotein of rabies virus[J]. Vet Microbiol, 2005, 108(3/4): 207-214. DOI: 10.1016/j.vetmic.2005.04.007
[22] Wojczyk BS, Czerwinski M, Stwora-Wojczyk MM, et al. Purification of a secreted form of recombinant rabies virus glycoprotein: comparison of two affinity tags[J]. Protein Expr Purif, 1996, 7(2): 183-193. DOI: 10.1006/prep.1996.0026
[23] Shakin-Eshleman SH, Remaley AT, Eshleman JR, et al. N-linked glycosylation of rabies virus glycoprotein. Individual sequons differ in their glycosylation efficiencies and influence on cell surface expression[J]. J Biol Chem, 1992, 67(15): 10690-10698.
[24] Burger SR, Remaley AT, Danley JM, et al. Stable expression of rabies virus glycoprotein in Chinese hamster ovary cells[J]. J Gen Virol, 1991, 72 (Pt 2): 359-367. DOI: 10.1099/0022-1317-72-2-359
[25] Kasturi L, Eshleman JR, Wunner WH, et al. The hydroxy amino acid in an Asn-X-Ser/Thr sequon can influence N-linked core glycosylation efficiency and the level of expression of a cell surface glycoprotein[J]. J Biol Chem, 1995, 270(24): 14756-14761. DOI: 10.1074/jbc.270.24.14756
[26] Wojczyk BS, Takahashi N, Levy MT, et al. N-glycosylation at one rabies virus glycoprotein sequon influences N-glycan processing at a distant sequon on the same molecule[J]. Glycobiology, 2005, 15(6): 655-666. DOI: 10.1093/glycob/cwi046
[27] Tesoro Cruz E, Feria Romero IA, Lopez Mendoza JG, et al. Efficient post-exposure prophylaxis against rabies by applying a four-dose DNA vaccine intranasally[J]. Vaccine, 2008, 26(52): 6936-6944. DOI: 10.1016/j.vaccine.2008.09.083
[28] Osorio JE, Tomlinson CC, Frank RS, et al. Immunization of dogs and cats with a DNA vaccine against rabies virus[J]. Vaccine, 1999, 17(9/10): 1109-1116. DOI: 10.1016/S0264-410X(98)00328-4
[29] Lodmell DL, Parnell MJ, Bailey JR, et al. One-time gene gun or intramuscular rabies DNA vaccination of non-human primates: comparison of neutralizing antibody responses and protection against rabies virus 1 year after vaccination[J]. Vaccine, 2001, 20(5/6): 838-844. DOI: 10.1016/S0264-410X(01)00392-9
[30] Lodmell DL, Parnell MJ, Bailey JR, et al. Rabies DNA vaccination of non-human primates: post-exposure studies using gene gun methodology that accelerates induction of neutralizing antibody and enhances neutralizing antibody titers[J]. Vaccine, 2002, 20(17/18): 2221-2228. DOI: 10.1016/S0264-410X(02)00143-3
[31] Saxena S, Sonwane AA, Dahiya SS, et al. Induction of immune responses and protection in mice against rabies using a self-replicating RNA vaccine encoding rabies virus glycoprotein[J]. Vet Microbiol, 2009, 136(1/2): 36-44. DOI: 10.1016/j.vetmic.2008.10.030
[32] Astray RM, Jorge SA, Pereira CA. Rabies vaccine development by expression of recombinant viral glycoprotein[J]. Arch Virol, 2017, 162(2): 323-332. DOI: 10.1007/s00705-016-3128-9
[33] Weyer J, Rupprecht CE, Mans J, et al. Generation andevaluation of a recombinant modified vaccinia virus Ankara vaccine for rabies[J]. Vaccine, 2007, 25(21): 4213-4222. DOI: 10.1016/j.vaccine.2007.02.084
[34] Artenstein AW, Opal JM, Opal SM, et al. History of U.S. military contributions to the study of vaccines against infectious diseases[J]. Mil Med, 2005, 170(4 Suppl): 3-11. DOI:10.7205/MILMED.170.4S.3
[35] Choudhry A, Mathena J, Albano JD, et al. Safety evaluation of adenovirus type 4 and type 7 vaccine live, oral in military recruits[J]. Vaccine, 2016, 34(38): 4558-4564. DOI: 10.1016/j.vaccine.2016.07.033
[36] Xiang ZQ, Pasquini S, Ertl HC. Induction of genital immunity by DNA priming and intranasal booster immunization with a replication-defective adenoviral recombinant[J]. J Immunol, 1999, 162(11): 6716-6723.
[37] Xiang ZQ, Yang Y, Wilson JM, et al. A replication-defective human adenovirus recombinant serves as a highly efficacious vaccine carrier[J]. Virology, 1996, 219(1): 220-227. DOI: 10.1006/viro.1996.0239
[38] Xiang Z, Li Y, Gao G, et al. Mucosally delivered E1-deleted adenoviral vaccine carriers induce transgene product-specific antibody responses in neonatal mice[J]. J Immunol, 2003, 171(8): 4287-4293. DOI: 10.4049/jimmunol.171.8.4287
[39] Zhou D, Cun A, Li Y, et al. A chimpanzee-origin adenovirus vector expressing the rabies virus glycoprotein as an oral vaccine against inhalation infection with rabies virus[J]. Mol Ther, 2006, 14(5): 662-672. DOI: 10.1016/j.ymthe.2006.03.027
[40] De Santis O, Audran R, Pothin E, et al. Safety and immunogenicity of a chimpanzee adenovirus-vectored Ebola vaccine in healthy adults: a randomised, double-blind, placebo-controlled, dose-finding, phase 1/2a study[J]. Lancet Infect Dis, 2016, 16(3): 311-320. DOI: 10.1016/S1473-3099(15)00486-7
[41] Ledgerwood JE, DeZure AD, Stanley DA, et al. Chimpanzee Adenovirus Vector Ebola Vaccine[J]. N Engl J Med, 2017, 376(10): 928-938. DOI: 10.1056/NEJMoa1410863
[42] Hanlon CA, Kuzmin IV, Blanton JD, et al. Efficacy of rabies biologics against new lyssaviruses from Eurasia[J]. Virus Res, 2005, 111(1): 44-54. DOI: 10.1016/j.virusres.2005.03.009
[43] Both L, Banyard AC, van Dolleweerd C, et al. Passive immunity in the prevention of rabies[J]. Lancet Infect Dis, 2012, 12(5): 397-407. DOI: 10.1016/S1473-3099(11)70340-1
[44] Bakker AB, Python C, Kissling CJ, et al. First administration to humans of a monoclonal antibody cocktail against rabies virus: safety, tolerability, and neutralizing activity[J]. Vaccine, 2008, 26(47): 5922-5927. DOI: 10.1016/j.vaccine.2008.08.050
[45] World Health Organization. WHO experts consultation on rabies. second report world health organ tech rep ser[EB/OL][2017-09-21], 2013, (982): 1-139.http://apps.who.int/iris/bitstream/10665/85346/1/9789240690943_eng.pdf
[46] Sloan SE, Hanlon C, Weldon W, et al. Identification and characterization of a human monoclonal antibody that potently neutralizes a broad panel of rabies virus isolates[J]. Vaccine, 2007, 25(15): 2800-2810. DOI: 10.1016/j.vaccine.2006.12.031
[47] Nagarajan T, Marissen WE, Rupprecht CE. Monoclonal antibodies for the prevention of rabies: theory and clinical practice[J]. Antibody Technology Journal, 2014, 4: 1-12. DOI:10.2147/ANTI.S33533
[48] Wang Y, Rowley KJ, Booth BJ, et al. G glycoprotein amino acid residues required for human monoclonal antibody RAB1 neutralization are conserved in rabies virus street isolates[J]. Antiviral Res, 2011, 91(2): 187-194. DOI: 10.1016/j.antiviral.2011.06.002
[49] Bakker AB, Marissen WE, Kramer RA, et al. Novel human monoclonal antibody combination effectively neutralizing natural rabies virus variants and individual in vitro escape mutants[J]. J Virol, 2005, 79(14): 9062-9068. DOI: 10.1128/JVI.79.14.9062-9068.2005
[50] Goudsmit J, Marissen WE, Weldon WC,et al. Comparison of an anti-rabies human monoclonal antibody combination with human polyclonal anti-rabies immune globulin[J]. J Infect Dis, 2006, 193(6): 796-801. DOI:10.1086/500470
[51] Marissen WE, Kramer RA, Rice A, et al. Novel rabies virus-neutralizing epitope recognized by human monoclonal antibody: fine mapping and escape mutant analysis[J]. J Virol, 2005, 79(8): 4672-4678. DOI: 10.1128/JVI.79.8.4672-4678.2005
[52] De Benedictis P, Minola A, Rota Nodari E, et al. Development of broad-spectrum human monoclonal antibodies for rabies post-exposure prophylaxis[J]. EMBO Mol Med, 2016, 8(4): 407-421. DOI: 10.15252/emmm.201505986
[53] Chao TY,Ren S, Shen E, et al. SYN023, a novel humanized monoclonal antibody cocktail, for post-exposure prophylaxis of rabies. PLoS Negl Trop Dis, 2017,20(12): e0006133. DOI: 10.1371/journal.pntd.0006133
[54] 张夏玲, 孙见宇, 殷珏等. 全人源抗狂犬病病毒单克隆抗体的制备与鉴定[J].南京医科大学学报(自然科学版), 2012, 32(6): 739-744.
[55] 陈超, 张铁钢. 人源抗狂犬病毒单克隆抗体载体的构建及烟草转基因研究[J]. 生物学通报, 2011, 46(2): 46-49. DOI: 10.3969/j.issn.0006-3193.2011.02.018
[56] 王晓虎, 靳玉珠, 丁壮, 等.治疗性狂犬病病毒单克隆抗体的研究进展[J].中国生物制品学杂志, 2009, 22(10): 1032-1035.
[57] 刘晓雷, 侯禹男, 陈知航, 等. 定量检测猕猴血清中重组人源化抗狂犬病毒单克隆抗体间接ELISA法的建立[J]. 生物技术通讯, 2008, 19(3): 407-409.DOI: 10.3969/j.issn.1009-0002.2008.03.026
[58] 贾茜, 徐葛林, 赵伟, 等. 重组人抗狂犬病毒单抗SO57、SOJB对不同狂犬病毒毒株中和作用的研究[J]. 病毒学报, 2006, 22(4):256-262.DOI: 10.3321/j.issn:1000-8721.2006.04.003
[59] 李新颖, 吕明. 抗体药物在抗感染领域的应用[J].药学学报, 2015, 50(12):1527-1533.
[60] Kuzmina NA, Kuzmin IV, Ellison JA, et al. Conservation of binding epitopes for monoclonal antibodies on the rabies virus glycoprotein[J]. Antivirals and Antiretrovirals. 2013, 5(2): 37-43. DOI: 10.1099/0022-1317-74-8-1539
[61] 王美霞, 贾敏, 金铭, 等.不同剂量重组人源抗狂犬病毒单克隆抗体注射液人体单次给药的安全性[J].中国生物制品学杂志, 2013, 26(7): 986-990.
