4种功能红曲相关标准中洛伐他汀含量测定方法的比较
2018-06-08李志强吴丽云
李志强,刘 颖,林 风,吴丽云*
(福建省微生物研究所 福建省新药(微生物)筛选重点实验室,福建 福州 350007)
红曲是用红曲菌(Monascussp.)发酵米饭制成的一种紫红色曲米,在我国已有超过1 000年的历史,被广泛应用于食品着色,醋、酒酿造,生物催化及传统中医药等领域,是极为珍贵的药食两用原料,具有极高的开发价值。福建省古田县为红曲发源地,该地所产红曲最为著名[1]。红曲产品种类多样,其中以大米为原料,用纯培养的红曲菌发酵生成的含发酵自然产生的莫纳可林K(又称洛伐他汀)等生物活性物质的红曲为功能红曲[2]。20世纪70年代末,ENDO A[3]从红曲产物中分离到莫纳可林K,该物质与土曲霉(Aspergillus terreus)产的洛伐他汀(lovastatin,又称为mevinolin)为同一物质[4],是目前临床上广泛应用的降胆固醇药物之一,用于治疗高血脂。洛伐他汀是红曲菌所产生的聚酮类化合物之一[5],其通过抑制胆固醇合成关键酶3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)还原酶的活性来阻断胆固醇的从头合成[4,6]。最近20多年的研究发现,红曲菌在代谢中除了可产生洛伐他汀以外,还可产生色素、γ-氨基丁酸、麦角甾醇、多不饱和脂肪酸、黄酮、多酚等多种生物活性物质,具有降血脂、降血压、降血糖、抑菌、抗癌和提高免疫力等多种功效[7-10]。
功能红曲是通过固态发酵生产的,除烘干外并未经过其他复杂的后续处理步骤,可直接服用,存在酸式和内酯式两种构型的洛伐他汀。内酯式洛伐他汀作为前体药物,需在人体内转变为酸式洛伐他汀才能被吸收并发挥作用[4]。在肝脏中,内酯式洛伐他汀在细胞色素P450 3A4酶的作用下被水解成酸式洛伐他汀[11]。研究表明,酸式构型的洛伐他汀功效是内酯式构型的2倍[6],但前者的稳定性不如后者。内酯式洛伐他汀的不良药物反应包括肌病和肝功能异常[12],如果不给予治疗会产生严重问题。因此,酸式洛伐他汀的比例应是衡量功能红曲安全性能和产品质量的指标之一。我国功能红曲产品及其现行相关标准见表1。4种标准均规定了洛伐他汀的含量,但只有《浙江省中药炮制规范》2015年版中规定了酸式洛伐他汀的比例。

表1 我国功能红曲产品及其相关标准Table 1 Functional red koji products and related standards in China
高效液相色谱法具有高准确度、高灵敏度的优点,是功能红曲标准中洛伐他汀含量测定最常用的方法。依据不同的标准,萃取溶剂种类有可能不同,在溶剂种类相同的情况下溶剂的浓度、萃取时间、高效液相色谱所采用的流动相均可能存在差异,因此这些标准中规定的洛伐他汀含量测定的方法并不完全相同。显然,按照这些标准检测同一个产品的洛伐他汀含量,可能会得到不同的数据,但这些数据之间的差异到底有多大并没有相关报道。本研究选取5份功能红曲,分别按照我国现行的4个功能红曲标准进行洛伐他汀含量和酸式洛伐他汀比例的测定,比较4种检测方法之间的差异,以期为功能红曲产品的质量控制提供更好的参考。
1 材料与方法
1.1 材料与试剂
功能红曲样品:自制,由本研究所“古田红曲生产菌种库”的优良红曲菌接种于米饭后经固态发酵制成,固态发酵条件参照文献[16]。
洛伐他汀标准品(批号100600-201003,含量为99.4%):中国食品药品检定研究院;甲醇和乙腈(色谱纯):德国Merck公司;磷酸(色谱纯):天津市光复精细化工研究所;其他试剂均为分析纯,超纯水用Milli-Q制备。
1.2 仪器与设备
Agilent1260高效液相色谱仪:美国Agilent公司;XA105型电子分析天平(双量程,d=0.01mg/0.1mg)和pH计(FE20):梅特勒-托利多公司;KQ-500DE型数控超声波清洗器:昆山市超声仪器有限公司;Milli-Q Advantage A10超纯水系统:美国Millipore公司。
1.3 方法
1.3.1 功能红曲样品预处理
将固态发酵后经过60℃干燥24 h的红曲米粉碎(60目,粉状)并充分混合均匀。分别按QB/T 2847—2007《功能性红曲米(粉)》(以下简称方法1)[2]、《四川省中药饮片炮制规范》2015年版(以下简称方法2)[13]、《浙江省中药炮制规范》2015年版(以下简称方法3)[14]和《中国药典》2015年版(以下简称方法4)[15]等标准的规定精密称取相应质量的红曲粉,并按规定方法提取红曲粉中的洛伐他汀。进行高效液相色谱分析之前,所有样品均经过0.45 μm微孔滤膜过滤。每个样品进行3次平行测定。
1.3.2 洛伐他汀标准溶液的配制
精密称取内酯式洛伐他汀标准品4份,每份10 mg,分别用4种方法中规定的溶剂溶解并定容至10 mL,作为储备液,于-20℃避光保存,临用前进行系列稀释。
定性用酸式洛伐他汀的制备参照QB/T2847—2007《功能性红曲米(粉)》[2],略作改动。精密称取内酯式洛伐他汀标准品4 mg,以少量乙腈溶解后用0.2 mol/L氢氧化钠溶液超声转化60 min,放置到室温后定容至10 mL,经0.45 μm微孔滤膜过滤,待用。
1.3.3 高效液相色谱条件
色谱柱:反相C18柱(5 μm,250 mm×4.6 mm);柱温:28℃(方法1中的柱温为25℃);检测波长:238 nm;检测器:二极管阵列检测器;进样体积:10 μL;流速:1 mL/min。根据保留时间定性化合物,使用外标法根据峰面积定量。
方法1的流动相为甲醇-水-磷酸(385∶115∶0.14),方法2和方法3的流动相为乙腈-甲醇-0.1%磷酸溶液(55∶5∶40),方法4的流动相为甲醇-水(75∶25)。
1.3.4 标准曲线绘制
根据4种方法,分别用体积分数75%的乙醇、体积分数75%的丙酮、乙腈和甲醇稀释1.3.2中配制的内酯式洛伐他汀储备液至质量浓度分别为1μg/mL、10μg/mL、30μg/mL、75 μg/mL、150 μg/mL、300 μg/mL的洛伐他汀标准溶液。按1.3.3的条件进行高效液相色谱分析,以洛伐他汀的质量浓度为横坐标(X),峰面积为纵坐标(Y)作图,进样线性回归分析。相关系数R2>0.999时,进行后续样品测定。
1.3.5 加标回收实验
为了研究4种方法中不同的提取条件对样品提取的效果,另取自制同一批红曲粉,精密称量,按低、中、高浓度分别加入400 μg、800 μg、1 600 μg的内酯式洛伐他汀,按1.3.1的方法进行样品的预处理后,按1.3.3的高效液相色谱条件进样测定,计算回收率。
1.3.6 数据处理
功能红曲样品中洛伐他汀总含量为酸式和内酯式洛伐他汀含量之和。采用SPSS 17.0软件进行数据处理,数据结果均为3次重复的平均值±标准差(standarddeviation,SD)。
2 结果与分析
2.1 标准曲线绘制和加标回收实验
4种方法的回归方程、线性相关系数(R2)和线性范围见表2,4种方法的内酯式洛伐他汀加标回收率实验结果见表3。

表2 洛伐他汀的线性回归方程、相关系数及洛伐他汀两种构型的保留时间和线性范围Table 2 Linear regression equation and correlation coefficient of lovastatin and retention time and linear range of two configurations of lovastatin
由表2可知,内酯式洛伐他汀在1~300 μg/mL范围内呈良好的线性关系。酸式洛伐他汀在除方法4外的其他3种方法中保留时间均稳定,在方法1中的保留时间最长;而内酯式洛伐他汀在4种方法中的保留时间均稳定,在方法2中的保留时间最长。酸式和内酯式洛伐他汀在方法2和方法3中的保留时间分别接近,两者保留时间之差值>5min。
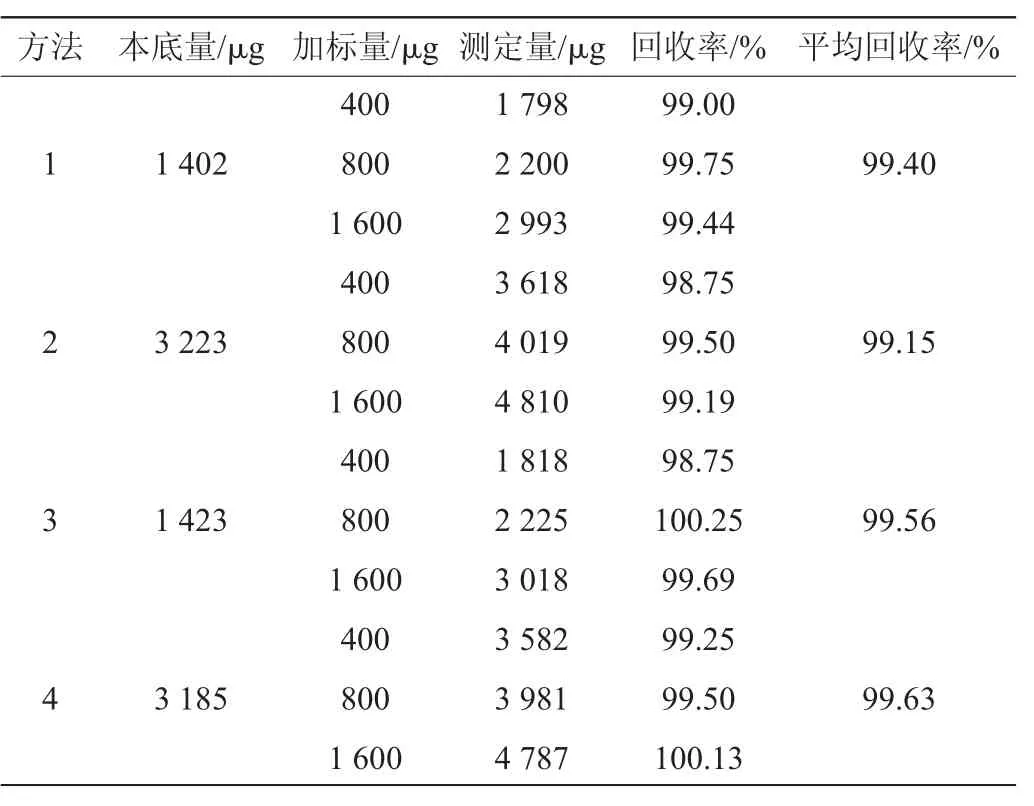
表3 4种方法的内酯式洛伐他汀加标回收率实验结果Table 3 Results of adding standard recovery rates experiments of lactone forms of lovastatin of four methods
由表3可知,4种方法的平均加标回收率均>99%,表明4种方法的检测准确度较高。
2.2 《中国药典》2015年版洛伐他汀含量测定方法存在的问题
通过实验发现,《中国药典》2015年版规定的高效液相色谱方法测定酸式洛伐他汀含量时存在两个问题:(1)峰形不对称,变形严重;(2)保留时间漂移幅度很大,导致酸式洛伐他汀和样品中其他成分的峰有可能没有完全分开,这会直接影响到酸式洛伐他汀检测的准确性和重复性。由图1(B)可知,5个样品的酸式洛伐他汀保留时间的变动已经超出正常范围,而内酯式洛伐他汀的保留时间正常、峰形对称。作者曾尝试过更换多种品牌和型号的色谱柱,但并不能稳定酸式洛伐他汀的保留时间,改善其峰形。因此在方法4中只给出了内酯式洛伐他汀含量,其他数据并没有提供。

图1 酸式洛伐他汀标准品(A)和5个样品(B)的高效液相色谱图Fig.1 HPLC chromatograms of acid forms of lovastatin standard(A)and five samples(B)
2.3 4种方法的检测结果
1号样品采用4种方法的高效液相色谱图见图2(其他4个样品的高效液相色谱图与1号样品类似,因此未予列出)。由图2可知,在方法1、方法2和方法3中酸式洛伐他汀和内酯式洛伐他汀与相邻色谱峰的分离度均>1.5,能满足样品检测的要求。酸式洛伐他汀和内酯式洛伐他汀均能在20 min内出峰,所用的分析时间较短,能满足样品快速分析的要求。方法1所采用的流动相使酸式洛伐他汀和内酯式洛伐他汀的色谱峰相邻,但能完全分开(分离度>1.5);方法2和方法3所采用的流动相使酸式洛伐他汀和内酯式洛伐他汀的色谱峰相距较远,分离度较高。
5个红曲样品分别采用4种方法进行洛伐他汀两种构型的含量及比例的测定,结果见表4。由表4可知,5个样品洛伐他汀总含量测定值的范围为2.45~15.55 mg/g,酸式洛伐他汀比例的测定值范围为47.53%~86.43%。同一个样品洛伐他汀总含量根据所采用的方法不同会有较大差异,但5个样品洛伐他汀总含量的测定值均表现出相同的趋势,方法2>方法3>方法1(表4和表5)。同一份样品采用不同方法测定的酸式洛伐他汀的比例较接近,如样品1中酸式洛伐他汀的比例分别为64.91%(方法1)、66.33%(方法2)、66.87%(方法3)。

图2 不同方法测定1号样品中的洛伐他汀高效液相色谱图Fig.2 HPLC chromatograms of lovastatin contents in sample 1 by different methods
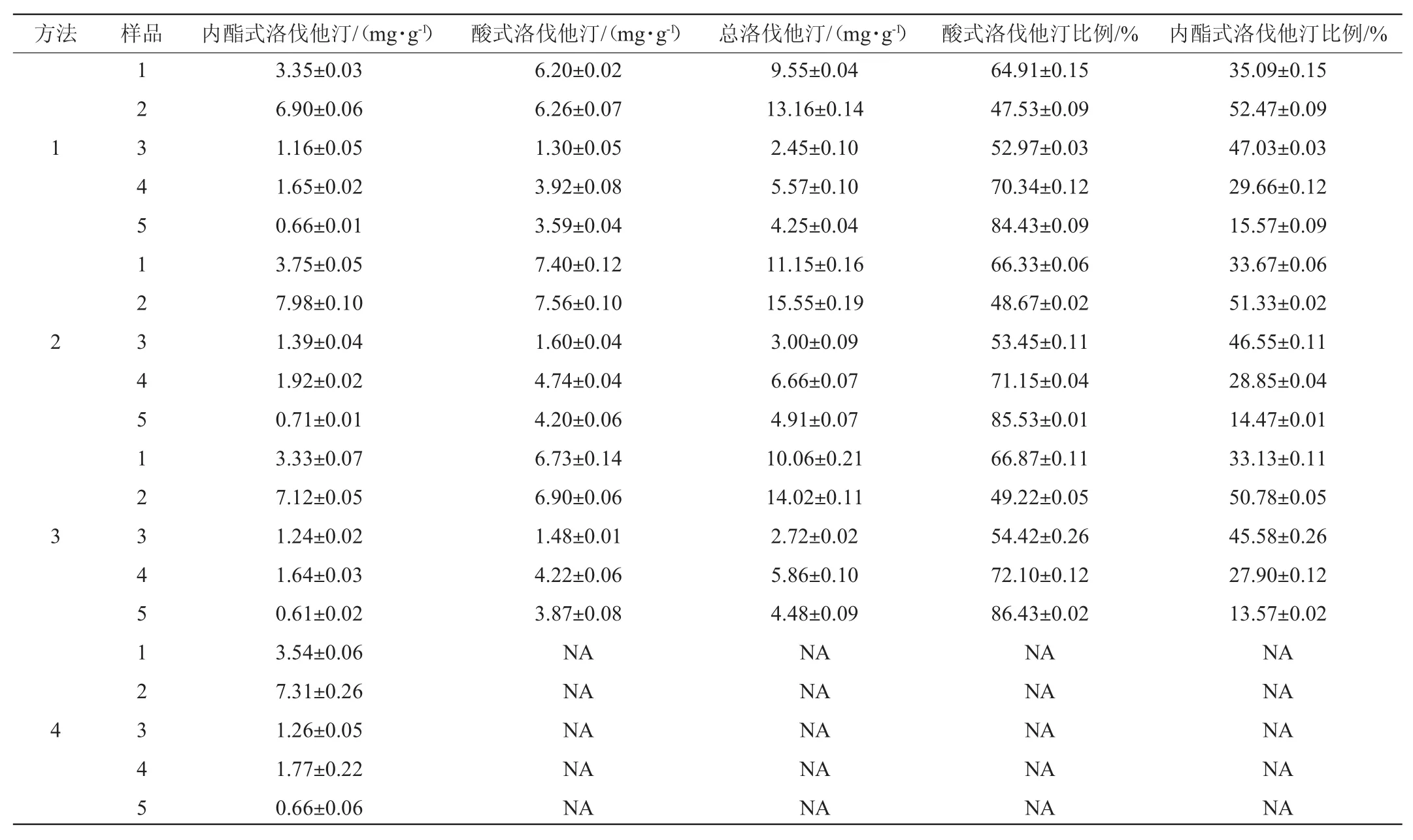
表4 5个红曲样品的洛伐他汀总含量和酸式洛伐他汀的比例(n=3)Table 4 Total lovastatin contents and the proportions of acid forms of lovastatin of five samples(n=3)

表5 不同方法测定的5个红曲样品中洛伐他汀总含量的相对比例Table 5 Relative proportions of total lovastatin contents of five red kojic samples with different methods
分别以方法2测定的5个样品的洛伐他汀总含量为参考值,计算方法1和3测定的样品中洛伐他汀总含量相对于方法2测定结果的相对比例,结果见表5。由表5可知,同一样品采用不同方法测定的结果有差异,其中测得洛伐他汀总含量为方法2>方法3>方法1。
3 结论
用《中国药典》2015年版中的高效液相色谱方法进行洛伐他汀含量测定时,其酸式构型保留时间异常、峰形不对称,导致其含量测定结果不准确,重复性不好;而内酯式构型的含量测定则不存在以上问题。
方法1中酸式和内酯式洛伐他汀的出峰时间均避免了溶剂和杂质峰的干扰,但两者的出峰时间很近。在实际样品检测中,由于功能红曲样品成分多样、系统轻微波动等因素的影响,可能会使色谱峰发生拖尾或前沿现象,两峰有可能无法完全分开。而方法2和方法3中内酯式洛伐他汀的出峰时间得到明显延长,从而与酸式洛伐他汀得到很好的分离,两者的出峰时间同样避免了溶剂和杂质峰的干扰。
采用不同的方法(主要是洛伐他汀的提取条件和高效液相色谱条件),对同一份样品的检测结果有较大差异,采用方法2测定的洛伐他汀总含量最高。同一份样品,采用3个标准测定的酸式洛伐他汀的比例很接近。从样品提取方法来看,方法1、方法2和方法3中的样品提取简便快捷,而方法4中样品提取相对复杂繁琐,可能会导致提取效率偏低。由于溶剂不可能从红曲粉中把洛伐他汀萃取完全,4种方法洛伐他汀含量测定值之间的差异可能主要是受萃取溶剂提取效率的影响,有可能方法2提取率相对最高。综合以上分析,在4种方法中《四川省中药饮片炮制规范》2015年版相对最好,但其他方法也不能完全否认。功能红曲中的洛伐他汀同时具有酸式和内酯式两种构型,建议未规定酸式洛伐他汀比例的标准可在今后的标准修订中对酸式洛伐他汀比例的检测进行规定。
1]林 风.福建古田为红曲发源地考证[J].中草药,2017,48(13):2793-2800.
2]中华人民共和国国家发展和改革委员会.QB/T 2847—2007功能性红曲米(粉)[S].北京:中国轻工业出版社,2007.
3]ENDO A.Monacolin K,a new hypocholesterolemic agent produced by aMonascusspecies[J].J Antibiot,1979,32(8):852-854.
[4]ALBERTS A,CHEN J,KURON G,et al.Mevinolin:a highly potent competitive inhibitor of hydroxymethylglutaryl-coenzyme A reductase and a cholesterol-lowering agent[J].P Natl Acad Sci USA,1980,77(7):3957-3961.
[5]陈 泉,吴远征,赵晓燕,等.功能性红曲中三类主要聚酮类化合物合成途径相关基因研究进展[J].中国酿造,2014,33(8):10-14.
[6]FENG Y,SHAO Y,ZHOU Y,et al.Effects of glycerol on pigments and monacolin K production by the high-monacolin K-producing but citrininfree strain,Monascus pilosusMS-1[J].Eur Food Res Technol,2015,240(3):635-643.
[7]CHEN W,HE Y,ZHOU Y,et al.Edible filamentous fungi from the speciesMonascus:early traditional fermentations,modern molecular biology,and future genomics[J].Compr Rev Food Sci Food Safe,2015,14:555-567.
[8]周文斌,贾瑞博,李 燕,等.红曲色素组分、功效活性及其应用研究进展[J].中国酿造,2016,35(7):6-10.
[9]胡均亮,陆方菊,陈 功,等.不同来源红曲米多酚类化合物和抗氧化活性的聚类分析[J].中国酿造,2017,36(3):39-43.
[10]黄宏南,林 杰,林文庭.保健红曲的研制与开发进展[J].海峡预防医学杂志,2006,12(6):18-20.
[11]SCHACHTER M.Chemical,pharmacokinetic and pharmacodynamic properties of statins:an update[J].Fund Clin Pharmacol,2004,19:117-125.
[12]KLIMEK M,WANG S,OGUNKANMI A.Safety and efficacy of red yeast rice(Monascus purpureus)as an alternative therapy for hyperlipidemia[J].Pharm Therapeut,2009,34(6):313-327.
[13]四川省食品药品监督管理局.四川省中药饮片炮制规范(2015年版)[S].成都:四川科技出版社,2016.
[14]浙江省食品药品监督管理局.浙江省中药炮制规范(2015年版)[S].北京:中国医药科技出版社,2016.
[15]国家药典委员会.中华人民共和国药典(2015年版)[S].北京:中国医药科技出版社,2015.
[16]刘 颖,林 风,郑军荣,等.低桔霉素且产Monacolin K红曲菌株的筛选与鉴定[J].福建农林大学学报:自然科学版,2015,44(5):456-461.
