菌株F21来源α-淀粉酶的酶学性质研究1
2018-06-08郭宏文1徐婷婷1刘晓兰1姜未公1马瑞1
郭宏文1,2,徐婷婷1,2,刘晓兰1,2,姜未公1,马瑞1
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔161006;2.黑龙江省普通高校农产品加工重点实验室,黑龙江齐齐哈尔161006)
在酶制剂工业中,α-淀粉酶是最早实现工业化生产且用途最广、产量最大的酶制剂品种,几乎占淀粉酶制剂总产量的50%以上[1]。通常,中性α-淀粉酶的最适pH范围为6.0~8.0,而酸性α-淀粉酶最适pH范围为4.0~6.0。与中性α-淀粉酶相比,酸性α-淀粉酶能够在酸性条件下水解淀粉,保持高活性。凭借它的优势,酸性α-淀粉酶在食品加工、酿造发酵、制糖、纺织、造纸、医药和饲料等工业领域的应用日益广泛[2-4]。目前工业应用的α-淀粉酶主要来源于细菌和丝状真菌[5-6],生产酸性α-淀粉酶的菌株则主要为黑曲霉和枯草芽孢杆菌[7-8]。研究和开发新型的酸性α-淀粉酶具有极高的社会经济价值。近年来,国内学者在开发新型的酸性α-淀粉酶方面开展了一些研究,如屈建航等[9]筛选到产α-淀粉酶的酵母菌菌株SH3,所产α-淀粉酶的最适pH值为5.0,最适温度为50℃。权淑静等[10]对黑曲霉菌株A-5-3所产α-淀粉酶进行了酶性质研究,酶的最适pH值为3.6,最适温度为70℃,具有很好的酸稳定性且为非Ca2+依赖型水解酶。本研究对实验室从白酒厂的酒醅中分离筛选的产α-淀粉酶菌株F21进行诱变选育[11],并对其所产的α-淀粉酶进行纯化和酶学性质研究,为开发新型的酸性α-淀粉酶在酶的纯化方面提供一些基础研究数据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
枯草芽孢杆菌(Bacillus subtilis)F21:本实验室从酒醅中分离并经诱变选育得到。
1.1.2 培养基[12]
菌种保藏培养基:可溶性淀粉1.2 g,蛋白胨0.8 g,酵母粉0.2 g,K2HPO40.1 g,MgSO4·7H2O 0.05 g,琼脂粉2.0 g,蒸馏水100 mL,pH 7.0,121℃灭菌20 min。
产酶种子培养基:可溶性淀粉1.2 g,蛋白胨0.8 g,酵母粉0.2 g,K2HPO40.1 g,MgSO·47H2O 0.05 g,蒸馏水100 mL,pH 7.0,121℃灭菌20 min。
产酶发酵培养基:玉米淀粉2.0 g,豆饼粉1.5 g,K2HPO40.1 g,MgSO·47H2O 0.05 g,蒸馏水100 mL,pH 7.0,121 ℃灭菌20 min。
1.1.3 试剂
快速辛基-琼脂糖凝胶(OctylSepharoseFastFlow)填料:美国Amersham Biosciences公司;硫酸铵(色谱纯):生工生物工程(上海)有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1810紫外可见分光光度计:北京普析通用仪器公司;HYG-III回转式恒温调速摇瓶柜:上海欣蕊自动化设备公司;CR21GⅢ日立高速冷冻离心机:天美(中国)科学仪器有限公司;AKTAPrime蛋白纯化系统:美国GE公司;Octyl-Sepharose Fast Flow层析柱(1.6 cm×20 cm):上海锦华层析设备厂。
1.3 方法
1.3.1 粗酶液的制备
菌株的活化:将菌种接种到斜面培养基,在37℃的培养箱中培养24 h。
种子液制备:活化后的菌种接入装有25 mL种子培养基的250 mL三角瓶中,于36℃、180 r/min条件下的摇床中培养18 h。
发酵液制备:取2.4mL种子液接种到装有30mL发酵培养基的250 mL三角瓶中,在40℃,200 r/min的摇床中培养48 h。
粗酶液制备:发酵液经四层纱布过滤后,在8 000 r/min条件下离心20 min,取上清液备用。
1.3.2 蛋白含量的测定
参见Folin-酚试剂法(Lowry法)[13]测定蛋白含量。
1.3.3α-淀粉酶活测定
参见YOO J Y等[14-15]的方法测定α-淀粉酶活。
α-淀粉酶活定义:在pH 4.6、温度60℃条件下,5 min水解1mg可溶性淀粉(0.5%)所需的酶量为一个活力单位(U)。
相对酶活:酶活与相同反应条件下酶活最大值的比值(%)。
酶比活力:酶活与蛋白浓度的比值,用每毫克蛋白所含的酶活力单位数表示(U/mg)。
1.3.4 硫酸铵盐析
将5 mL上清液装入离心管中,在4℃条件下,分别缓慢加入饱和度为10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的硫酸铵,4℃静置过夜,经10 000 r/min冷冻离心20 min后,收集各管中的沉淀,测定不同硫酸铵饱和度条件下对应的蛋白浓度和α-淀粉酶活,绘制盐析曲线[16]。
1.3.5 Octyl-Sepharose Fast Flow柱层析
色谱方法及条件:平衡液为饱和度40%的硫酸铵溶液;洗脱液使用0.02 mol/L pH7.0磷酸缓冲液(phosphatic buffer solution,PBS);流速为2mL/min;上样量为15mL。样品上样后先用120 mL饱和度为40%的硫酸铵冲洗,然后用120 mL饱和度为40%的硫酸铵和等体积的0.02 mol/L pH7.0 PBS进行梯度洗脱(洗脱液中硫酸铵饱和度40%~0%),最后用0.02 mol/LpH 7.0 PBS洗脱,用自动部分收集器定时收集3 mL/管,检测各管收集液的蛋白吸光度值及α-淀粉酶活,收集酶活高的洗脱液[16]。
1.3.6 酶学性质研究
最适反应pH:采用pH为3.5~10.5的不同缓冲液配制反应体系,于55℃条件反应,并计算相对酶活力。
最适反应温度:酶反应体系于35~90℃条件下进行反应,并计算相对酶活力。
pH稳定性:酶液分别在不同pH(3.5~10.5)条件下处理1 h后进行酶反应,测定相对酶活。
温度稳定性:酶液分别在不同温度(35~90℃)条件下处理1 h后进行酶反应,测定相对酶活。
不同金属离子对酶活的影响:酶反应体系中添加0.5 mmol/L不同种类的金属离子(Ca2+、Mg2+、Fe2+、Zn2+、Cu2+、Mn2+、Co2+、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA))后,于最适pH和温度条件下进行酶反应,测定相对酶活。
1.3.7 数据处理
实验数据均为3次平行实验结果的平均值,图利用Excel软件进行数据处理得到。
2 结果
2.1 硫酸铵盐析
采用不同饱和度的硫酸铵对粗酶液进行盐析,测定硫酸铵沉淀中的蛋白浓度及酶活,制作盐析曲线,结果如图1所示。

图1 硫酸铵盐析曲线Fig.1 The curve of ammonium sulfate fractionation
由图1可知,硫酸铵饱和度低于40%时,目的酶蛋白沉淀的量很少,饱和度在40%~60%时,目的酶蛋白随硫酸铵量的增加开始大量析出,酶活同时迅速增大。当饱和度超过60%时,目的酶蛋白的析出量增加很少,酶活增加很小,而杂蛋白仍大量析出。硫酸铵饱和度为50%、60%和70%时酶活分别为804.7 U/mL、1 053.2 U/mL和1 115.5 U/mL。计算了各饱和度目的酶蛋白的比活力,50%饱和度的比活力为1 826.7,60%饱和度的比活力为1 617.6,70%饱和度的比活力1 173.0。综合考虑比活力及酶活,为了达到较好纯化效果而又减少酶活的损失。因此,选择使用60%饱和度的硫酸铵对发酵液进行盐析以沉淀回收目的酶蛋白。
2.2 Octyl-Sepharose Fast Flow柱层析
测定不同收集液的OD280nm值和酶活,制作疏水层析曲线,结果如图2所示。

图2 Octyl-Sepharose F F疏水层析曲线Fig.2 The elution curve of Octyl-Sepharose Fast Flow Hydrophobic chromatography
由图2可知,共出现三个蛋白峰,第一个峰在冲冼的阶段,是没有被疏水分离介质吸附上的蛋白质,峰值最大,OD280nm值为1.565,蛋白量最多。第二个峰在梯度洗脱过程中出现,是吸附在分离介质上的被一定浓度的PBS洗脱下来的部分蛋白,其峰值小,OD280nm值为0.432,蛋白含量少。第三个峰出现在用无硫酸铵的PBS冲洗的阶段,峰值最小,是吸附在分离介质上的结合力最强的少量蛋白。分别测定这三个蛋白峰对应的各管酶活,仅第一个峰有酶活,活性峰与蛋白峰几乎重合。说明酶没能被分离介质所吸附,在第一阶段被缓冲液洗下。而第二、第三个峰的蛋白均无酶活,属于杂蛋白峰。通过本次疏水层析达到了一定的纯化效果,去除了酶液中被疏水分离介质吸附的杂蛋白。
2.3 α-淀粉酶纯化结果
粗酶液、60%饱和度的硫酸铵对发酵液进行盐析沉淀后用蒸馏水溶解及Octyl-Sepharose Fast Flow柱层析洗脱液中各指标的测定结果见表1。

表1 a-淀粉酶的纯化结果Table 1 Purification results of α-amylase
2.4 酶学性质研究
2.4.1 酶反应最适pH及pH稳定性
不同pH对酶活的影响及pH稳定性结果见图3。由图3可知,酶在pH4.8时反应的活力最大,酶反应的最适pH值为4.8,在酸性条件pH 4.5~6.0范围内酶反应活力较高,相对酶活在75%以上。在中性条件pH 7.0条件下,相对酶活为66.2%,在碱性条件酶反应仍保持较高的活力,pH 9.0时的相对酶活为60.9%,pH10时的相对酶活为53.9%。结果表明,酶在pH 4.0~9.0的范围内相对稳定,相对酶活保持在90%以上,且在酸性环境pH 4.5条件下最为稳定。酶在pH 4.0条件下的相对酶活为91.8%,pH5.0条件下的相对酶活为98.2%,可见,该酶具有较好的耐酸性。

图3 反应pH对酶活性的影响及酶的pH稳定性Fig.3 Effect of reaction pH on enzyme activity and pH stability of enzyme
2.4.2 酶反应最适温度及热稳定性
不同反应温度对酶活的影响及酶的热稳定性结果见图4。由图4可知,酶反应温度为55℃时的活力最大,酶反应的最适温度为55℃。酶在50~65℃范围内反应具有较高活力,相对酶活在90%以上。当温度大于75℃时酶活急剧下降,75℃酶反应时的相对酶活为76.9%,90℃酶反应时的相对酶活只有44.1%。酶的热稳定性研究结果为,酶在35℃条件下最稳定,在温度低于45℃的条件下比较稳定,活力保持在35℃时酶活的90%以上,在高于60℃的条件下酶迅速失活,60℃条件下的残余酶活为65.5%,75℃条件下的残余酶活只有8.9%。

图4 反应温度对酶活性的影响及酶的热稳定性Fig.4 Effect reaction temperature of enzyme activity and temperature stability
2.4.3 金属离子对酶活的影响
以不添加金属离子时的酶活为对照,金属离子对酶活的影响结果见图5。由图5可知,Ca2+、Mn2+、Zn2+、Co2+对酶活有激活作用,其中Ca2+对酶的活性激活作用较强,活力比对照提高了17.8%。其余金属离子对酶的活性有一定的抑制作用,其中Fe2+和Fe3+的抑制作用较强,活力只为对照的88.2%和89.2%。
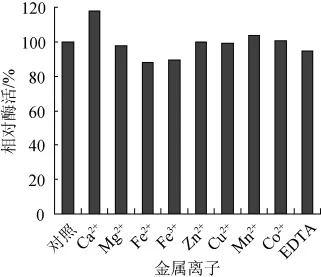
图5 不同金属离子对酶活的影响Fig.5 Effect of different metal ions on enzyme activity
3 结论
本研究采用硫酸铵盐析和疏水作用层析对菌株F21所产的α-淀粉酶粗酶液进行纯化并对其进行酶学性质研究。研究发现,该α-淀粉酶反应的最适温度为55℃,最适pH值为4.8,属于一种中温酸性α-淀粉酶。酶在pH 4.0~9.0及低于45℃的环境下比较稳定。Ca2+对酶的活性有较强的激活作用,Fe2+及Fe3+对酶的活性有较强的抑制作用。该α-淀粉酶对钙离子有依赖性,这与文献报道的多种酸性α-淀粉酶的特点是一致的。该α-淀粉酶稳定存在的pH范围广范,具有较好耐酸性的同时,在中性及偏碱性条件下也比较稳定,且在中性及偏碱性条件下的酶活仍保持在酸性条件下酶活的60%以上,使该酶具有一定的研究开发价值。
[1]孟宪梅,杜 承,秦亚楠.耐高温α-淀粉酶的分子生物学研究进展[J].吉林工商学院学报,2010,26(5):41-43.
[2]Reddy N S,Nimmagadda A,Sambasiva Rao K R S.An overview of the microbial α-amylase family[J].Afr J Biotechnol.2003,2(12):645-648.
[3]Kalpana Bandian S K.Halotolerant,acid-alkali stable,chelator resistant and raw starch digesting α-amylase from a marine bacterium Bacillus subtilis S8-18[J].J Basic Microbiol,2014,54(8):802-811.
[4]贾冬梅,华晓曼,王玉华.耐酸性α-淀粉酶研究进展[J].食品科技,2016,41(10):224-227.
[5]Gupta R,Gigras P,Mohapatra H,et al.Microbial α-amylases:a biotechnologicalperspective[J].ProcessBiochemistry,2003,38(11):1599-1616.
[6]李 松,王正祥.真菌α-淀粉酶的研究进展[J].生物技术通报,2011,27(3):66-70.
[7]Sharma A,Satyanarayana T.Microbial acid-stable α-amylases:Characteristics,genetic engineering and applications[J].Process Biochem,2013,48(2):201-211.
[8]石方方,焦国宝,丁长河,等.耐酸耐高温α-淀粉酶的研究进展[J].中国食品添加剂,2014,(4):171-176.
[9]屈建航,尹 伊,焦国宝,等.酸性α-淀粉酶菌株的筛选及其发酵条件研究[J].生物技术通报,2015,31(7):188-192.
[10]权淑静,解复红,马 焕,等.一株产酸性α-淀粉酶菌株的筛选及酶学性质研究[J].中国酿造,2014,33(5):104-108.
[11]郭宏文,王 艳,江成英,等.酸性α-淀粉酶菌种的诱变选育[J].江苏农业科学,2016,44(3):356-357.
[12]郭宏文,江成英,王 路,等.酸性α-淀粉酶菌种产酶条件的优化[J].江苏农业科学,2017,45(21):308-310.
[13]张龙翔,张庭芳,李令媛.生化实验方法和技术[M].北京:高等教育出版社,2002:137-138.
[14]Yoo Y J,Hong J,Hatch R T.Comparison of α-amylase activities from different assay methods[J].Biotechnology and Bioengineering,1987,30(11):147-151.
[15]史永昶,姜涌明,樊 飚,等.蛋白酶对解粉芽孢杆菌α-淀粉酶活力的影响[J].微生物学通报,1995,22(1):23-25.
[16]江成英,吴耘红.生物工程实验原理与技术[M].大连:大连理工大学出版社,2013:331-346.
