妊娠期代谢性疾病与运动介导的内质网自适应机制
2018-06-06朱小烽
朱小烽,马 云,叶 群,3,梁 辰,傅 姗,4
妊娠期代谢性疾病与运动介导的内质网自适应机制
朱小烽1,2,马 云1,叶 群1,3,梁 辰1,傅 姗1,4
1.国家体育总局运动医学研究所, 北京 100061; 2. 嘉兴学院师范学院, 浙江 314000; 3.上海体育学院 运动科学学院, 上海 200438; 4.温州医科大学 体育与健康学院, 浙江 325035
孕期代谢性疾病的共同特征是胰岛素抵抗发展为病理性的糖脂代谢紊乱,再进而导致血管内皮损伤、胎盘炎症和氧化应激状态增加。各种内源性和外源性细胞损伤都将引起内分泌器官(如胰腺和胎盘)的内质网应激。这种机体内环境受损可能会导致“胎儿编程”易感性,使得将来发展为代谢性疾病的风险增加。为了适应孕期代谢应激,运动可以刺激内质网实现新的代谢平衡。适宜的运动可以减轻氧化应激、炎症反应、线粒体功能障碍和钙离子失衡,这可能是重建孕期代谢性疾病中内质网平衡的潜在机制。
妊娠期糖尿病;内质网应激;先兆子痫;运动适应
在过去的20年中,肥胖、高血压和2型糖尿病的患病率在全球范围内急剧增加。久坐的生活方式、不平衡的饮食结构及遗传倾向是代谢性疾病的主要危险因素[18]。研究表明[18,69],成人阶段的疾病可以发生在胎儿期,母亲接触的不良环境可以在后期的生活中使子代感染疾病。“健康与疾病的发育起源”学说(Developmental Origins of Health and Disease Hypothesis,DOHaD)认为,不良的子宫内环境可能影响胎儿的代谢模式、生长发育及增加子代成年期罹患慢性疾病,如肥胖、心血管疾病、糖尿病等的风险[6]。
内质网(endoplasmic reticulum,ER)是在真核生物细胞中由膜围成的隧道系统,为细胞中重要的亚细胞器。负责蛋白的生物合成、折叠、组装和修饰加工(包括羟基化、糖基化、酰基化和二硫键形成等)[4]。实际上内质网是膜被折叠成一个扁囊或细管状构造,可分为粗面内质网(rough Endoplasmic Reticulum,rER)和光面内质网(smooth Endoplasmic Reticulum,sER)两种。粗面内质网上附着有大量核糖体,合成膜蛋白和分泌蛋白。光面内质网上无核糖体,为细胞内外糖类和脂类的合成和转运场所,同时与钙离子的运输息息相关,故与运动的关系更为密切[21]。
内质网应激(endoplasmic reticulum stress,ERS)是ER由于各种应激因素导致生理功能发生紊乱的一种亚细胞器的病理过程[4]。各类应激源都能促使内质网产生应激,包括热休克、糖耗竭、钙离子失衡或蛋白糖基化障碍等都会扰乱内质网的稳态,导致在内质网腔中未折叠和错误蛋白折叠的积累[22]。并导致一个复杂的信号网络——未折叠蛋白反应(unfolded protein response,UPR)的激活,以缓解ERS并促进细胞存活,其具体途径主要有3个[107]:1)通过减弱蛋白质翻译来减少新合成的蛋白质进入ER;2)通过上调ER相关基因表达增加蛋白质折叠能力;3)通过ER相关降解(ERAD)和溶酶体自噬使得错误折叠和未折叠蛋白质降解。以往的研究表明,在肥胖诱导的胰岛素抵抗和2型糖尿病中,ERS和UPR信号通路的激活扮演着重要的角色[23,81,107]。
由于体力活动的减少、饮食习惯的改变和遗传等因素,流行病学研究显示,近年来妊娠期糖尿病(gestational diabetes mellitus,GDM)、妊娠期高血压(hypertensive disorder complicating pregnancy,HDCP)和孕期代谢综合征(gestational metabolic syndrome,GMS)呈现逐年递增的趋势[102]。该类疾病的共同特征为胰岛素抵抗发展为病理性的糖脂代谢紊乱,再进而导致血管内皮损伤、胎盘炎症和氧化应激状态增加[49,95]。胎盘组织ER微环境中可能受到Ca2+的消耗,缺氧和N-末端糖基化的功能障碍的干扰,导致ERS[93]。这种子宫内环境受损可能会导致“胎儿编程”易感性,使得将来发展为代谢性疾病的风险增加(图1)。
近10年来,合理运动是围产期健康促进的研究热点之一,适宜的运动有助于改善胰岛素的敏感性、抗氧化应激和降低炎症等,在妊娠期代谢性疾病的防治中发挥着重要的角色,本文试对妊娠期代谢性疾病与运动介导的内质网自适应机制进行综述。
Figure1. The Fetal Programming of Metabolic Diseases
1 内质网应激调控细胞代谢稳态的基本作用机制
UPR属于细胞自适应机制[88],当出现错误折叠的蛋白质在内质网腔内积累后,刺激一系列的信号通路,恢复ER功能和保持内环境稳态的一个过程。UPR主要由3种跨膜蛋白所介导:双链RNA依赖的蛋白激酶样内质网类激酶[double-stand and RNA-dependent protein kinase (PKR) -like ER kinase, PERK],激活转录因子6(activating transcription factor 6, ATF6)和肌醇需求激酶(inositol requiring enzyme 1 alpha, IRE1α)[21,22,43,81,109]。在基础(非活动)状态下,这3种跨膜蛋白均与伴侣分子免疫球蛋白结合蛋白/葡萄糖调节蛋白78(B-cell immunoglobulin binding protein /glucose-regulated protein 78, Bip/GRP78)结合,处于无活性状态[41]。GRP78蛋白为热休克蛋白70(hot shock protein 70,HSP70)的家族成员,可以促进新生蛋白的正确折叠。当错误折叠和未折叠蛋白积累到一定阈值时,PERK、IRE1α和ATF6从Bip/GRP78释放,从而被激活[92]。
1.1 PERK通路与内质网应激
PERK是位于内质网膜上的一种Ⅰ型跨膜蛋白,具有丝氨酸/苏氨酸蛋白激酶活性。PERK敲除小鼠在胚胎期正常发育,但出生后出现异常,如高血糖症、低胰岛素血症、胰腺细胞死亡、动脉粥样硬化和生长迟缓等[121]。一旦出现内质网应激,PERK可以磷酸化真核细胞蛋白质翻译起始复合体2α(eukaryotic initiation factor 2α, eIF2α)[46]。eIF2α是PERK的主要底物,eIF2α磷酸化干扰了活性43S翻译起始复合物的形成并抑制了翻译过程[39]。eIF2α的丝氨酸-51残基是蛋白质功能磷酸化的重要位点,丝氨酸-51对丙氨酸(S51A)的突变可以减弱应激条件下的翻译抑制[46,100]。eIF2α中S51A突变的纯合子小鼠在胚胎和出生阶段都显示有胰岛β细胞的死亡,并且由于糖异生缺陷相关的低血糖在出生后18 h内死亡[98];而S51A突变的杂合子小鼠在给予高脂喂养后变得肥胖并具有糖尿病,并且由于胰岛素的分泌减少,它们显示出严重的葡萄糖耐受性降低,随着ER腔的异常扩张,胰岛素原运输不畅,胰岛β细胞中胰岛素颗粒数量减少[97]。此外,随后的研究也证实了eIF2α的几个重要功能,eIF2α磷酸化具有抑制β细胞中蛋白质合成的功能,通过翻译抑制是体内葡萄糖平衡和成熟β细胞存活所必需的;同时,eIF2α磷酸化所导致的翻译抑制是UPR基因、氧化应激反应基因和β细胞特异性基因最佳表达所必需的,如果有机体这种调控机能衰退则会导致ER膨胀和线粒体的损伤[46]。
eIF2α去磷酸化由两种不同的酶进行调节,生长停滞和DNA损伤诱导蛋白34(GADD34)和蛋白磷酸酶1[78]。GADD34的失活可防止eIF2α的去磷酸化,并阻止蛋白质合成的恢复,这通常在应激反应晚期被观察到。蛋白质合成恢复缺陷能有效抑制应激诱导蛋白的翻译,并且干扰GADD34突变细胞中应激诱导基因的程序化激活[79]。Salubrinal是eIF2α去磷酸化的选择性抑制剂,因此,它被提出作为胰腺β细胞的保护剂,然而,也有报道指出,Salubrinal能增强脂肪酸诱导的ERS,并引起胰腺β细胞的翻译抑制,胰岛素释放缺陷和胰腺β细胞的凋亡[29,48,114]。
当PERK被ERS激活时,大多数mRNA的翻译通过eIF2α的磷酸化作用被抑制,但也选择性地提高翻译激活转录因子4(ATF4)[4,83]。导致下游基因C/EBP同源蛋白(GADD153)的诱导。ATF4在不同的途径中具有不同的生物调控效应,ATF4激活涉及蛋白质合成和折叠、运输营养、机体代谢、氧化还原调节和细胞凋亡的某些基因的转录[56,106]。ATF4基因敲除小鼠显示出明显的新生鼠贫血症状,大多数在出生后的头3个星期死亡,幸存的也通常不具有生育能力[70]。由于ATF4是不同eIF2特异性激酶的常见下游靶标,因此,活化的eIF2α/ATF4途径产生的效应通常称为综合应激反应(integrated Stress Response,ISR)[42]。ISR期间肾上腺髓质素2(adrenomedullin 2,ADM2)基因受ATF4调控,ADM2基因的高表达可以被认为是线粒体呼吸链受到抑制[56]。同样,基因C/EBP同源蛋白(CHOP/GADD153)也受ATF4的转录调控[38]。而CCAAT/增强子结合蛋白(CHOP)在ERS环境下可作为凋亡诱导剂起作用,CHOP基因缺陷型小鼠比野生型小鼠表现出更少的程序性细胞死亡[122]。真核细胞翻译起始因子4E(eukaryotic translation initiation factor 4E,eIF4E)结合蛋白1(4E-BP1)基因也受ATF4的调控与转录,4E-BP1基因敲除小鼠显示出低血糖、白色脂肪组织减少和代谢率增加的现象[55]。另外一份研究也指出,4E-BP1表达的异常增加可诱导β细胞凋亡,并表明高密度脂蛋白参与下调4E-BP1,与胰腺β细胞的保护有关[87]。
1.2 IRE1通路与内质网应激
IRE1是属于内质网N型跨膜蛋白,不仅具有丝氨酸/苏氨酸蛋白激酶活性,此外还具有位点特异性的核酸内切酶活性[21]。IRE1具有IRE1α和IRE1β两个亚型,IRE1α在胰腺组织中大量存在,而IRE1β只存在胃肠道的上皮细胞中[21]。当细胞培养过表达时,IRE1α可以有效激活Bip的转录,而IRE1β则导致强烈的凋亡[45]。IRE1α基因敲除的小鼠胚胎就显示死亡,而IRE1β敲除的小鼠以类似Mendelian率出生,发育正常,具有正常的生育能力和生殖行为[103]。体内成像显示,通过XBP1的剪接,IRE1α在胰腺和胎盘中生理活化,IRE1α的丧失导致严重的胎盘功能障碍[44]。
另外有研究也证实了IRE1α在肝脏发育、B细胞分化及胰岛素生物合成中具有重要作用[65,120]。IRE1α磷酸化与胰岛β细胞中的胰岛素生物合成结合,对机体瞬间暴露于高糖环境做出反应;相反,在胰腺β细胞中敲除IRE1α或抑制IRE1α磷酸化将阻止胰岛素的生物合成[65]。在另一项关于IRE1α介导胰岛素mRNA降解机制的研究中,在轻度ERS条件下发现IRE1α通过XBP1剪接传递蛋白信号,而在严重的ERS下,通过ER定位的mRNA衰变传递凋亡信号[35]。
IRE1α也参与胰腺β细胞的NO信号传递和IL-1β信号传导,NO是腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)的有效活化剂,其参与胰腺β细胞中NO介导的损伤性防御。在轻度ERS下,通过增加胰腺β细胞中的NF-kB活化来激活IL-1β信号传导[72]。
XBP1最初被认为是调控主要组织相容性复合物Ⅱ类基因表达的转录因子[42]。近年来,XBP1被报道在预防氧化应激以及ERS方面发挥了重要的调节作用[72]。XBP1与磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)的p85调节亚基相互作用,促进了在ERS条件下XBP1的核易位和UPR诱导,PI3K也是胰岛素代谢作用的重要介质,p85通过胰岛素刺激从催化亚单位(p110)解离[84]。XBP1的轻度激活以叉头框蛋白O1(FoxO1)依赖的方式增强葡萄糖耐量[58]。XBP1也被p38丝裂原活化蛋白激酶(p38 MAPK)介导的磷酸化调控[58]。
ERS期间,IRE1与肿瘤坏死因子受体相关因子2(TNF receptor-associated factor 2,TRAF2)结合,IRE1α-TRAF2复合物与Jun氨基端激酶(Jun N-Terminal kinase,JNK)和IkB激酶(IkB kinase,IKK)相互作用并最终激活它们[21]。激活的JNK磷酸化转录因子激活蛋白1(activator protein 1,AP1);激活的IKK降解IkB,从而释放NF-kB,导致促炎因子的表达[21];此外,AP1的激活入核也能诱导炎症相关基因的转录[50](图2)。细胞凋亡信号调节激酶1(apoptosis signalregulating kinase 1,ASK1)与TRAF2直接相互作用并介导JNK通路的激活[77]。此外,通过对肝细胞特异性TRAF2基因敲除的小鼠研究发现,TRAF2通过对胰高血糖素的高血糖反应促进肝脏糖异生,使得肥胖症中的高血糖症患病风险升高[19]。ASK1基因常规敲除的小鼠以Mendelian比率出生,与野生型的外观无差异,在其发育阶段也没有表现出组织与形态学异常[101];另一方面,据报道,ASK1介导内皮细胞中高葡萄糖诱导的细胞衰老,ASK1缺乏可减轻胰岛素抵抗、心脏炎症纤维化以及肥胖引起的血管内皮功能障碍[110,113]。
当ERS时,激活的IRE1α在低聚反应和磷酸化的作用下,内切核糖核酸酶活性,去除转录因子X盒结合蛋白1(X-box binding protein 1,XBP1)上的一个26碱基的内含子,产生具有活性的转录因子XBP1s,XBP1s与ATF6共同启动转录,诱导内质网相关性死亡(endoplasmic reticulum associated degradation,ERAD)相关因子的表达[11](图2)。

图2 内质网应激通路图
Figure2. Endoplasmic Reticulum Stress Pathway
注:改编自Hotamisligil[42],作图软件来源于Servier Medical Art(http://www.servier.com)。
1.3 ATF6通路与内质网应激
在哺乳动物中,ATF6有两种基因:ATF6α和ATF6β[40]。ERS时,ATF6与GRP78解离,需要移动ATF6到高尔基体上,由丝氨酸蛋白酶的位点1(site-1 protease,S1P)和金属蛋白酶的活性位点2(site-2 protease,S2P)分割后激活转录因子,通过多种途径影响着UPR[21]。包括蛋白质合成减少,上调分子伴侣和其他蛋白的表达,这些将有助于重新恢复内质网的稳态,降解错误折叠和未折叠的蛋白,触发炎症和胰岛素抵抗[88]。此外,研究报道,ATF6α具有保护β细胞免受ERS并抑制肝脏硬化。它还在高脂血症和胰岛素抵抗中发挥着重要的作用[2]。ATF6α基因敲除小鼠表现有对葡萄糖的耐受性降低,胰岛素分泌受损,胰腺中胰岛素含量降低,肝脏脂肪变性等病理特征[119]。ATF6通过与环磷酸腺苷反应元件结合蛋白(CREB)转录共激活因子2(CREB-regulated transcription coactivator,CRTC2/ TORC2)的相互调节,作为糖异生酶的关键调节剂在调控机体的脂代谢中发挥着重要的作用[36,66,105]。ATF6的激活可以通过破坏CREB和CRTC2之间的相互作用来减少肝脏葡萄糖输出,从而抑制CRTC2对参与糖异生的基因启动子的占据,因此,肥胖动物肝脏中ATF6的过度表达似乎有利于逆转CRTC2对葡萄糖异生的作用[105]。类似地,还有报道ATF6通过抑制CREB活性从而来抑制cAMP刺激的肝脏糖异生[99]。而运动的自适应机制则是骨骼肌PGC-1α通过ATF6α的共激活介导肌管和骨骼肌中的UPR[108]。
固醇调节元件结合蛋白(sterol RegulatoryElement Binding Protein,SREBP)属于核转录因子家族,是脂肪合成基因重要的转录调节因子,SREBP家族的转录因子驻留在ER中。在低固醇水平或胰岛素应答中,SREBP蛋白转运到高尔基体并被加工成活性转录因子[119]。SREBP蛋白的激活也在ERS过程中发生,对于调节参与胆固醇代谢(SREBP1α、SREBP2)或脂质合成(SREBP1c)的靶基因至关重要[31]。事实上,SREBP转录因子可能是脂质代谢与UPR整合的关键介质[42]。当ER膜缺乏脂质或固醇时,SREBP切割活化蛋白(SREBP-SCAP)复合物与胰岛素诱导基因1(insulin-induced gene 1,Insig-1)分离,因此,SCAP护送SREBPs从ER到高尔基体[9,24]。SREBPs被高尔基体中的S1P和S2P切割,切割的N-末端转移到细胞核中以激活参与胆固醇和脂质生物合成和代谢的基因[42](图2)。ATF6和SREBPs都是ER膜结合的转录因子,研究证实了ATF6可以抑制SREBP2在肝细胞中对脂肪生成的调节[119]。
2 孕期代谢性疾病与内质网应激
随着妊娠的发展,孕妇体内新陈代谢将发生一系列的变化。在妊娠24~28周左右,母体外周骨骼肌会逐渐出现生理性的胰岛素抵抗,直至分娩[95]。研究发现,孕期胎盘会分泌一系列的多肽激素、生长因子、细胞因子来调节母体代谢和胎儿生长发育[18,61]。人胎盘泌乳素(human placental lactogen,hPL)和催乳素诱导母体胰腺中的β细胞扩增和胰岛素释放,而人胎盘生长激素(human placental growth hormone,hPGH)和脂肪因子引起外周胰岛素抵抗[5]。孕期母体血清中hPL和hPGH浓度分别增加30和8倍[37]。这种正常的胰岛素抵抗过程可以保障骨骼肌对葡萄糖的摄入减少,将孕妇血糖维持在一个较高的水平,有助于满足胎儿生长发育所需。为满足胰岛素需求增加,孕妇胰岛B细胞会主动分泌胰岛素,来代偿外周组织中生理学的胰岛素抵抗现象。胰岛素分泌受限的孕妇,由于无法代偿这种生理变化,进而使得血糖升高,最终可能导致GDM。同时,妊娠期母体脂质代谢的异常也较为常见。
胎盘分泌由胎盘特异性上游增强子调控的瘦素和脂联素用于调节母体脂质代谢,在正常怀孕期间,这些因素有利于母体能量资源的重新分配[17]。然而,胎盘功能的扰动则可能破坏其活性,使得母体代谢的正常平衡遭到破坏,最终导致某些代谢性疾病的发生,如:肥胖、代谢综合征、GDM、先兆子痫等[32,82]。已有研究表明,UPR途径与细胞营养感知机制以及糖脂代谢密切相关,而具有高多肽内分泌活性的器官(如胰腺和胎盘)容易导致ERS[73,83]。ERS与孕期脂质代谢的关系也是双向的,ERS通路的激活可以导致脂肪生成和改变体内的脂质平衡,而脂质代谢异常同样也会引起ERS[34]。孕期高脂饮食诱导的ERS条件下,eIF2α的磷酸化和PERK途径的激活允许通过诱导C/EBPα的降低和减少Insig1蛋白翻译来增加脂质的生成。然而,在长时间的ERS中,CHOP可能导致C/EBPs的失调[7];类似的高糖饮食诱导的ERS环境下C/EBPα的激活依赖于XBP1的高表达。此外,在妊娠期代谢性疾病导致的ERS中,XBP1和ATF6对PPARα、PGC1α介导的载脂蛋白B和脂肪酸氧化途径的激活都是至关重要的[7]。饱和脂肪酸,如棕榈酸,是各种类型细胞中已知的ERS诱导剂,可以调节细胞的存活和凋亡相关信号。因此,ER是继线粒体外又一治疗妊娠期代谢性疾病的重要靶点。
GDM是指在妊娠过程中初次出现的糖耐量异常,是妊娠期间最常见的代谢异常疾病。GDM对于母婴健康均具有严重影响,一方面易增加妊高征、酮症酸中毒、以及增加剖宫产率等方面的风险;另一方面可导致胎儿呼吸窘迫、早产以及新生儿低血糖等,后代容易出现肥胖、糖耐量受损等现象。GDM和妊娠肥胖的主要特征是炎症和内毒素血症[67]。各种内源性和外源性细胞损伤,如病毒感染、无菌性炎症和环境毒素都可引起ERS,从而诱导妊娠中参与免疫反应的促炎细胞因子、趋化因子和其他介质的表达[53]。越来越多的证据显示,ERS在调节炎症和胰岛素抵抗中起着关键的作用[60,63,68]。IL-1α和IL-β是重要的促炎因子,能抑制GDM妇女脂肪细胞中的胰岛素信号通路,加强了外周胰岛素的抵抗和炎症的活化[63,67]。ERS中,尤其是IRE1通路已被证明可诱导IL-1β的炎性体依赖性分泌[53]。因此,抑制ERS诱导产生的IL-1,可能是改善母体肥胖和妊娠代谢性疾病潜在的治疗方法[63]。Liong[64]用ERS抑制剂牛磺脱氧胆酸(tauro-ursodeoxycholic acid,TUDCA)下调IRE1α和GRP78基因,显著降低了脂多糖(lipopolysaccharide,LPS)和聚肌苷酸-聚胞苷酸(polyinosinic- polycytidylic acid,[Poly(I:C)])等导致的IL-6、IL-8、IL-1β和MCP-1,再次证实了人类骨骼肌中ERS诱导的炎症和胰岛素抵抗过程参与了GDM的发展。
由于有效的UPR防止了细胞的凋亡,GDM胎盘和胎儿的过度生长可能与凋亡途径激活减少有关[8,47]。由此,UPR也被认为构成了胎盘功能不良的标志。Belkacemi发现,GDM胎盘的细胞凋亡指数明显低于对照组,而葡萄糖转运蛋白(SLC2A)比对照组高出了3倍,SLC2A高表达与胎盘的巨噬细胞发挥作用有关[8]。与之类似,Farias研究还发现,GDM孕妇脐静脉内皮细胞和脂肪细胞中人类CHOP同源蛋白(hCHOP)高于对照组,且与SLC29A1启动子的活性降低有关[25]。ER稳态受损也与GDM有关,如,GDM患者中脐静脉内皮细胞中CHOP表达增加,也在一定程度上表明了ERS与胎盘脉管系统中血管生成之间的潜在联系[34]。最近的研究也证实了代谢性酸中毒不是高血糖所引起,而是GDM胎盘中ERS引起的[116]。综上所述,ERS和UPR信号分子在保持胎盘功能稳态和预防GDM中发挥着重要的作用。
氧化应激是GDM与先兆子痫的主要病因[90],氧化应激也是胎盘ERS的强诱导者[47,115]。此外,先兆子痫中也存在胎盘细胞氧化应激的现象[15]。胚胎植入、血管生成和胎盘发育等都会产生活性氧(ROS)和氮,主要通过线粒体途径或通过黄嘌呤脱氢酶蛋白水解切割成黄嘌呤氧化酶形式导致ROS的产生[15];其次,蛋白质折叠本身就是产生ROS的氧化事件。因此,高分泌负担或反复尝试重折叠可能导致ROS在细胞内的浓度升高[15]。此外UPR可以激活一些与氧化应激相同的细胞内炎症信号通路。PERK-Nrf2和IRE-CHOP是细胞在ERS下的两种不同转归途径,PERK-Nrf2上调抗氧化酶表达,而IRE-CHOP则促进细胞凋亡[115]。Muralimanoharan发现,GDM患者胎盘中乳酸脱氢酶增加,强调了合成代谢途径活化与线粒体功能障碍的相关性,其中miR-143起到了关键的介导作用[75]。而线粒体功能障碍与氧化应激密切相关,两者影响着GDM患者的胎盘[57]。线粒体产生的ATP被认为是大多数真核细胞的主要能量来源,在胎盘的滋养细胞中,它们具有作为类固醇激素合成及参与胆固醇转运和代谢的重要功能。在滋养层的细胞分化过程中线粒体也发生了形态学的改变,典型的类固醇生成细胞的管状嵴通常在妊娠后期的合体滋养层中广泛存在,同时伴有大量的ER[14]。此外,严重的先兆子痫患者胎盘中分离的线粒体显示出显著的形态学改变[57]。胎盘线粒体和内质网稳态的扰动因此可能驱动不同的下游代谢效应。
Yung团队研究证实,利用维生素等抗氧化剂对高糖诱导的胎盘ERS有积极的预防效果[116]。因此,外源性抗氧化剂的补充对改善GDM患者胎盘ERS具有积极的临床意义[47]。此外,Cheng研究推测,GDM会改变胎儿内皮细胞的氧化还原蛋白质组,导致受损的核转录因子Nrf2介导抗氧化防御[20]。Nrf2在维持线粒体功能和保护细胞免受ERS中起着关键的作用。GDM胎儿内皮细胞中氧化还原信号传导的持续缺陷将破坏细胞对子宫内氧化应激的防御,使子代在后期的生活中增加2型糖尿病和心血管等代谢性疾病的风险[20]。这在一定程度上也提示了Nrf2诱导物有可能成为有潜力的基因靶向治疗药物。迄今为止的研究表明,无氧糖酵解作为一种基本机制与母体糖尿病、胎盘和胎儿发育中的损伤密切相关,而有氧运动联合抗氧化剂更能提高机体抗氧化酶的活性。抗氧化治疗的效果取决于运动强度[89]。时下,妊娠期运动抗氧化的研究还鲜有报道,对有氧运动抗氧化作用剂量与效应的探索仍然是今后研究的重点。
3 运动介导的孕期代谢性疾病与内质网自适应机制
妊娠过量的脂质积累引起脂毒性和炎症,运动则是防治代谢性疾病的有效方法之一。较多研究已证实运动可以增加骨骼肌葡萄糖转运蛋白、抗氧化剂和脂肪酸氧化酶活性。研究认为,运动对UPR的改善机制是运动介导的代谢适应[80]。而长期运动对孕期代谢益处与妊娠期久坐生活方式引起的病理变化的具体分子机制尚未完全厘清。
Kim发现,运动后ERS在人类骨骼肌中被激活,与安静状态下相比,在完成200 km比赛后的3 h,BiP蛋白表达、ATF4 mRNA水平、XBP1的拼接和未拼接水平都显著增加[51]。由于急性运动后骨骼肌中炎症和氧化应激被激活,UPR的增加和蛋白酶体活性的降低,变成了细胞应激后的应对机制[59]。运动后UPR的激活是对当前应激状态的保护机制,这在WU的研究中予以证实[108],在一次中等强度的运动后小鼠骨骼肌中的UPR被激活,但在几次训练之后,UPR一些标志物的激活减少,有些甚至被抑制。值得注意的是,在四头肌和腓肠肌中UPR被激活,而在非负重条件下,竖脊肌或心脏中UPR没有明显的改变。这意味着,肌肉收缩施加的机械应力或直接参与运动的肌肉产生一些代谢改变,在UPR活化过程中起着重要的作用。
此外,运动对疾病的防治效果和它诱导的生物反应与运动的强度密切相关,生物学反应根据运动强度的变化而变化,因此诱导不同程度的ERS。研究者对比了两组不同强度的运动,5周后发现,大强度的运动训练增加了线粒体的生物合成并降低了ERS和大鼠骨骼肌组织细胞凋亡的信号传导[52]。运动对ERS的影响具有一定的组织特异性,如,自主运动可以有效上调下丘脑、海马和皮层区域中的UPR相关蛋白表达,而长期强迫性游泳训练使得高脂诱导小鼠的脂肪组织中PERK和elF2α磷酸化降低[85]。但是,运动对妊娠期代谢密切相关的骨骼肌、胰腺、胎盘和肝脏等组织的影响如何,现阶段的研究还较为匮乏,还需我们进一步审查运动形式、运动种类、组织影响和UPR反应阶段等方面的关系。
GDM和先兆子痫被认为是孕期糖脂代谢异常相关的代谢综合征表征[13]。氧化应激被认为与妊娠期代谢性疾病的发病有关,脂质过氧化物的增加导致内皮功能障碍是其主要原因[33],一氧化氮(NO)的生物利用度降低也是发病机理之一[112]。研究者认为,长期有氧运动对氧化应激和内皮细胞功能有积极的调节作用,是妊娠期代谢性疾病良好的非药物性治疗方式[112]。已有研究证实,有氧运动可以显著地降低受试者的血压和氧化应激,但如果运动强度过大则可能损伤内皮细胞[3]。这种机制类似于孕期运动剂量与健康效应之间的“U”型效应(图3)即中等强度的运动负荷时拥有最佳的健康效应。而在实际的运动过程中,孕期女性,尤其是代谢性疾病人群的运动负荷有别于常人。虽然美国妇产科医师学会(American College of Obstetricians and Gynecologists,ACOG)推荐的每周150 min中等强度的有氧运动[1],而对于妊娠期患有代谢性疾病的人群而言,这种“中等强度”的界限还需要更加合理和科学的界定。其次,运动对氧化应激与抗氧化应激之间本身就存在一种共生关系,除抗氧化应激外,运动本身就产生ROS,其潜在来源包括线粒体的呼吸链,超氧化物的黄嘌呤氧化酶产生、一氧化氮合成、儿茶酚胺氧化和嗜中性粒细胞诱导的氧化刺激[3]。机体在这种被氧化与抗氧化的过程中导致组织抗氧化防御机制的上调,而Gounder指出,运动诱导机体抗氧化能力的提高,极有可能与Nrf2介导的ERS改善有关[30]。最新研究显示[96]:4周运动诱导了AMP活化蛋白激酶(AMPK)和随后的过氧化物酶体增殖物激活受体δ(PPARδ)的激活,有助于改善血管内皮细胞的ERS,该研究也揭示了运动有助于PPARδ介导的ERS抑制,并为治疗妊娠期代谢性血管病变提供了潜在的有效靶标。

图3 孕期运动剂量与健康效应
Figure 3. The Relationship of Exercise Dose and Health Effects During Pregnancy
注:改编自Mottola M F[74],当孕期久坐不动或超过一定的运动负荷对子代与母体都会产生健康的负向效应,尤其是胎儿健康效应对运动的敏感性更甚母体本身。
ERS中的炎症通路也是孕期代谢性疾病发生与发展的一个关键位点[42]。ERS中与炎症相关的信号通路主要有JNK-AP1和IKK-NF-kB途径(图4)。几项研究都表明了运动可以反转炎症细胞因子的mRNA表达模式,在妊娠期糖尿病人群中,单核细胞趋化蛋白-1,纤溶酶原激活物抑制剂-1和IKKβ在脂肪组织中高表达[85]。作为一种抗炎分子,热休克蛋白70(HSP70)可以减少炎症介质在不同炎症模型中的释放,HSP70可以与NF-kB相互作用以发挥这种抗炎作用[28]。研究证实,在无氧阈强度下持续4 min的单次运动即可使得HSP70 mRNA表达显著升高[12]。此外,运动降低了脂肪、胰腺和肝脏中的TNF-α、IL-6和Toll样受体4的表达水平,运动锻炼具有较好的抗炎作用[71]。体力活动可以较好地阻止大鼠肝脏和脂肪组织中NF-kB磷酸化水平的升高。在JNK敲除的小鼠中,肥胖诱导的促炎因子如TNF-α、IL-6和MCP-1等的表达也被抑制[104]。IRE-1α和PERK分支可以导致NF-kB-IKK通路的激活[42],JNK和IKK的激活通过使胰岛素受体底物(IRS1和IRS2)丝氨酸磷酸化从而抑制胰岛素作用。值得注意的是,这些途径的激活在孕期代谢异常和胰岛素机制中发挥着重要的作用。孕期过量的营养物质本身可以作为诱导ERS的信号,其与炎性信号通路的激活直接相关。如,GDM中游离脂肪酸的代谢和运输障碍,过量的游离脂肪酸诱导肌细胞、胰腺β细胞、肝细胞和胎盘细胞中产生炎症[54]。白介素15(IL-15)作为骨骼肌葡萄糖摄取和利用的循环肌源性细胞因子被一些研究所发现。作为免疫调节因子,IL-15被认为能增加骨骼肌中的葡萄糖摄取,改善骨骼肌胰岛素敏感性[16,111]。Yang等研究发现,跑台运动促进了高脂诱导的胰岛素抵抗(IR)大鼠骨骼肌IL-15和IL-15受体α(IL-15Rα)的表达,IL-15对ERS的抑制作用可能与运动训练对胰岛素敏感性的改善有关[111]。但是,IL-15对于妊娠期胰岛素敏感性的直接作用仍未彻底阐明。另外,线粒体损伤衍生的ROS是炎症小体形成的主要触发因素,Peeri等认为,运动对自噬过程的增强加速了损伤线粒体的消除,从而导致ROS和无菌性炎症的降低[86](图4)。因此,线粒体的稳定更新对于正常和健康的线粒体表现至关重要。研究证实,孕期经常性运动还能增加骨骼肌线粒体的数量[112]。线粒体生物发生也被证明在控制UPR过程中具有关键的作用,转录共激活因子PGC-1α是一种关键的调控因子,在维持线粒体功能,机体氧化代谢和能量稳定的过程中发挥着重要的调控作用[27,62,76,117,118]。运动过程中涉及了骨骼肌功能的调节,这对全身代谢的平衡起着重要的作用。在GDM等妊娠期代谢性疾病中常伴随骨骼肌线粒体功能障碍及骨骼肌中PGC-1α和PGC-1β水平的降低[91]。此外,发现PGC-1α是通过ATF6共激活介导肌管和骨骼肌中的UPR,其中包括激活ATF-4和CHOP等分子标记改善机体的ERS。从而推断一些骨骼肌特异性因子可能存在或者影响着PGC-1/ATF6蛋白复合物的功能。而运动诱导的PGC-1α表达可能在疾病的自适应机制中发挥着重要的角色[94]。CA2+/钙调蛋白依赖性蛋白激酶4(CaMK4)在运动的代谢适应中具有重要的调节作用,这可能也与PGC-1α基因的转录控制有关[26]。因此,骨骼肌中线粒体、ERS及运动三者之间的耦合关系还需进一步的厘清。
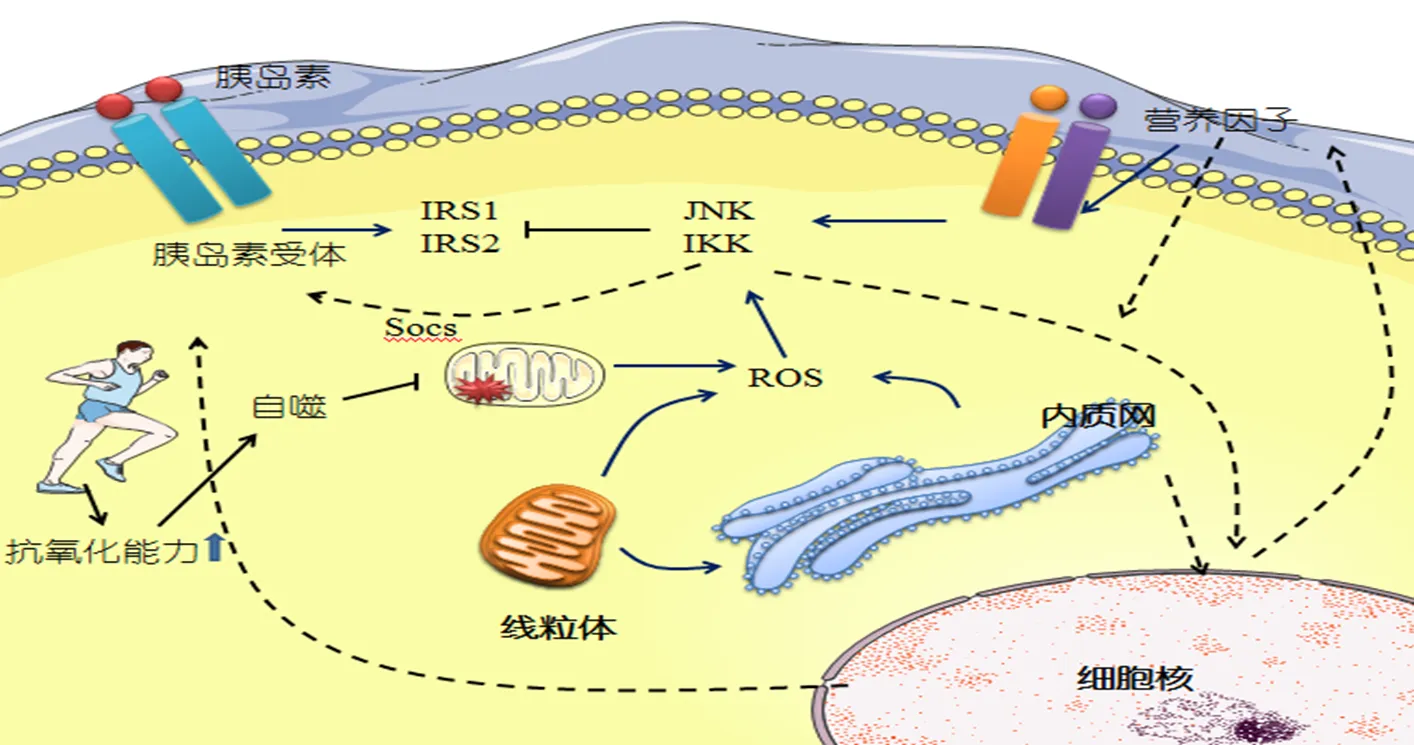
图4 运动、炎症与应激
Figure4. Exercise, Inflammation and Stress
随着“Sports is Medicine”(运动即良医)理念的深入,拓展了运动对孕期代谢性疾病的防治认识的新思路。孕期是否可以借鉴Booth和Laye所建议的那样[10],用“运动药丸”来模拟产生与运动类似的分子效应,笔者认为这种代谢调节的药丸疗法在现阶段还是难以实现的,因为运动对人体带来的是多重的代谢效应与免疫应答,不仅仅是几种简单分子效应的组合。
4 结语
为了适应孕期代谢应激,运动可以刺激ER实现新的代谢平衡。适宜的运动可以减轻氧化应激、线粒体功能障碍和钙离子失衡,这可能是重建孕期代谢性疾病中ER平衡的潜在机制。
运动介导的妊娠期代谢性疾病中UPR调节作用的研究仍然较少,其机制仍未彻底阐明,探索孕期代谢性疾病与运动介导的改善机制还需更多的研究。运动作为有效的非药物预防和治疗手段,不同的妊娠期代谢性疾病模型,不同的干预方式(如运动类型、运动强度、持续时间等)可能存在不一致的结果。与机体在运动后UPR标志物的增加相比,其相应减少的效应到底如何?运动如何有效地诱导下游通路的增加,而选择性地减少其他UPR标记?这些都是今后运动与孕期健康促进领域所需要探索和研究的问题。
[1] ACOG. ACOG Committee opinion:Exercise during pregnancy and the postpartum period[J]. ObstetGynecol,2002, 99(1):171-173.
[2] ARAGON I V, BARRINGTON R A, JACKOWSKI SThe specialized unfolded protein response of B lymphocytes: ATF6alpha-independentdevelopment of antibody-secreting B cells[J]. Mol Immunol,2012, 51(3-4):347-355.
[3] AVLONITI A, CHATZINIKOLAOU A, DELI C KExercise-induced oxidative stress responses in the pediatric population[J]. Antioxidants,2017, 6(1):1-16.
[4] BACK S H, RANDAL J. KAUFMAN. Endoplasmic reticulum stress and type 2 diabetes[J]. Annu Rev Biochem,2012, 81:767-793.
[5] BARBOUR L A, SHAO J, QIAO LHuman placental growth hormone causes severe insulin resistance in transgenic mice [J]. Am J ObstetGynecol,2002, 186(3):512-517.
[6] BARKER. Fetal and infant origins of adult disease[J]. MonatsschrKinderh,2001, 149(Sup1):s2-s6.
[7] BASSERI S, AUSTIN R C. Endoplasmic reticulum stress and lipid metabolism: Mechanisms and therapeutic potential[J]. BiochemResInt,2012, 2012:1-13.
[8] BELKACEMI L, KJOS S, NELSON D MReduced apoptosis in term placentas from gestational diabetic pregnancies[J]. J Dev Orig Health Dis,2013, 4(3):256-265.
[9] BENNETT M K, SEO Y K, DATTA SSelective binding of sterol regulatoryelement-binding protein isoforms and co-regulatory proteins to promoters for lipid metabolic genes in liver[J]. J Biol Chem,2008, 283(23):15628-15637.
[10] BOOTH F W, LAYE M J. Lack of adequate appreciation of physical exercise's complexities can pre-empt appropriate design and interpretation in scientific discovery[J]. J Physiol,2009, 587(23):5527-5539.
[11] BOURDIER G, ARNAUD C, BELAIDI-CORSAT ERole of endoplasmic reticulum stress in the deleterious cardiovascular consequences of chronic intermittent hypoxia. Beneficial effects of high-intensity interval training[J]. ArchCardiovasc Dis Suppl, 2015, 7(2):206.
[12] BRUDER G, JARASCH E D, HEID H W. High concentrations of antibodies to xanthine oxidase in human and animal sera. Molecularcharacterization,[J]. J ClinInvest,1984, 74(3):783-794.
[13] BURTON G J, YUNG H W. Endoplasmic reticulum stress in the pathogenesis of early-onset pre-eclampsia[J]. Pregnancy hypertens, 2011, 1(1-2):72-78.
[14] BURTON G J, YUNG H W, MURRAY A J. Mitochondrial–Endoplasmic reticulum interactions in the trophoblast: Stress and senescence[J]. Placenta,2017, ( 52):146-155.
[15] BURTON G J, YUNG H W, CINDROVA-DAVIES TPlacental endoplasmic reticulum stress and oxidative stress in the pathophysiology of unexplained intrauterine growth restriction and early onset preeclampsia[J]. Placenta,2009, 30 (Suppl A)S43-48.
[16] BUSQUETS S, FIGUERAS M, ALMENDRO VInterleukin-15 increases glucose uptake in skeletal muscle. An antidiabetoge-nic effect of the cytokine[J]. Biochim Biophys Acta, 2006, 1760 (11):1613-1617.
[17] CALLAWAY L K, COLDITZ P B, BYRNE N MPrevention of gestational diabetes: feasibility issues for an exercise intervention in obese pregnant women[J]. Diabetes care,2010, 33(7):1457-1459.
[18] CHALK T E, BROWN W M. Exercise epigenetics and the fetal origins of disease[J]. Epigenomics,2014, 6(5):469-472.
[19] CHEN Z, SHENG L, SHEN HHepatic TRAF2 regulates glucose metabolism through enhancing glucagon responses[J]. Diabetes,2012, 61(3):566-573.
[20] CHENG X, CHAPPLE S J, PATEL BGestational diabetes mellitus impairs Nrf2-mediated adaptive antioxidant defenses and redox signaling in fetal endothelial cells in utero[J]. Diabetes, 2013, 62(12):4088-4097.
[21] DELDICQUE L, HESPEL P, FRANCAUX M. Endoplasmic reticulum stress in skeletal muscle: Origin and metabolic consequences [J]. Exerc sport Sci Rev,2012, 40:43-49.
[22] DELDICQUE L, HESPEL P, FRANCAUX M. Endoplasmic reticulum stress in skeletal muscle: origin and metabolic consequences[J]. Exerc Sport Sci Rev,2012, 40(1):43-49.
[23] EIZIRIK D L, CARDOZO A K, CNOP M. The role for endoplasmic reticulum stress in diabetes mellitus[J]. Endocr Rev,2008, 29(1):42-61.
[24] FANG D L, WAN Y, SHEN WEndoplasmic reticulum stress leads to lipid accumulation through upregulation of SREBP-1c in normal hepatic and hepatoma cells[J]. MolcellBiochem, 2013, 381(1-2):127-137.
[25] FARIAS M, PUEBLA C, WESTERMEIER FNitric oxide reduces SLC29A1 promoter activity and adenosine transport involving transcription factor complex hCHOP-C/EBPalpha in human umbilical vein endothelial cells from gestational diabetes[J]. Cardiovasc Res,2010, 86(1):45-54.
[26] FERRARO E, GIAMMARIOLI A M, CHIANDOTTO SExercise-induced skeletal muscle remodeling and metabolic adaptation: redox signaling and role of autophagy[J]. Antioxid Redox Signal,2014, 21(1):154-176.
[27] FURRER R, HANDSCHIN C. Exercise and PGC-1α in Inflammation and Chronic Disease[J]. Dtsch Z Sportmed,2015, 66(12):317-320.
[28] GOLBIDI S, BADRAN M, LAHER I. Antioxidant and anti-inflammatory effects of exercise in diabetic patients[J]. Exp Diabetes Res,2012, 2012:941868.
[29] GOSWAMI P, GUPTA S, BISWAS JEndoplasmic reticul-um stress plays a key role in rotenone-induced apoptotic death of neurons[J]. Molneurobiol,2016, 53(1):285-298.
[30] GOUNDER S S, KANNAN S, DEVADOSS DImpaired transcriptional activity of Nrf2 in age-related myocardial oxidative stress is reversible by moderate exercise training[J]. PloS One, 2012, 7(9):e45697.
[31] GREGOR M F, HOTAMISLIGIL G S. Adipocyte stress: the endoplasmic reticulum and metabolic disease[J]. J Lipid Res,2007, 48(9):1905-1914.
[32] GUELINCKX I, DEVLIEGER R, MULLIE PEffect of lifestyle intervention on dietary habits, physical activity, and gestational weight gain in obese pregnant women: a randomized controlled trial[J]. Am J Clin Nutr,2010, 91(2):373-380.
[33] GUPTA S, AGARWAL A, SHARMA R K. The role of placental oxidative stress and lipid peroxidation in preeclampsia[J]. ObstetGynecol Surv,2005, 60(12):807-816.
[34] GUZEL E, ARLIER S, GUZELOGLU-KAYISLI OEndoplasmic reticulum stress and homeostasis in reproductive physiology and pathology[J]. Int J Mol Sci,2017, 18(4):792.
[35] HAN D, LERNER A G, WALLE L VIRE1alpha kinase activation modes control alternate endoribonuclease outputs to determine divergent cell fates[J]. Cell,2009, 138(3):562-575.
[36] HAN J, LI E, CHEN LThe CREB coactivator CRTC2 controls hepatic lipid metabolism by regulating SREBP1[J]. Nat,2015, 524(7564):243-246.
[37] HANDWERGER S, FREEMARK M. The roles of placental growth hormone and placental lactogen in the regulation of human fetal growth and development[J]. J Pediatr Endocrinol Metab,2000, 13(4):343-356.
[38] HARDING H P, NOVOA I, ZHANG Y HRegulated translation initiation controls stress-induced gene expression in mammalian cells[J]. MolCell, 2000, 6(5):1099-1108.
[39] HARDING H P, ZHANG Y, RON D. Protein translation and folding are coupled by an endoplasmic-reticulum-resident kinase [J]. Nat,1999, 397(6716):271-274.
[40] HAZE K, OKADA T, YOSHIDA HIdentification of the G13 (cAMP-response-element-binding protein-related protein) gene product related to activating transcription factor 6 as a transcriptional activator of the mammalian unfolded protein response[J]. Biochem J,2001, 355(pt1):19-28.
[41] HOTAMISLIGIL G S. Endoplasmic reticulum stress and atherosc ler-osis [J]. Nat Med,2010, 16(4):396-399.
[42] HOTAMISLIGILGS. Endoplasmic reticulum stress and the infla-mmatory basis of metabolic disease[J]. Cell,2010, 140(6):900-917.
[43] HUMMASTI S, HOTAMISLIGIL G S. Endoplasmic reticulum stress and inflammation in obesity and diabetes[J]. Circ Res,2010, 107(5):579-591.
[44] IWAWAKI T, AKAI R, YAMANAKA SFunction of IRE1 alpha in the placenta is essential for placental development and embryonic viability[J]. Proc Nat AcadSci USA, 2009, 106 (39):16657-16662.
[45] IWAWAKI T, HOSODA A, OKUDA TTranslational control by the ER transmembrane kinase/ribonuclease IRE1 under ER stress[J]. Nat Cell Biol,2001, 3(2):158-164.
[46] IWAWAKI T, OIKAWA D. The role of the unfolded protein response in diabetes mellitus[J]. Semin Immunopathol,2013, 35 (3): 333-350.
[47] JAWERBAUM. Placental endoplasmic reticulum stress and acidosis: relevant aspects in gestational diabetes[J]. Diabetologia, 2016, 59(10):2080-2081.
[48] JEON Y J, KIM J H, SHIN J I. Salubrinal-mediated upregulation of eIF2alpha phosphorylation increases doxorubicin sensitivity in MCF-7/ADR cells[J]. Mol Cells,2016, 39(2):129-135.
[49] KAMANA K C, SHAKYA S, ZHANG H. Gestational diabetes mellitus and macrosomia: a literature review[J]. Ann Nutr Metab,2015, 66 (Suppl 2):14-20.
[50] KASSAN M, GALAN M, CHOI S KEndoplasmic reticulum stress and microvascular endothelial dysfunction in diabetes[J]. J Diabetes Metab,2011, 2.
[51] KIM H J, JAMART C, DELDICQUE LEndoplasmic reticulum stress markers and ubiquitin-proteasome pathway activity in response to a 200-km run[J]. Med Sci Sports Exerc,2011, 43(1):18-25.
[52] KIM K, KIM Y H, LEE S HEffect of exercise intensity on unfolded protein response in skeletal muscle of rat[J]. Korean J Physiol Pharmacol,2014, 18(3):211-216.
[53] KIM S, JOE Y, JEONG S OEndoplasmic reticulum stress is sufficient for the induction of IL-1β production via activation of the NF-κB and inflammasome pathways[J]. Innate Immun,2014, 20(8):799-815.
[54] KING V, DAKIN R S, LIU LMaternal obesity has little effect on the immediate offspring but impacts on the next generation[J]. Endocrinol,2013, 154(7):2514-2524.
[55] KOHARA K T, POULIN F, KOHARA MAdipose tissue reduction in mice lacking the translational inhibitor 4E-BP1[J]. Nat Med,2001, (7):1128-1132.
[56] KOVALEVA I E, GARAEVA A A, CHUMAKOV P MIntermedin/adrenomedullin 2 is a stress-inducible gene controlled by activating transcription factor 4[J]. Gene,2016, 590(1):177-185.
[57] LAPPAS M, HIDEN U, DESOYE GThe role of oxidative stress in the pathophysiology of gestational diabetes mellitus[J]. Antioxid Redox Signal,2011, 15(12):3061-3100.
[58] LEE J, SUN C, ZHOU Yp38 MAPK-mediated regulation of Xbp1s is crucial for glucose homeostasis[J]. Nat Med,2011, 17(10):1251-1260.
[59] LEE S S, YOO J H, SO Y S. Effect of the low- versus high-intensity exercise training on endoplasmic reticulum stress and GLP-1 in adolescents with type 2 diabetes mellitus[J]. J Phys Ther Sci,2015, 27(10):3063-3068.
[60] LEGRY V, VAN ROOYEN D M, LAMBERT BEndoplasmic reticulum stress does not contribute to steatohepatitis in obese and insulin-resistant high-fat-diet-fed foz/foz mice[J]. ClinSci,2014, 127(7):507-518.
[61] LEITE C F, DO-NASCIMENTO S L, HELMO F RAn overview of maternal and fetal short and long-term impact of physical activity during pregnancy[J]. Arch GynecolObstet,2017, 295(2):273-283.
[62] LIN J, HANDSCHIN C, SPIEGELMAN B M. Metabolic control through the PGC-1 family of transcription coactivators[J]. Cell Metab, 2005, 1(6):361-370.
[63] LIONG S, LAPPAS M. Endoplasmic reticulum stress is increased in adipose tissue of women with gestational diabetes[J]. PloS one,2015, 10(4):e0122633.
[64] LIONG S, LAPPAS M. Endoplasmic reticulum stress regulates inflammation and insulin resistance in skeletal muscle from pregnant women[J]. Mole Cell Endocrinol,2016, 425(c):11-25.
[65] LIPSON K L, FONSECA S G, ISHIGAKI SRegulation of insulin biosynthesis in pancreatic beta cells by an endoplasmic reticulum-resident protein kinase IRE1[J]. Cell Metab, 2006, 4(3): 245-254.
[66] LUO Q, VISTE K, URDAY-ZAA J CMechanism of CREB recognition and coactivation by the CREB-regulated transcriptio-nal coactivator CRTC2[J]. Proc Natl Acad Sci USA,2012, 109 (51):20865-20870.
[67] LAPPAS M. Activation of inflammasomes in adipose tissue of women with gestational diabetes[J]. Mol Cell Endocrinol,2014, 382(1):74-83.
[68] LEE J M. Nuclear receptors resolve endoplasmic reticulum stress to improve hepatic insulin resistance[J]. Diabetes Metab J,2017, 41(1):10-19.
[69] MANZUR K, NAIM-SHUCHANA S. Physical activity and exercise during pregnancy[J]. Eur J Physiother,2013, 16(1):2-9.
[70] MASUOKA H C, TOWNES T M. Targeted disruption of the activating transcription factor 4 gene results in severe fetal anemia in mice[J]. Blood,2002, 99(3):736-745.
[71] MELO A M, BENATTI R O, IGNACIO-SOUZA L MHypothalamic endoplasmic reticulum stress and insulin resistance in offspring of mice dams fed high-fat diet during pregnancy and lactation[J]. Metabolism,2014, 63(5): 682-692.
[72] MIANI M, COLLI M L, LADRIERE LMild endoplasmic reticulum stress augments the proinflammatory effect of IL-1β in pancreatic rat β-cells via the IRE1α/XBP1s pathway[J]. Endocrinol, 2012, 153(7):3017-3028.
[73] MIZUUCHI M, CINDROVA-DAVIES T, OLOVSSON MPlacental endoplasmic reticulum stress negatively regulates transcription of placental growth factor via ATF4 and ATF6beta: implications for the pathophysiology of human pregnancy complications [J]. JPathol,2016, 238(4):550-561.
[74] MOTTOLA. The role of exercise in the prevention and treatment of gestational diabetes mellitus[J]. Curr Upp Sport Med Rep,2007, 6(6):381-386.
[75] MURALIMANOHARAN S, MALOYAN A, MYATT L. Mitoch-ondrial function and glucose metabolism in the placenta with 2 gestational diabetes mellitus: Role of MIR-143[J]. Clin Sci,2016, 36(9):8-9.
[76] NARKAR V A, FAN W, DOWNES MExercise and PGC-1alpha-independent synchronization of type I muscle metabolism and vasculature by ERRgamma[J]. Cell Metab,2011, 13(3):283-293.
[77] NISHITOH H, MATSUZAWA A, TOBIUME KSystematic identification of novel protein domain families associated with nuclearfunctions[J]. Genome Res,2002, 12(1):47-56.
[78] NOVOA I, ZENG H Q, HARDING H PFeedback inhibition of the unfolded protein response by GADD34-mediated dephosph-orylation of eIF2alpha[J]. J Cell Biol,2001, 153(5):1011-1022.
[79] NOVOA I, ZHANG Y, ZENG HStress-induced gene expression requires programmed recovery from translational repression[J]. EMBO J,2003, 22(5):1180-1187.
[80] OST M, COLEMAN V, KASCH JRegulation of myokine expression: Role of exercise and cellular stress[J]. Free radic BiolMed,2016, 98:78-89.
[81] OZCAN L, ERGIN A S, LU AEndoplasmic reticulum stress plays a central role in development of leptin resistance[J]. Cell Metab,2009, 9(1):35-51.
[82] PACHECO N L P, ANDERSEN A M N, JORGENSEN M K. Preeclampsia and breast cancer: The influence of birth characteristics[J]. Breast,2015, 24(5):613-617.
[83] PAGLIASSOTTI M J, KIM P Y, ESTRADA A LEndoplasmic reticulum stress in obesity and obesity-related disorders: An expanded view[J]. Metabolism,2016,65(9):1238-1246.
[84] PARK S W, ZHOU Y, LEE JThe regulatory subunits of PI3K, p85alpha and p85beta, interact with XBP-1 and increase its nuclear translocation[J]. Nat Med,2010, 16(4):429-437.
[85] PASSOS E, ASCENSAO A, MARTINS M JEndoplasmic Reticulum Stress Response in Non-alcoholic Steatohepatitis: The Possible Role of Physical Exercise[J]. Metab: Clinl and Exp,2015, 64(7):780-792.
[86] PEERI M, AMIRI S. Protective effects of exercise in metabolic disorders are mediated by inhibition of mitochondrial-derived sterile inflammation[J]. Med Hypotheses,2015, 85(6):707-709.
[87] PETREMAND J, BULAT N, BUTTY A CInvolvement of 4E-BP1 in the protection induced by HDLs on pancreatic beta-cells. [J]. MolEndocrinol,2009, 23(10):1572-1586.
[88] RANGEL-ALDAO R. The unfolded protein response, inflammat-ion, oscillators, and disease: a systemsbiology approach[J]. Endoplasmic Reticulum Stress Dis,2015, 2(1).
[89] RADAK Z, ISHIHARA K, TEKUS EExercise, oxidants, and antioxidants change the shape of the bell-shaped hormesis curve[J]. Redox Biol,2017, (12):285-290.
[90] RAIJMAKERS M T, DECHEND R, POSTON L. Oxidative stress and preeclampsia: rationale for antioxidant clinical trials[J]. Hypertension,2004, 44(4):374-380.
[91] RAMAMOORTHY T G, LAVERNY G, SCHLAGOWSKI A IThe transcriptional coregulator PGC-1beta controls mitochond-rial function and anti-oxidant defence in skeletal muscles[J]. NatCommuns,2015, 6:10210.
[92] RAYAVARAPU S, COLEY W, NAGARAJU K. Endoplasmic reticulum stress in skeletal muscle homeostasis and disease[J]. Curr Rheumatol Rep,2012, 14(3):238-243.
[93] REDMAN. The endoplasmic reticulum stress of placental impoverishment[J]. Am J Pathol,2008, 173(2):311-314.
[94] ROPELLE E R, PAULI J R, CINTRA D EAcute exercise modulates the Foxo1/PGC-1alpha pathway in the liver of diet-induced obesity rats[J]. J Physiol,2009, 587(Pt 9):2069-2076.
[95] RYCKMAN K K, SPRACKLEN C N, SMITH C JMaternal lipid levels during pregnancy and gestational diabetes: a systema-tic review and meta-analysis[J]. BJOG,2015, 122(5):643-651.
[96] SAN C W, WONG W T, ZHAO LPPARδ is required for exercise to attenuate endoplasmic reticulum stress and endothelial dysfunction in diabetic mice [J]. Diabetes,2017, 66(2): 519-528.
[97] SCHEUNER D, MIERDE D V, SONG BControl of mRNA translation preserves endoplasmic reticulum function in beta cells and maintains glucose homeostasis[J]. Nat Med,2005, 11(7):757-764.
[98] SCHEUNER D, SONG B, MCEWEN ETranslational control Is required for the unfolded protein response and In vivo glucose homeostasis[J]. Mol Cell,2001, 7(6):1165-1176.
[99] SEO H Y, KIM M K, MIN A KEndoplasmic reticulum stress -induced activation of activating transcription factor 6 decreases cAMP-stimulated hepatic gluconeogenesis via inhibition of CREB [J]. Endocrinol,2010, 151(2):561-568.
[100] SRIVASTAVA S P, DAVIES M V, KAUFMAN R J. Calcium depletion from the endoplasmic reticulum activates the double-stranded RNA-dependent protein kinase (PKR) to inhibit protein synthesis[J]. J Biol Chem,1995, 270(28):16619-16624.
[101] TOBIUME K, MATSUZAWA A, TAKAHASHI TASK1 is required for sustained activations of JNK/p38MAP kinases and apoptosis[J]. EMBO Rep,2001, 2(3):222-228.
[102] TONG G X, CHENG J, CHAI JAssociation between gestational diabetes mellitus and subsequent risk of cancer: a systematic review of epidemiological studies[J]. Asian Pac J Cancer P,2014, 15(10):4265-4269.
[103] URANO F, WANG X Z, BERTOLOTTI ACoupling of Stress in the ER to Activation of JNK Protein Kinases by Transmembrane Protein Kinase IRE1[J]. Sci,2000, 287(5453): 664-666.
[104] VALLERIE S N, FURUHASHI M, FUCHO RA predominant role for parenchymal c-Jun amino terminal kinase (JNK) in the regulation of systemic insulin sensitivity[J]. PloS One, 2008, 3(9):e3151.
[105] WANG Y, VERA L, FISCHER W HThe CREB coactivator CRTC2 links hepatic ER stress and fasting gluconeogenesis[J]. Nat,2009, 460(7254):534-537.
[106] WENGROD J C, GARDNER L B. Cellular adaptation to nutrient deprivation: crosstalk between the mTORC1 and eIF2alpha signaling pathways and implications for autophagy[J]. Cell cycle,2015, 14(16):2571-2577.
[107] WU J, KAUFMAN R J. From acute ER stress to physiological roles of the unfolded protein response[J]. Cell Death Differ,2006, 13(3):374-384.
[108] WU J, RUAS J L, ESTALL J LThe unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1α /ATF6α complex[J]. Cell Metab,2011, 13(2): 160-169.
[109] XU C, BAILLY-MAITRE B, REED J C. Endoplasmic reticulum stress: cell life and death decisions[J]. J Clin Invest,2005, 115(10):2656-2664.
[110] YAMAMOTO E, DONG Y F, KATAOKA KOlmesartan prevents cardiovascular injury and hepatic steatosis in obesity and diabetes, accompanied by apoptosis signal regulating kinase-1 inhibition[J]. Hypertens,2008, 52(3):573-580.
[111] YANG H T, LUO L J, CHEN W JIL-15 expression increas-ed in response to treadmill running and inhibited endoplasmic reticulum stress in skeletal muscle in rats[J]. Endocrine,2015, 48(1):152-163.
[112] YEO S, DAVIDGE S T. Possible beneficial effect of exercise, by reducing oxidative stress, on the incidence of preeclampsia [J]. J Womens Health Gend Based Med,2001, 10(10):983-989.
[113] YOKOI T, FUKUO K, YASUDA OApoptosis signal-regulating kinase 1 mediates cellular senescence induced by high glucose in endothelial cells[J]. Diabetes,2006, 55(6):1660-1665.
[114] YUAN T, LUO B L, WEI T HSalubrinal protects against cigarette smoke extract-induced HBEpC apoptosis likely via regulating the activity of PERK-eIF2α signaling pathway[J]. Arch of MedRes,2012, 43(7):522-529.
[115] YUNG H, KOROLCHUK S, TOLKOVSKY A MEndoplasmic reticulum stress exacerbates ischemia-reperfusion-induced apoptosis through attenuation of Akt protein synthesis in human choriocarcinoma cells[J]. FASEB J,2009, 21(3):872-884.
[116] YUNG H W, ALNAES-KATJAVIVI P, JONES C JPlacental endoplasmic reticulum stress in gestational diabetes: the potential for therapeutic intervention with chemical chaperones and antioxidants[J]. Diabetologia,2016, 59(10):2240-2250.
[117] YAN Z. Exercise, PGC-1alpha, and metabolic adaptation in skeletal muscle[J]. Appl Physiol Nutr Metab,2009, 34(3):424-427.
[118] ZADEGAN F G, GHAEDI K, KALANTAR S MCardiac differentiation of mouse embryonic stem cells is influenced by a PPAR gamma/PGC-1alpha-FNDC5 pathway during the stage of cardiac precursor cell formation[J]. Eur J Cell Biol,2015, 94(6): 257-266.
[119] ZENG L F, LU M, MORI KATF6 modulates SREBP2-mediated lipogenesis[J]. EMBO J,2004, 23(4):950-958.
[120] ZHANG K Z, WONG H N, SONG B BThe unfolded protein response sensor IRE1α is required at 2 distinct steps in B cell lymphopoiesis[J]. JClinInvest,2005, 115(2):268-281.
[121] ZHANG P, MCGRATH B, LI SThe PERK eukaryotic initiation factor 2 kinase is required for the development of the skeletal system, postnatal growth, and the function and viability of the pancreas[J]. MolCellBiol,2002, 22(11):3864-3874.
[122] ZINSZNER H, KURODA M, WANG X ZCHOP is implicated in programmed cell death in response to impaired function of the endoplasmic reticulum[J]. Genes Dev,1998, 12(7): 982-995.
Adaptive Mechanism of Endoplasmic Reticulum by Gestational Metabolic Diseases and Exercise Mediated
ZHU Xiao-feng1,2, MAYun1, YE Qun1,3, LIANG Chen1, FU Shan1,4
1.National Reserch Institate of Sport Medicine,Beijing 100061,China;2.Jiaxing University,Zhejiang 314000,China;3.Shanghai University of Sport,Shanghai 200438, China; 4.Wenzhou Medical University, Zhejiang 325035, China.
Gestational metabolic diseases share a common feature, which is the development of insulin resistance to pathological glucose and lipid metabolism disorders. It has thus led to vascular endothelial injury, placental inflammation and aggravated oxidative stress.. A variety of endogenous and exogenous cell damage will induce endoplasmic reticulum stress in endocrine organs, such as pancreas and placenta. Such damage to the internal environment of the body may lead to fetal programming susceptibility, thus adding to the risk of future development into metabolic diseases. Exercise can stimulate the endoplasmic reticulum to achieve a new metabolic balance, so as to adapt to the gestational metabolic stress. Appropriate exercise can alleviate oxidative stress, inflammatory response, mitochondrial dysfunction and calcium ion imbalance, which may account for the underlying mechanism of reconstructing endoplasmic reticulum balance in gestational metabolic diseases.
梁辰,女,副主任医师,硕士生导师,主要研究方向为运动与医务监督,E-mail:lclc3@163.com。
1002-9826(2018)03-0068-11
G804.7
A
2017-10-11;
2018-02-09
国家体育总局政府性基金资助项目(109031000000015J001);嘉兴市科技计划项目(2017AY33078)。
朱小烽,男,讲师,在读博士研究生,主要研究方向为妇幼体力活动与健康促进,E-mai:zhuxiaofeng102@126. com。
10.16470/j.csst.201803009
