表达猪流行性腹泻病毒保护性抗原重组乳酸杆菌的构建及鉴定
2018-06-05孙玉章许运斌王宏华孙明军蒋贻海
孙玉章,许运斌,王宏华,孙明军,蒋贻海
(1. 青岛蔚蓝生物股份有限公司,国家动物用保健品工程技术研究中心,山东青岛 266000;2. 遵义医学院,贵州省传染病与生物安全特色重点实验室,贵州遵义 563000;3. 中国动物卫生与流行病学中心,山东青岛 266032)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由冠状病毒科冠状病毒属猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种急性、高度接触性猪传染病,以水样腹泻、呕吐和脱水为主要临床特征[1]。本病1971年首次报道于英国,随后迅速在欧洲蔓延,目前全球范围内均有报道。我国1984年首次确认了该病的存在和流行[2]。PEDV可感染各种年龄的猪。哺乳仔猪、架子猪或育肥猪发病率可达100%,尤其是哺乳仔猪,受害最严重,而母猪发病率为15%~90%[3]。由于PEDV主要感染仔猪肠道组织黏膜并在小肠和结肠的绒毛上皮细胞浆中复制,因此局部黏膜免疫产生的抗原特异性分泌型免疫球蛋白A(secretory IgA,SIgA),理论上应具有更好的免疫潜力和免疫效果[4]。
研究证实,乳酸菌是诱导黏膜免疫极好的免疫佐剂和疫苗载体[5]。因此,本研究构建了表达PEDV表面纤突糖蛋白主要核心保护性抗原表位(COE)的重组乳酸菌基因工程菌株,以期为下一步体内重组乳酸杆菌抗PEDV黏膜免疫效果评价和口服疫苗制备提供试验依据。
1 材料与方法
1.1 病毒、载体与菌株
PEDV SG-1株:2016年分离自山东省寿光市某规模化养猪场,由本实验室鉴定并保存;乳酸菌基因工程菌株和穿梭表达载体pSIP等:吉林大学动物医学院兽医传染病教研室惠赠;pMD-18T载体:购自Takara(大连)有限公司;E.coli DH5α菌株及其感受态细胞:本实验室保存。
1.2 主要试剂
基因组总RNA提取试剂盒、质粒小提试剂盒、DNA凝胶回收与纯化试剂盒和DNA Ladder marker(DL2000、DL5000)等:购于天根生化科技(北京)有限公司;RT-PCR预混液、EcoR I、Xba I、Nhe I、Hind III和T4 DNA ligase等:购于Takara(大连)有限公司;氨苄青霉素、卡那霉素、氯霉素和红霉素等:购于北京鼎国昌盛生物技术责任有限公司;小鼠抗HIS标签单抗、辣根过氧化物酶(HRP)标记的羊抗鼠IgG:购于北京全式金生物技术有限公司;DAB显色试剂盒:购于武汉博士德生物工程有限公司。其他试剂均为国产分析纯。
1.3 PEDV主要保护性抗原表位的扩增
1.3.1 引物合成 根据PEDV SG-1株 S基因部分保护性抗原(499~638 aa,COE)的序列特点,设计1对扩增引物。上游引物P1:5´-TCA GCTAGC TTGCTTTTGACCTTGACGATG-3´( 含 有 Nhe I酶切位点);下游引物P2:5´-AGT AAGCTT TTAAGAAACGTCCGTGACACC-3´( 含 有 Hind III酶切位点)。引物由生工生物工程(上海)股份有限公司合成。
1.3.2 PEDV主要保护性抗原表位的扩增 将PEDV细胞培养液反复冻融3次后12 000 r/min离心;按基因组总RNA提取试剂盒(天根)说明书所列操作规程,提取病毒悬液总RNA;以此为模板反转录后进行PCR扩增,获得含有所设计酶切位点的目的片段。RT-PCR反应体系为:RT-PCR Mix 25 µL,P1 2µL,P2 2 µL,AMV RT enzyme 1 µL,Genome template 4 µL,RNase inhibitor 1 µL,ddH2O 15 µL。反应条件为:42 ℃ 60 min,95 ℃ 5 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,35 个循环;72 ℃ 10 min,4 ℃ 60 min。PCR产物经1%琼脂糖凝胶电泳观察。
1.4 重组乳杆菌载体的构建
将PCR产物按DNA凝胶回收与纯化试剂盒(天根)说明书所列操作程序,回收纯化后克隆于pMD-18T载体并转化至E.coli DH5α感受态细胞;挑取阳性菌落进行扩增并测序;将测序正确的阳性菌落扩大培养并提取质粒,经Nhe I、Hind III双酶切后,定向克隆于pSIP穿梭表达载体,并转化至E.coli DH5α感受态细胞;经抗性平板筛选阳性菌落后扩大培养,提取质粒并进行双酶切鉴定。
1.5 表达外源蛋白重组乳杆菌的构建
利用电转化仪,将pSIP-PEDV-S-COE转化至新鲜制备的乳酸杆菌基因工程菌感受态细胞中,经抗性平板筛选阳性菌落后扩大培养,提取质粒并进行Nhe I、Hind III双酶切鉴定。
1.6 重组乳酸杆菌的表达与Western-blot鉴定
挑取重组乳酸杆菌转化平板上的单菌落,接种于工作浓度的抗性MRS液体培养基中,37 ℃静置培养过夜;取过夜培养物,以1%比例接种于摇瓶中扩大培养,待OD600nm为0.3~0.5时,加入工作浓度的诱导剂,计时培养,间隔固定时间取样检测;将诱导表达后的菌液,以12 000 r/min离心,收集菌体,并用PBS重悬菌体沉淀,然后加入等量SDS-PAGE上样缓冲液,沸水浴10 min,最后进行SDS-PAGE电泳。
利用BIO-RAD半干式转膜仪,将凝胶中的蛋白条带转印至PVDF膜上,用ddH2O洗膜3次;将膜置于含5%脱脂奶粉的PBS,室温封闭2 h,PBST洗膜3次;加入1:3 000稀释的一抗(鼠抗HIS标签单抗),室温孵育2 h,PBST洗膜3次;加入1:5 000稀释的二抗(HRP标记的羊抗鼠IgG),室温孵育2 h,PBST洗膜3次;用DAB显色试剂盒显色并观察结果。
2 结果
2.1 PEDV主要保护性抗原表位的扩增
提取PEDV细胞培养液总RNA,按前述反应体系和条件进行RT-PCR,然后进行1%琼脂糖凝胶电泳,得到预期大小约500 bp的COE目的片段(图1)。
2.2 表达外源蛋白重组乳酸杆菌的鉴定
将pSIP-PEDV-S-COE电转化至新鲜制备的乳酸杆菌基因工程菌感受态细胞中,经抗性筛选后,小量扩增,提取质粒并进行Nhe I、Hind III双酶切鉴定,得到约500 bp的目的片段,与预期大小相符(图2)。
2.3 重组乳酸杆菌的表达及鉴定
重组乳酸杆菌pSIP-PEDV-COE经过夜培养并诱导表达后,取样进行SDS-PAGE电泳后转膜,利用抗HIS标签抗体进行Western blot检测,结果在约27 KD处检测到目的蛋白条带,且诱导4 h与8 h的蛋白表达量差异不显著(图3)。
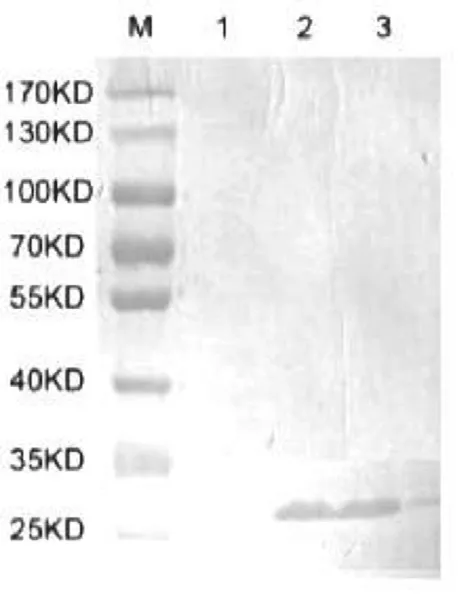
图3 Western blot检测
3 讨论
PEDV S蛋白是位于病毒粒子表面的纤突糖蛋白,能够结合仔猪肠道黏膜上的氨基肽酶N(Aminopeptidase N,APN)受体[6],从而介导PEDV与宿主细胞的吸附、融合,同时可以刺激宿主机体产生特异性中和抗体和细胞免疫途径。研究证实,S蛋白存在多个线性抗原表位[7-9],其中499~638aa位的核心抗原表位区COE在不同PEDV毒株中均比较保守,能诱导机体产生较高水平的中和抗体,因此COE是开发新型PEDV疫苗的重要靶位[10-13]。
由于PEDV对肠道组织具有亲嗜性,因此局部黏膜免疫可能在PED发展过程中发挥着至关重要的作用。哺乳动物的胃肠道黏膜上皮及固有层内均含有大量的免疫细胞及免疫分子,其能够通过SIgA和IgM阻止病原微生物在黏膜上皮层的粘附和定殖。作为食品安全级的乳酸菌,其不仅能够促进多种淋巴细胞的活化和多种细胞因子的分泌,还能作为免疫佐剂,诱导机体产生干扰素和提高肠道中非特异性IgA抗体水平。因此,将乳酸菌等益生菌作为被动黏膜免疫递送系统的外源载体具有广泛的应用前景。它可以通过口服等方式向目标动物肠道黏膜靶向传递抗原组分,从而刺激机体B淋巴细胞产生特异性抗体和Th1/Th2型平衡的免疫应答[14-15]。
4 结论
本研究将PEDV核心保护性抗原基因(COE)插入到穿梭表达载体并电转化至乳酸杆菌基因工程菌株内进行诱导培养,构建了表达PEDV部分保护性抗原COE的重组乳酸杆菌,以期通过乳酸菌本身的早期占位和天然抗菌功能,在仔猪肠道局部黏膜形成优势免疫区,从而预防和控制PED的发生和流行。本研究为进一步开展动物免疫保护试验和研发PED新型口服疫苗奠定了基础。
[1] STRAW B E,ZIMMERNAN J J,ALLAIRE S D, 等 .猪病学[M]. 赵德明等,译. 9版. 北京:中国农业大学出版社,2008:399-404.
[2] 宣华,邢德坤,王殿瀛,等. 应用猪胎肠单层细胞培养猪流行性腹泻病毒的研究[J]. 中国人民解放军兽医大学学报,1984,4(3):202-208.
[3] 甘孟侯,杨汉春. 中国猪病学[M]. 北京:中国农业出版社,2005:188-190.
[4] 杨倩. 黏膜免疫及其疫苗设计[M]. 北京:科学出版社,2016:4-9.
[5] SARAO L K,ARORA M. Probiotics,prebiotics,and microencapsulation:A review[J]. Critical reviews in food science and nutrition,2017,57(2):344-371.
[6] 高君恺,刘浩飞,杨倩. 猪流行性腹泻病毒的研究进展[J]. 南京农业大学学报,2014,37(1):1-5.
[7] CHANG S H,BAE J L,KANG T L,et al.Identification of the epitope region capable of inducing neutralizing antibodies against the porcine epidemic diarrhea virus[J]. Molecules and cells,2002,14:295-299.
[8] 孙东波,冯力,陈建飞,等. 猪流行性腹泻病毒CH/JL毒株S基因的克隆、序列分析及线性抗原表位区的鉴定[J]. 病毒学报,2007,23(3):381-384.
[9] LEE D K,PARK C K,KIM S H,et al. Heterogeneity in spike protein genes of porcine epidemic diarrhea viruses isolated in Korea[J]. Virus research,2010,149(2):175-182.
[10] 董丽娜,高凤山,许崇波,等. 表达猪流行性腹泻病毒COE基因的重组乳酸菌的构建与鉴定[J]. 畜牧兽医学报,2008,39(12):1743-1747.
[11] GE J W,LIU D Q,LI Y J. Construction of recombinant lactobacilli expressing the core neutralizing epitope(COE)of porcine epidemic diarrhea viruses and a fusion protein consisting of COE and Escherichia coli heat-labile enterotoxin B,and comparison of the immune responses by orogastric immunization[J]. Canadian journal of microbiology,2012,58(11):1258-1267.
[12] 向敏,张洁,高其双,等. 猪流行性腹泻病毒COE核酸疫苗的构建及免疫原性[J]. 中国兽医学报,2013,33(11):1627-1630.
[13] 宁昆,杨德全,葛菲菲,等. 猪流行性腹泻病毒COE抗原表位的原核表达及鉴定[J]. 动物医学进展,2014,35(11):25-28.
[14] RAMIREZ K,DITAMO Y,RODRIGUEZ L,et al.Neonatal mucosal immunization with a non-living,non-genetically modified Lactococcus lactic vaccine carrier induces systemic and local Th1-type immunity and protects against lethal bacterial infection[J]. Mucosal immunology,2010,3(2):159-171.
[15] POORBAGHI S L,DADRAS H,GHEISA H R,et al.Effects of Lactobacillus acidophilus and inulin on faecal viral shedding and immunization against H9N2 Avian in fluenza virus[J]. Journal of applied microbiology,2013,116:667-676.
