鳗弧菌免疫诱导牙鲆IL-1β、IFN-γ和 TNF-α 基因表达变化
2018-06-05钱晓宇王占飞绳秀珍唐小千战文斌
钱晓宇,王占飞,绳秀珍,唐小千,邢 婧,战文斌
(中国海洋大学水产动物病害与免疫学实验室,山东青岛 266003)
鱼类的黏膜免疫系统相对于陆生动物具有更重要的作用,受到的关注越来越多[1-2]。在高等脊椎动物的黏膜免疫中,多聚免疫球蛋白受体(pIgR)能够介导分泌型免疫球蛋白通过转胞吞作用运输到黏膜表面,发挥中和及免疫清除病原的功能,也可以独自在体表黏液中发挥非特异性免疫功能[3]。硬骨鱼pIgR在结构和功能上与哺乳动物有很多相似之处[4],也具有转运黏膜Igs的功能[5-6],可以在体外结合多种细菌[7],发挥免疫防御作用。研究发现多种鱼类在免疫或感染后pIgR表达量显著上调[8-11],表明在病原刺激下硬骨鱼pIgR应答表达变化趋势与高等动物相似[12]。对哺乳动物的研究表明,IFN-γ、IL-1β和 TNF-α可以调节 pIgR 转录[13-14]。其中:IFN-γ可以通过上皮细胞上的受体,激活细胞内的信号传导及转录激活因子1(STAT1)。STAT1与干扰素调节因子(IRF)上的相应位点结合引发IRF转录和表达。IRF进入细胞核与PIGR基因1号外显子上的相应位点结合引发pIgR的转录[14-15];IL-1可以活化一个MyD88依赖性信号通路,经NF-κB途径调节pIgR的转录[15];TNF-α可以通过上皮细胞膜上的受体,激活细胞内NF-κB通路,进而引发pIgR的转录和表达[16]。鉴于硬骨鱼pIgR在结构与功能上与高等脊椎动物的相似性,因而推断在哺乳动物pIgR调控过程中起作用的细胞因子也能调控硬骨鱼pIgR的表达,但是目前还缺乏相关研究资料。
本研究用灭活鳗弧菌(Vibrio anguillarum)浸泡和注射两种免疫方式免疫牙鲆(Paralichthys olivaceus),采用实时荧光定量PCR(qPCR),分析各组织中细胞因子IFN-γ、IL-1β和TNF-α表达量的动态变化,以期为研究鱼类细胞因子IFN-γ、IL-1β和TNF-α对pIgR的表达调控提供资料。
1 材料与方法
1.1 疫苗制备
将实验室保藏的鳗弧菌,经连续划线法在BHI固体培养基上28 ℃条件下培养24 h;挑取单菌落至BHI液体培养基中,28 ℃扩大培养24 h;菌液经8 000 ×g离心10 min后回收菌体,再用无菌磷酸盐缓冲液(PBS,pH7.4)洗涤3次;在终浓度为0.5%福尔马林中,室温放置24 h灭活,随后离心回收菌体;清洗3次后,取200 µL涂板验证是否完全灭活;将完全灭活的细菌放到4 ℃冰箱保存备用。
1.2 免疫和样品采集
将健康牙鲆在实验室暂养1周,使其适应环境。期间连续曝气,保持合适水温,每天换水1/3。适应环境后,将牙鲆随机分成4组用于免疫:第1组腹腔注射浓度为1×108CFU/mL的鳗弧菌灭活疫苗(PBS稀释),每尾100 μL;第2组每尾腹腔注射100 μL PBS作为注射组对照;第3组在用海水稀释的浓度为1×108CFU/mL的灭活菌液中连续充气浸泡30 min;第4组在含有100 μL PBS的海水中浸泡30 min,作为浸泡组对照。
4组鱼分别于免疫前,以及免疫后的4、8、12、24、48、72、96 h取样。每组随机取鱼3尾,解剖取皮肤、鳃、前肠、中肠、后肠、肝、脾和头肾8种组织;分别混合3尾鱼的各组织,提取总RNA,反转录得到cDNA模板;测定cDNA浓度并将其调整一致,−20 ℃保存备用。
1.3 荧光定量PCR引物设计
根据NCBI中公布的牙鲆肿瘤坏死因子(TNF-α)、干扰素(IFN-γ)、白介素(IL-1β)及核糖体RNA(18S RNA)基因序列(表1),利用Primer Premier 5.0 软件设计特异性引物;先在普通PCR仪上扩增,再通过琼脂糖电泳检测PCR产物。电泳条带单一表明引物特异性高,可作为荧光定量PCR引物。
1.4 荧光定量PCR及数据分析
以反转录得到的cDNA为模板,18S rRNA为内参,进行实时荧光定量PCR检测。使用SYBR Green I Master mix试剂盒在荧光定量PCR仪上扩增,所得Ct值利用2-△△Ct法计算免疫后不同时间点组织中的细胞因子(TNF-α、IL-1β、IFN-γ) 表 达 量。 利 用SPSS 19.0统计软件中的单因素方差(one-way ANOVA)分析基因表达量差异(显著性水平为0.05)。
2 结果
2.1 免疫前后IL-1β变化
免疫前及免疫后96 h内,试验组牙鲆皮肤、鳃、前肠、中肠、后肠、肝脏、脾和头肾中的IL-1β表达量呈现先上升后下降趋势(图1-A—图1-H);除注射组牙鲆皮肤中IL-1β上调速度稍慢外(图1-A),其他组在4—72 h之间显著高于对照组水平。在黏膜免疫组织皮肤和鳃中,浸泡组IL-1β表达量在免疫后12 h达到峰值,注射组在24 h达到峰值,浸泡组峰值(比对照组高12倍和9倍)高于注射组(比对照组高9倍和6倍)(图1-A,图1-B);而在系统免疫组织脾和头肾中的情况则相反,注射组IL-1β表达量在12 h达到峰值(上调50~60倍), 而浸泡组在24 h达到峰值(上调10倍左右)(图1-G,图1-H);其他组织中,两种免疫处理组的IL-1β表达量同时达到峰值,但注射组高于浸泡组(图1-C—图1-F)。

表1 牙鲆细胞因子表达分析所用引物
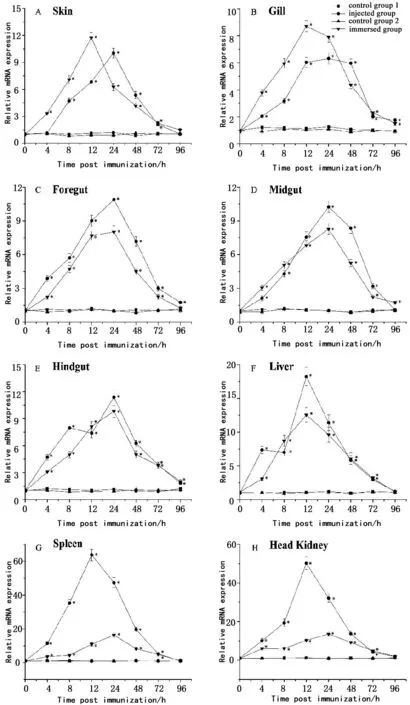
图1 鳗弧菌灭活疫苗免疫前后牙鲆各组织中IL-1β表达量的变化
2.2 免疫前后IFN-γ变化
在免疫后96 h内,IFN-γ基因变化量也呈现出先上升后下降趋势,且在免疫后4~72 h期间,免疫组显著高于对照组(图2-A—图2-H)。在浸泡组皮肤、鳃以及注射组鳃、肝脏和脾脏中,IFN-γ表达量在免疫后12 h达到峰值(图2-A,图2- B,图2-F,图2-G),其余组织中的IFN-γ表达量皆在24 h达到峰值(图2-C—图2-E,图2-H)。浸泡免疫组皮肤、鳃和肝脏中的IFN-γ应答较强,达到对照组的15~20倍(图2-A,图2-B,图2-F);注射组头肾和脾脏中的IFN-γ表达量是对照组的30倍左右(图2-G,图2-H)。但是,两种免疫方式在肠道中引起的IFN-γ表达量只有对照组的6~8倍(图2-C—图2-E)。
2.3 免疫前后TNF-α变化
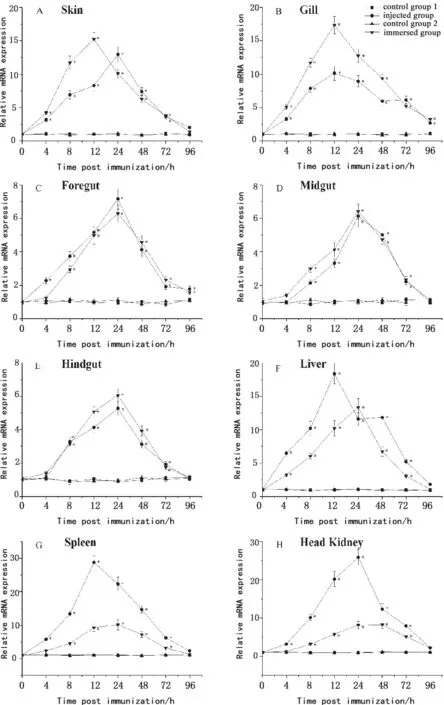
图2 鳗弧菌灭活疫苗免疫前后牙鲆各组织中IFN-γ表达量的变化
免疫后牙鲆各组织内的TNF-α基因变化同样呈现先上升后下降趋势(图3-A—图3-H)。浸泡组皮肤和头肾中的TNF-α表达量在4 h后开始显著高于对照组(图3-A—图3-H),皮肤中的12 h时达到峰值(图3-A),其他组织均从8 h后开始显著上升(图3-B—图3-E,图3-G)。如:肝脏中的TNF-α表达量12 h后才显著高于对照组(图3-F),48 h时达到峰值(图3-F),其他组织中的皆在24 h时达到峰值。注射组脾和头肾中的TNF-α表达量4 h后开始显著上升(图3-G,图3-H),其他组织均在8 h后开始显著高于对照组(图3-A—图3-F)。两种免疫方式引起的TNF-α应答变化相差不大,皆比对照组高2~4倍,但在皮肤和鳃中,浸泡组的TNF-α表达量高于注射组,其他组织则相反。

图3 鳗弧菌灭活疫苗免疫前后牙鲆各组织中TNF-α表达量的变化
3 讨论
本研究结果显示,鳗弧菌注射和浸泡免疫后,牙鲆各组织中的IL-1β、TNF-α和IFN-γ基因表达量相对于对照组都有显著增加,说明两种方式都能有效引起牙鲆3种细胞因子的免疫应答。其中,在皮肤和鳃中,浸泡方式引起的3种细胞因子免疫应答均比注射组启动早,且峰值高于注射组。这可能是由于鳃和皮肤直接暴露于水中,浸泡免疫方式可以直接且快速刺激这两个部位在短时间内产生局部免疫应答。相反,在头肾和脾脏中,注射免疫引起的IL-1β、TNF-α和IFN-γ基因应答启动较早,且峰值远高于浸泡组,原因可能是浸泡法无法直接刺激脾脏和头肾,因此产生的应答要晚于注射组。这与宋晓青等[17]的研究结果相似。在前、中、后肠以及肝脏中,注射组引起的IL-1β和TNF-α变化要稍早于浸泡组,而在中肠和肝脏中,浸泡组引起的IFN-γ上升速度和峰值都高于注射组。
IL-1β是IL-1家族中的一员,其本身并不具有生物学活性,需要与半胱氨酸天冬氨酸蛋白酶1(caspase-1)结合,加工成熟后才具有活性并参与到免疫调节中[18]。IL-1β可由单核细胞、巨噬细胞、树状细胞等产生,而细胞因子和微生物产物等很多物质都可以引起IL-1β基因的大量表达。IL-1β是炎症反应中的重要因子,常被当作免疫刺激发生的阳性标志[19]。目前对鱼类IL-1β的研究表明,在LPS刺激下,体外培养的虹鳟白细胞中,IL-1β表达量显著升高[20]。LPS还可在体外诱导鲤鱼头肾白细胞[21],以及鲈头肾、鳃白细胞[22]增强IL-1β的表达。本研究发现在浸泡和腹腔注射灭活鳗弧菌后,牙鲆各组织内IL-1β表达相对于对照组都显著上调,与石斑鱼[23]、半滑舌蹋[24]以及大西洋鲑[25]中的研究结果一致。Hayashi等[26]发现IL-1β可以在体外刺激HT-29细胞系中pIgR阳性细胞的增殖并上调pIgR表达,而IL-1β也可以上调兔泪腺腺泡和上皮细胞中的pIgR表达[27-28],IL-1β和IFN-γ在HT-29细胞系上对pIgR的表达调节表现出协同作用[29]。因此,本研究中IL-1β的上调表达可能是浸泡和腹腔注射灭活鳗弧菌后pIgR显著上调表达的原因之一,但还有待于进一步研究。
IFN-γ是生物体内重要的免疫调节因子,具有广谱抗病毒功能,可以通过促进MHCⅠ类及Ⅱ类抗原的加工提呈,促使CD4+B细胞向TH1细胞分化等过程,来实现对生物体免疫功能的调节。研究证明,重组的干扰素可以刺激HT-29细胞产生更多的pIgR[30-33]。本研究发现,经浸泡和注射免疫后,牙鲆各组织IFN-γ表达量显著上升,变化趋势与注射减毒爱德华氏菌后斑马鱼脾脏中IFN-γ的变化趋势一致[34],但IFN-γ调节鱼类pIgR表达的直接证据还有待于通过阻断剂阻断IFN-γ表达[31]等手段抑制pIgR表达来证明。
TNF-α由活化的单核细胞、巨噬细胞和T细胞分泌,因可以在体内抑制并杀伤肿瘤细胞而得名。除了能使肿瘤细胞发生出血性坏死外,TNF-α还可以参与机体炎性反应和免疫应答的调节,具有促进细胞生长、分化、凋亡等重要作用[35]。本研究中,浸泡和注射免疫灭活鳗弧菌都引起了牙鲆各组织TNF-α上调表达,但是TNF-α的变化幅度比IL-1β和IFN-γ要小,这可能与TNF-α自身的特性有关。因为TNF-α表达量过高也会破坏机体的稳态,造成病理损伤[36]。体外试验证明,在急性和长期暴露于TNF-α条件下,HT-29细胞中的pIgR均会发生上调表达[37-39]。因此,本研究的TNF-α表达动态结果为深入研究TNF-α对pIgR的调控提供了资料。
本研究发现,鳗弧菌免疫后,IL-1β、IFN-γ和TNF-α等细胞因子的表达显著上调,因此在硬骨鱼中 IL-1β、IFN-γ和 TNF-α 3 种因子都可能具有调节pIgR表达的作用。灭活鳗弧菌免疫诱导这些细胞因子上调,进而通过IL-1β、IFN-γ和TNF-α相关的STAT1[14]或NF-κB[15-16]等途径,促使牙鲆体内pIgR发生上调表达,但是牙鲆体内细胞因子与pIgR变化之间的关系,以及这3种细胞因子对鱼类pIgR表达的调控机制还有待研究。
[1] DANILOVA N,BUSSMANN J,JEKOSCH K,et al.The immunoglobulin heavy-chain locus in zebrafish:identification and expression of a previously unknown isotype,immunoglobulin Z[J]. Nature immunology,2005,6(3):295-302.
[2] HANSEN J D,LANDIS E D,PHILLIPS R B.Discovery of a unique Ig heavy-chain isotype(IgT)in rainbow trout:Implications for a distinctive B cell developmental pathway in teleost fish[J]. Proceedings of the national academy of sciences of the United States of America,2005,102(19):6919-6924.
[3] PHALIPON A,CORTHÉSY B. Novel functions of the polymeric Ig receptor:well beyond transport of immunoglobulins[J]. Trends in immunology,2003,24(2):55-58.
[4] KAETZEL C S. Coevolution of mucosal immunoglobulins and the polymeric immunoglobulin receptor:evidence that the commensal microbiota provided the driving force[J]. Isrn immunology,2014,2014:1-20.
[5] ZHANG Y A,SALINAS I,LI J,et al. IgT,a primitive immunoglobulin class specialized in mucosal immunity[J]. Nature immunology,2010,1(9):827-836.
[6] HAMURO K,SUETAKE H,SAHA N R,et al.A teleost polymeric Ig receptor exhibiting two Ig-like domains transports tetrameric IgM into the skin[J]. Journal of immunology,2007,178(9):5682-5689.
[7] KELLY C,TAKIZAWA F,SUNYER J O,et al.Rainbow trout(Oncorhynchus mykiss)secretory component binds to commensal bacteria and pathogens[J].Scientific reports,2017,7:1-9.
[8] 王磊. 鲤鱼多聚免疫球蛋白受体(cpIgR)功能的研究[D]. 济南:山东师范大学,2009.
[9] WANG L,ZHANG J,KONG X,et al. Molecular characterization of polymeric immunoglobulin receptor and expression response to Aeromonas hydrophila challenge in Carassius auratus[J]. Fish & shellfish immunology,2017,70:372-380.
[10] YU Y Y,LIU Y Z,LI H L,et al. Polymeric immunoglobulin receptor in dojo loach(Misgurnus anguillicaudatus):Molecular characterization and expression analysis in response to bacterial and parasitic challenge[J]. Fish & shell fish immunology,2018,73:175-184.
[11] 丁冰洁,绳秀珍,唐小千,等. 大菱鲆多聚免疫球蛋白受体基因的克隆及表达分析[J]. 中国水产科学,2013,178(4):792-801.
[12] WIELAND W H,ORZAEZ D,LAMMERS APARMENTIER H K,et al. A functional polymeric immunoglobulin receptor in chicken(Gallus gallus)indicates ancient role of secretory IgA in mucosal immunity[J]. Biochemical journal,2004,380(3):669-676.
[13] JOHANSEN F E,BRANDTZAEG P. Transcriptional regulation of the mucosal IgA system[J]. Trends in immunology,2004,25(3):150-157.
[14] KAETZEL C S. The polymeric immunoglobulin receptor:bridging innate and adaptive immune responses at mucosal surfaces[J]. Immunological reviews,2005,206(1):83-99.
[15] JOHANSEN F E,KAETZEL C. Regulation of the polymeric immunoglobulin receptor and IgA transport:new advances in environmental factors that stimulate pIgR expression and its role in mucosal immunity[J]. Mucosal immunology,2011,4(6):598-602.
[16] SCHNEEMAN T A,BRUNO M E,SCHJERVEN H,et al. Regulation of the polymeric Ig receptor by signaling through TLRs 3 and 4:linking innate and adaptive immune responses[J]. Journal of immunology,2005,175(1):376-384.
[17] 宋晓青,邢婧,战文斌. 牙鲆经注射和浸泡免疫鳗弧菌灭活疫苗后7种免疫相关基因表达的变化[J]. 中国水产科学,2014,21(4):747-758.
[18] DOCKRELL H M. The Cytokine Handbook[J].Immunology,1993,78(2):339.
[19] ENGELSMA M Y,HUISING M O,MUISWINKEL W B V,et al. Neuroendocrine–immune interactions in fish:a role for interleukin-1[J]. Veterinary immunology& immunopathology,2002,87(3/4):467-479.
[20] ZOU J,HOLLAND J,PLEGUEZUELOS O,et al.Factors influencing the expression of interleukin-1β in cultured rainbow trout(Oncorhynchus mykiss)leucocytes[J]. Developmental & comparative immunology,2000,24(6/7):575-582.
[21] FUJIKI K,SHIN D H,NAKAO M,et al. Molecular cloning and expression analysis of carp(Cyprinus carpio)interleukin-1 beta,high affinity immunoglobulin E Fc receptor gamma subunit and serum amyloid A[J].Fish & shell fish immunology,2000,10(3):229-242.
[22] SCAPIGLIATI G,BUONOCORE F,BIRD S,et al. Phylogeny of cytokines:molecular cloning and expression analysis of sea bass Dicentrarchus labrax interleukin-1beta[J]. Fish & shellfish immunology,2001,11(8):711-726.
[23] WEI Y C,PAN T S,CHANG M X,et al. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish,the orange-spotted grouper Epinephelus coioides[J].Veterinary immunology & immunopathology,2011,141(3/4):173-182.
[24] YU Y,ZHONG Q W,ZHANG Q Q,et al. Fulllength sequence and expression analysis of a myeloid differentiation factor 88(MyD88)in half-smooth tongue sole Cynoglossus semilaevis[J]. International journal of immunogenetics,2009,36(3):173-182.
[25] HAUGLAND O,TORGERSEN J,SYED M,et al.Expression pro files of in flammatory and immune-related genes in Atlantic salmon(Salmo salar L)at early time post vaccination[J]. Vaccine,2005,23(48/49):5488-5499.
[26] HAYASHI M,TAKENOUCHI N,ASANO M,et al.The polymeric immunoglobulin receptor(secretory component)in a human intestinal epithelial cell line is up-regulated by interleukin-1[J]. Immunology,1997,92(2):220-225.
[27] KELLEHER R S,HANN L E,EDWARDS J A,et al.Endocrine,neural,and immune control of secretory component output by lacrimal gland acinar cells[J].Journal of immunology,1991,146(10):3405.
[28] LAMBERT R W,KELLEHER R S,WICKHAM L A,et al. Neuroendocrinimmune modulation of secretory component production by rat lacrimal,salivary,and intestinal epithelial cells[J]. Investigative ophthalmology& visual science,1994,35(3):1192.
[29] KVALE D,BRANDTZAEG P. Constitutive and cytokine induced expression of HLA molecules,secretory component,and intercellular adhesion molecule-1 is modulated by butyrate in the colonic epithelial cell line HT-29[J]. Gut,1995,36(5):737.
[30] SOLLID L M,KVALE D,BRANDTZAEG P,et al.Interferon-gamma enhances expression of secretory component,the epithelial receptor for polymeric immunoglobulins[J]. Journal of immunology,1987,138(12):4303.
[31] PISKURICH J F,FRANCE J A,TAMER C M,et al. Interferon-γ induces polymeric immunoglobulin receptor mRNA in human intestinal epithelial cells by a protein synthesis dependent mechanism[J]. Molecular immunology,1993,30(4):413-421.
[32] PISKURICH J F,YOUNGMAN K R,PHILLIPS K M,et al. Transcriptional regulation of the human polymeric immunoglobulin receptor gene by interferon-gamma[J].Molecular immunology,1997,34(1):75.
[33] KRAJCI P,TASKÉN K,KVALE D,et al. Interferongamma stimulation of messenger RNA for human secretory component(poly-Ig receptor)depends on continuous intermediate protein synthesis[J]. Scandinavian journal of immunology,1993,37(2):251.
[34] YANG D,LIU Q,NI C,et al. Gene expression profiling in live attenuated Edwardsiella tarda vaccine immunized and challenged zebrafish:Insights into the basic mechanisms of protection seen in immunized fish[J].Developmental & comparative immunology,2013,40(2):132-141.
[35] CAMINERO A,COMABELLA M,MONTALBAN X.Tumor necrosis factor alpha(TNF-α),anti-TNF-α and demyelination revisited:an ongoing story[J]. Journal of neuroimmunology,2011,234(1/2):1-6.
[36] STADTMUELLER B M,YANG Z,HUEYTUBMAN K E,et al. Biophysical and biochemical characterization of avian secretory component provides structural insights into the evolution of the polymeric ig receptor[J]. Journal of immunology,2016,197(4):1408.
[37] KVALE D,LØVHAUG D,SOLLID L M,et al. Tumor necrosis factor-alpha up-regulates expression of secretory component,the epithelial receptor for polymeric Ig[J].Journal of immunology,1988,140(9):3086.
[38] KVALE D,BRANDTZAEG P,LØVHAUG D. Upregulation of the Expression of Secretory Component and HLA Molecules in a Human Colonic Cell Line by Tumour Necrosis Factor-αand Gamma Interferon[J].Scandinavian journal of immunology,1988,28(3):351-357.
[39] BRUNO M E,KAETZEL C S. Long-term exposure of the HT-29 human intestinal epithelial cell line to TNF causes sustained up-regulation of the polymeric Ig receptor and proinflammatory genes through transcriptional and posttranscriptional mechanisms[J].Journal of immunology,2005,174(11):7278-7284.
